
专题06 盐类的水解(考点清单)(讲+练)-2024-2025学年高二化学上学期期中考点大串讲(人教版2019选择性必修1)
展开
这是一份专题06 盐类的水解(考点清单)(讲+练)-2024-2025学年高二化学上学期期中考点大串讲(人教版2019选择性必修1),共19页。试卷主要包含了盐类水解的概念,盐类水解的实质,盐类水解的规律,盐类水解程度大小比较规律,制备无机化合物,某些离子的去除,去油污,化肥的施用等内容,欢迎下载使用。
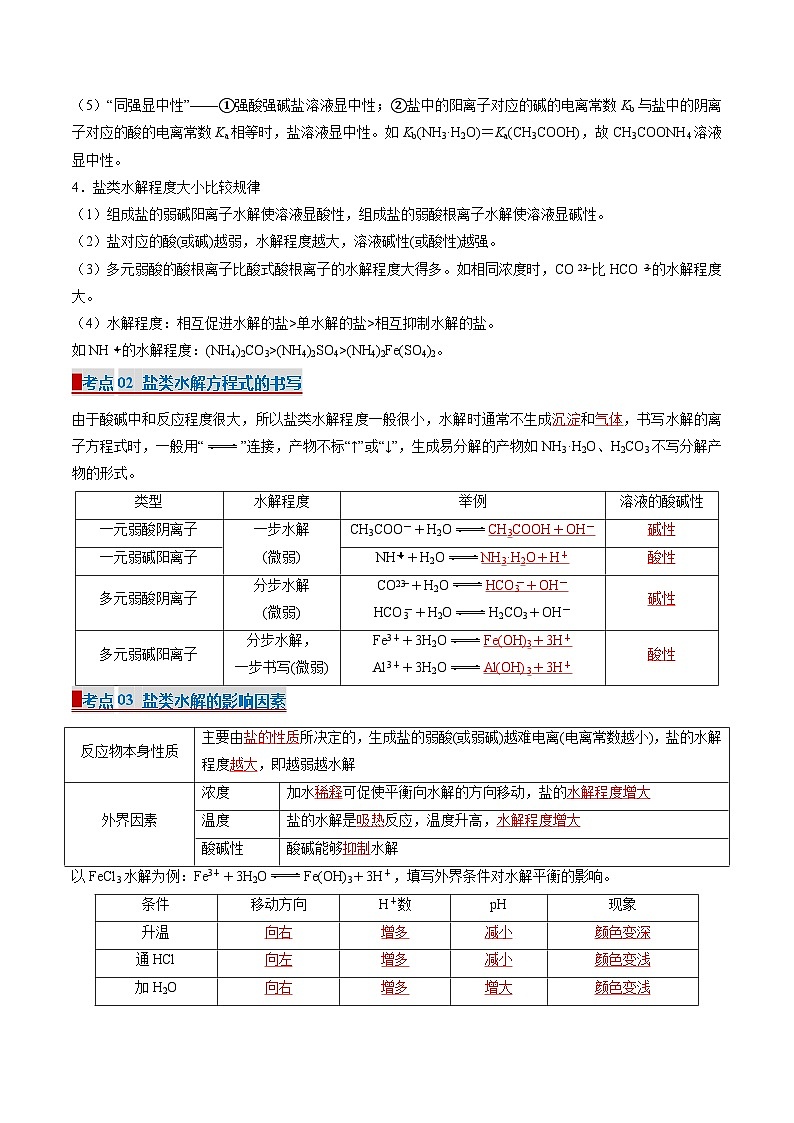
▉考点01 盐类的水解及其规律
1.盐类水解的概念
在水溶液中,盐电离出来的离子与水电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
2.盐类水解的实质
盐电离→eq \b\lc\{\rc\}(\a\vs4\al\c1(弱酸的阴离子→结合H+,弱碱的阳离子→结合OH-))→破坏了水的电离平衡→水的电离程度增大→溶液呈碱性、酸性或中性。
3.盐类水解的规律:
(1)“有弱才水解,无弱不水解”——盐中有弱酸阴离子或弱碱阳离子才水解,若没有,则是强酸强碱盐,不发生水解反应。
(2)“越弱越水解”——弱酸阴离子对应的酸越弱,水解程度越大;弱碱阳离子对应的碱越弱,其水解程度越大。如:碳酸的酸性大于次氯酸,则相同浓度的NaHCO3溶液的水解程度小于NaClO溶液。
(3)“都弱都水解”——弱酸弱碱盐电离出的弱酸阴离子和弱碱阳离子都发生水解,且相互促进。
(4)“谁强显谁性”——当盐中的阴离子对应的酸比阳离子对应的碱更容易电离时,水解后盐溶液呈酸性,反之,呈碱性,即强酸弱碱盐显酸性,强碱弱酸盐显碱性。如:碳酸的电离常数Ka1小于NH3·H2O的电离常数Kb,故NH4HCO3溶液显碱性。
(5)“同强显中性”——①强酸强碱盐溶液显中性;②盐中的阳离子对应的碱的电离常数Kb与盐中的阴离子对应的酸的电离常数Ka相等时,盐溶液显中性。如Kb(NH3·H2O)=Ka(CH3COOH),故CH3COONH4溶液显中性。
4.盐类水解程度大小比较规律
(1)组成盐的弱碱阳离子水解使溶液显酸性,组成盐的弱酸根离子水解使溶液显碱性。
(2)盐对应的酸(或碱)越弱,水解程度越大,溶液碱性(或酸性)越强。
(3)多元弱酸的酸根离子比酸式酸根离子的水解程度大得多。如相同浓度时,COeq \\al(2-,3)比HCOeq \\al(-,3)的水解程度大。
(4)水解程度:相互促进水解的盐>单水解的盐>相互抑制水解的盐。
如NHeq \\al(+,4)的水解程度:(NH4)2CO3>(NH4)2SO4>(NH4)2Fe(SO4)2。
▉考点02 盐类水解方程式的书写
由于酸碱中和反应程度很大,所以盐类水解程度一般很小,水解时通常不生成沉淀和气体,书写水解的离子方程式时,一般用“”连接,产物不标“↑”或“↓”,生成易分解的产物如NH3·H2O、H2CO3不写分解产物的形式。
▉考点03 盐类水解的影响因素
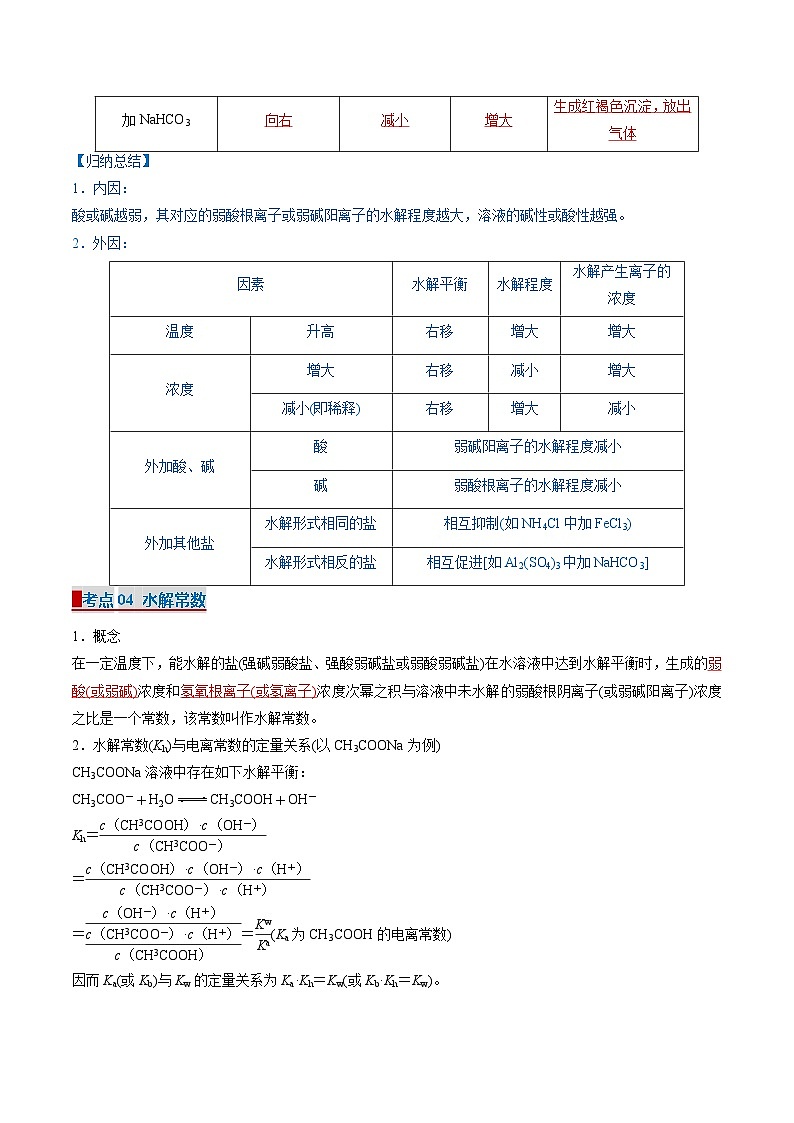
以FeCl3水解为例:Fe3++3H2OFe(OH)3+3H+,填写外界条件对水解平衡的影响。
【归纳总结】
1.内因:
酸或碱越弱,其对应的弱酸根离子或弱碱阳离子的水解程度越大,溶液的碱性或酸性越强。
2.外因:
▉考点04 水解常数
1.概念
在一定温度下,能水解的盐(强碱弱酸盐、强酸弱碱盐或弱酸弱碱盐)在水溶液中达到水解平衡时,生成的弱酸(或弱碱)浓度和氢氧根离子(或氢离子)浓度次幂之积与溶液中未水解的弱酸根阴离子(或弱碱阳离子)浓度之比是一个常数,该常数叫作水解常数。
2.水解常数(Kh)与电离常数的定量关系(以CH3COONa为例)
CH3COONa溶液中存在如下水解平衡:
CH3COO-+H2OCH3COOH+OH-
Kh=eq \f(c(CH3COOH)·c(OH-),c(CH3COO-))
=eq \f(c(CH3COOH)·c(OH-)·c(H+),c(CH3COO-)·c(H+))
=eq \f(c(OH-)·c(H+),\f(c(CH3COO-)·c(H+),c(CH3COOH)))=eq \f(Kw,Ka)(Ka为CH3COOH的电离常数)
因而Ka(或Kb)与Kw的定量关系为Ka·Kh=Kw(或Kb·Kh=Kw)。
如Na2CO3的水解常数Kh=eq \f(Kw,Ka2);
NaHCO3的水解常数Kh=eq \f(Kw,Ka1)。
NH4Cl的水解常数Kh=eq \f(Kw,Kb)(Kb为NH3·H2O的电离常数)。
3.水解常数是描述能水解的盐水解平衡的主要参数。水解常数只受温度的影响;因水解反应是吸热反应,故水解常数随温度的升高而增大。
▉考点05 盐类水解的应用
1.判断酸碱性
(1)判断盐溶液的酸碱性——谁强显谁性,同强显中性
如:FeCl3溶液显酸性,原因是Fe3++3H2O ⇌ Fe(OH)3+3H+
(2)判断酸(碱)的强弱
如:NaX、NaY、NaZ三种盐pH分别为7、9、10,
则酸性HX>HY>HZ
2.某些盐溶液的配制、保存
(1)在配制FeCl3、AlCl3、CuCl2、SnCl2等溶液时为防止水解,常先将盐溶于少量相应的酸中,再加蒸馏水稀释到所需浓度。
(2)Na2SiO3、Na2CO3等不能贮存于带磨口玻璃塞的试剂瓶中。因Na2SiO3、Na2CO3水解呈碱性,产生较多OH-,能腐蚀玻璃生成Na2SiO3,使瓶口和瓶塞粘在一起。
3.判断盐溶液蒸干时所得的产物
(1)弱碱易挥发性酸盐加热蒸干通常得到氢氧化物固体(除铵盐),再灼烧生成氧化物。例如高温蒸发浓缩FeCl3溶液,最后灼烧,得到的固体物质是Fe2O3。又如若要得到MgCl2固体,可将MgCl2·6H2O在HCl气氛中加热脱水。
(2)强碱易挥发性酸盐加热蒸干可以得到同溶质固体。例如高温蒸发浓缩Na2CO3溶液,最后灼烧,得到的固体物质是Na2CO3。
(3)还原性盐在蒸干时会被O2氧化。如Na2SO3(aq)蒸干得Na2SO4(s)。
(4)弱酸的铵盐蒸干后无固体。如NH4HCO3、(NH4)2CO3。
【注意】判断盐溶液蒸干所得产物成分关键点:
(1)盐溶液水解生成易挥发性酸eq \(――→,\s\up7(蒸干),\s\d5(灼烧))金属氧化物。
(2)考虑盐受热时是否分解。
4.生成胶体
(1)制备胶体:向沸水中滴加FeCl3饱和溶液,并继续加热以增大Fe3+的水解程度,从而制备Fe(OH)3胶体。
FeCl3+3H2OFe(OH)3(胶体)+3HCl
(2)净水
铁盐作净水剂原理:Fe3++3H2O Fe(OH)3(胶体)+3H+
明矾作净水剂原理:Al3++3H2O Al(OH)3(胶体)+3H+
5.制备无机化合物:如用TiCl4制备TiO2。
其反应的方程式为TiCl4+(x+2)H2O(过量)===TiO2·xH2O↓+4HCl。
TiO2·xH2O焙烧得到TiO2。
6.某些离子的去除:如除去MgCl2溶液中的Fe3+可在加热搅拌条件下,加入MgCO3[或MgO或Mg(OH)2]后,与H+反应,调节pH,促进Fe3+水解为Fe(OH)3沉淀,再过滤。
7.去油污
热的纯碱溶液去油污效果好。
原因:加热能促进Na2CO3水解,COeq \\al(2-,3)+H2OHCOeq \\al(-,3)+OH-
产生的c(OH-)较大,而油脂在碱性较强的条件下水解受到促进,故热的纯碱溶液比冷的去油污效果好。
8.化肥的施用
如:草木灰(K2CO3)与铵态氮肥不能混合施用,降低肥效。
这是两种盐发生水解相互促进反应放出氨气的缘故。
9.除锈剂
NH4Cl 与 ZnCl2 溶液可作焊接时的除锈剂
10.泡沫灭火器原理
成分为NaHCO3与Al2(SO4)3:
发生反应为Al3++3HCO3−===Al(OH)3↓+3CO2↑
11.判断离子共存
弱碱阳离子与弱酸阴离子发生完全双水解,则无法大量共存,如:
阳离子:Al3+、Fe3+ 与
阴离子:CO32-、HCO3-、SiO32-、S2-、HS-、 AlO2-、ClO-
【归纳总结】
盐类水解应用常考点
▉考点06 溶液中粒子浓度的变化分析
1.把握三种守恒,明确等量关系
2.粒子浓度关系比较及等式关系
1.下列有关化学用语表示正确的是
A.电离:
B.水解:
C.泡沫灭火器制作原理:
D.硫酸氢钠熔融状态下可发生电离:
【答案】C
【解析】A.是多元弱酸,分步电离,其电离方程式为:、,故A错误;
B. 是电离方程式,水解方程式为,故B错误;
C.泡沫灭火器是碳酸氢钠和硫酸铝混合,二者发生双水解反应,其制作原理:,故C正确;
D.硫酸氢钠熔融状态下只破坏离子键,不破坏共价键,其电离方程式为,故D错误;
综上所述,答案为C。
2.下列有关pH=11的氨水和pH=11的碳酸钠溶液中水的电离程度的比较正确的是
A.前者大于后者B.前者等于后者C.前者小于后者D.无法确定
【答案】C
【解析】水的电离方程式为:H2O=H++OH-,加入酸或碱后,增大氢离子或氢氧根离子浓度导致水的电离平衡向逆反应方向移动,即抑制水的电离;加入含有弱根离子的盐后,弱根离子和氢离子或氢氧根离子生成弱电解质,从而能促进水的电离,所以加入氨水能抑制水的电离,加入碳酸钠能促进水的电离,故选答案C。
3.室温时,下列操作能使浓度均为0.01ml·L-1的
①CH3COOH溶液②CH3COONa溶液中c(CH3COO-)都增大的是
A.升高温度B.加水稀释C.加入少量硫酸D.加入少量NaOH固体
【答案】D
【解析】A.升高温度促进电离和水解,所以①CH3COOH溶液中c(CH3COO-)增大,②CH3COONa溶液中c(CH3COO-)减小,故A不符合题意;
B.加水稀释虽然能促进电离和水解,但溶液稀释的倍数大于电离的倍数,所以①CH3COOH溶液中c(CH3COO-)减小,②CH3COONa溶液中c(CH3COO-)减小,故B不符合题意;
C.加入少量硫酸,氢离子浓度增大,抑制①CH3COOH电离,促进②CH3COONa溶液的水解,所以①CH3COOH溶液中c(CH3COO-)减小,②CH3COONa溶液中c(CH3COO-)增大,故C不符合题意;
D.加入少量NaOH固体,促进①CH3COOH电离,抑制②CH3COONa溶液的水解,所以c(CH3COO-)都增大,故D符合题意;
故答案:D。
4.0.1ml/L溶液中,由于的水解,使得。如果要使更接近于0.1ml/L,可采取的措施是
A.加入少量氢氧化钠B.加入少量水
C.加入少量盐酸D.加热
【答案】C
【分析】如果要使更接近于0.1ml/L,需要抑制铵根离子水解,并且加入的物质和铵根离子之间不反应即可,根据水解平衡的移动影响因素来回答。
【解析】A.加入氢氧化钠,会消耗铵根离子,使得铵根离子浓度更小于,故A错误;
B.加水稀释会导致溶液中铵根离子浓度减小,故B错误;
C.加入盐酸会抑制铵根离子水解,能使更接近于0.1ml/L,故C正确;
D.加热会促进铵根离子水解,导致溶液中铵根离子浓度减小,故D错误;
答案选C。
5.化学与生活生产密切相关,下列事实与盐类水解无关的是
A.古代用草木灰的水溶液来洗涤衣物
B.“管道通”中含有铝粉和苛性钠,用于疏通下水道
C.氯化铵溶液可做金属焊接中的除锈剂
D.向中加入水,加热蒸干,最后焙烧固体得到
【答案】B
【解析】A.草木灰的主要成分是碳酸钾,碳酸钾水解使溶液显碱性,油污在碱性条件下易被除去,与盐类水解有关,A错误;
B.铝与氢氧化钠溶液反应生成氢气,增大管道内气压用于疏通下水道,与盐类水解无关,B正确;
C.铵根离子水解,有H+生成,使溶液显酸性,H+与铁锈反应,能起到除锈的作用,与盐类水解有关,C错误;
D.在加热的条件下,TiCl4水解得TiO2⋅xH2O和HCl,最后焙烧得到TiO2,与盐类水解有关,D错误;
故选B。
6.将AlCl3溶液和Al(NO3)3溶液分别加热蒸干,并灼烧,所得产物的主要成份是:
A.均为Al(OH)3B.前者得Al2O3,后者得Al(NO3)3
C.均为Al2O3D.前者得AlCl3,后者得Al(NO3)3
【答案】C
【解析】AlCl3和Al(NO3)3都是强酸弱碱盐,水解产生A1(OH)3、HCl及HNO3,由于盐酸和硝酸都是挥发性的酸,所以AlCl3溶液和Al(NO3)3溶液在加热时水解生成固体A1(OH)3,Al(OH)3在加热条件下分解生成Al2O3,故合理选项是C。
7.下列说法正确的是( )
A.稀释0.1 ml·L-1 Na2CO3溶液,溶液的pH增大
B.水解反应NHeq \\al(+,4)+H2ONH3·H2O+H+达到平衡后,升高温度平衡逆向移动
C.加热0.1 ml·L-1 Na2CO3溶液,COeq \\al(2-,3)的水解程度增大
D.Na2CO3溶液中加入少量Ca(OH)2固体,COeq \\al(2-,3)水解程度减小,溶液的pH减小
答案 C
解析 COeq \\al(2-,3)+H2OHCOeq \\al(-,3)+OH-,稀释时平衡右移,但c(OH-)减小,pH减小,A项错误;水解反应是吸热反应,升温平衡正向移动,B项错误;COeq \\al(2-,3)+H2OHCOeq \\al(-,3)+OH-,加入少量Ca(OH)2固体,COeq \\al(2-,3)与Ca2+生成沉淀,平衡左移,COeq \\al(2-,3)水解程度减小,c(OH-)增大,pH增大,D项错误。
8.25 ℃时,某氯化铵溶液的pH=4,下列叙述中不正确的是
A.溶液中的c(OH-)=1×10-10 ml·L-1
B.溶液中的c(Cl-)>>c(H+)>c(OH-)
C.溶液中的c(H+)+=c(Cl-)+c(OH-)
D.溶液中的c(NH3·H2O)=
【答案】D
【解析】A.NH4Cl溶液pH = 4,c(H+)=10-4ml/L,由于在25℃时Kw=10-14,所以溶液中的 c(OH-) ==1×10-10 ml/L,A正确;
B.NH4Cl是强酸弱碱盐,弱碱根NH离子发生水解反应而消耗,所以c(Cl-) >c(NH);弱碱根NH离子发生水解反应消耗水电离产生的OH-,使水的电离平衡被破坏,水继续电离,当最终达到电离平衡时,c(H+)>c(OH-)。盐水解的程度是很微弱的,因此c(NH)>c(H+)。故整个溶液中离子浓度关系为c(Cl-)>c(NH)>c(H+)>c(OH-),B正确;
C.根据电荷守恒可知溶液中的c(H+) + c(NH) = c(Cl-) + c(OH-),C正确;
D.在溶液中NH3·H2O 是盐水解产生的,而NH是盐电离产生的。在溶液中盐水解的程度是很微弱的,因此c(NH3·H2O) c(A2-)>c(OH-)>c(HA-)>c(H+)
(3)③ ②>③>①
(4)均有可能
【解析】(1)存在的分子有H2O、H2A,则H2A为弱酸,电离方程式为H2AH++HA-,HA-H++A2-;
(2)Na2A的水溶液水解显碱性。若溶液M由10 mL 2 ml·L-1NaHA溶液与2 ml·L-1NaOH溶液等体积混合而得,M相当于1ml·L-1Na2A的水溶液,则溶液M的pH>7; A2-发生两步水解,各离子浓度顺序为:c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+);
(3)①弱酸H2A电离,②中NaHA水解生成H2A分子和氢氧根离子溶液显碱性,③中等体积混合为等量的NaCl、NaHA、H2A,浓度均为0.01ml·L-1,HA-会抑制弱酸的电离,则三种情况的溶液中H2A分子浓度最大的为③,最小的为②;②溶液pH大于③,①③相比①的酸性强,则pH最小,所以②>③>①;
(4)混合溶液,则c(H+)=10-5ml·L-1,显酸性,则酸过量,H2A为弱酸,pH=3的H2A溶液与pH=11的NaOH溶液混合时酸的浓度大于碱的浓度,则二者体积关系不确定,大于、小于或等于都可能酸过量。
14.酸、碱、盐是中学化学学习的重要化合物,请依据其性质回答下列问题。
(1)常温下,小苏打溶液pH_______7(填“>”、“=”或“”、“=”或“”、“=”或“”、“=”或“”、“=”或“NaHCO3
判断溶液中离子能否大量共存
Al3+和HCOeq \\al(-,3)因发生相互促进的水解反应而不能大量共存
配制或贮存易水解的盐溶液
配制FeCl3溶液,要向FeCl3溶液中加入适量盐酸
胶体的制备,作净水剂
明矾溶于水生成胶状物氢氧化铝,能吸附水中悬浮的杂质,并形成沉淀使水澄清
化肥的使用
铵态氮肥不宜与草木灰混合使用
泡沫灭火器的反应原理(水解互促)
Al3++3HCOeq \\al(-,3)===Al(OH)3↓+3CO2↑
无水盐的制备
由MgCl2·6H2O制MgCl2,在干燥的HCl气流中加热
判断盐溶液的蒸干产物
将AlCl3溶液蒸干灼烧得到的是Al2O3而不是AlCl3
某些盐的分离除杂
为除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgO或MgCO3或Mg(OH)2,过滤后再加入适量的盐酸
盐溶液除锈
NH4Cl溶液除去金属表面的氧化物(NHeq \\al(+,4)水解溶液显酸性)
判断电解质的强弱
CH3COONa溶液能使酚酞变红(pH>7),说明CH3COOH是弱酸
三守恒
原理与方法
举例
说明
电荷
守恒
原理:电解质溶液中阳离子所带的电荷总数与阴离子所带的电荷总数相等。即电荷守恒,溶液呈电中性。
方法:①找出溶液中所有的阴、阳离子。
②阴、阳离子浓度乘以自身所带的电荷数建立等式。
Na2CO3溶液为例:
c(Na+)+c(H+)=c(OH-)+c(HCOeq \\al(-,3))+2c(COeq \\al(2-,3))
物料
守恒
原理:在电解质溶液中,由于某些离子发生水解或电离,离子的存在形式发生了变化,就该离子所含的某种元素来说,变化前后其原子个数是守恒的,即元素物料守恒。
方法:①分析溶质中的特定元素的原子或原子团间的质量守恒关系(特定元素除H、O元素外)。
②找出特征元素在水溶液中的所有存在形式。
①单一元素守恒,如1 ml NH3通入水中形成氨水,就有n(NH3)+n(NH3·H2O)+n(NHeq \\al(+,4))=1 ml,即氮元素守恒。
②两元素守恒,如Na2CO3溶液中,c(Na+)=2c(H2CO3)+2c(HCOeq \\al(-,3))+2c(COeq \\al(2-,3)),即钠元素与碳元素守恒。
质子
守恒
原理:电解质溶液中,由于电离、水解等过程的发生,往往存在质子(H+)的转移,转移过程中质子数量保持不变,称为质子守恒。
方法一:可以由电荷守恒与元素质量守恒推导出来。
方法二:质子守恒是依据水的电离平衡:H2OH++OH-,水电离产生的H+和OH-的物质的量总是相等的,无论在溶液中由水电离出的H+和OH-以什么形式存在。
方法一:Na2CO3中将电荷守恒和物料守恒中的Na+消去得:c(OH-)=c(H+)+c(HCOeq \\al(-,3))+2c(H2CO3)。
方法二:
①以Na2CO3溶液为例:
c(OH-)=c(H+)+c(HCOeq \\al(-,3))+2c(H2CO3)
②以NaHCO3溶液为例:
c(H2CO3)+c(H+)=c(OH-)+c(COeq \\al(2-,3))
①由电荷守恒与物料守恒也可以推出质子守恒,即方法一
②化学计量数为得(或失)质子的数目
③H3O+简写为H+
单一
电解质溶液
一元弱酸
0.100 ml·L-1L CH3COOH溶液中的浓度关系:
物料守恒:c(CH3COOH)+c(CH3COO-)=0.1 ml·L-1
电荷守恒:c(CH3COO-)+c(OH-)=c(H+)
一元弱碱
0.100 0 ml·L-1 NH3·H2O溶液中的粒子浓度关系:
物料守恒:c(NH3·H2O)+c(NHeq \\al(+,4))=0.1 ml·L-1
电荷守恒:c(NHeq \\al(+,4))+c(H+)=c(OH-)
各粒子浓度大小关系:c(NH3·H2O)>c(OH-)>c(NHeq \\al(+,4))>c(H+)
一元弱酸的强碱盐
0.100 0 ml·L-1 NH4Cl溶液中粒子浓度关系:
物料守恒:c(NHeq \\al(+,4))+c(NH3·H2O)=c(Cl-)=0.1 ml·L-1
电荷守恒:c(NHeq \\al(+,4))+c(H+)=c(Cl-)+c(OH-)
质子守恒:c(H+)=c(OH-)+c(NH3·H2O)
一元弱碱的强酸盐
0.100 0 ml·L-1 CH3COONa溶液中粒子浓度关系:
物料守恒:c(CH3COO-)+c(CH3COOH)=c(Na+)=0.1 ml·L-1
电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
质子守恒:c(OH-)=c(H+)+c(CH3COOH)
各粒子浓度大小关系:c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+)
弱酸的
酸式盐溶液
0.10 ml·L-1 NaHCO3溶液的pH>7,溶液中粒子浓度关系:
物料守恒:c(Na+)=c(HCOeq \\al(-,3))+c(H2CO3)+c(COeq \\al(2-,3))
电荷守恒:c(Na+)+c(H+)=c(HCOeq \\al(-,3))+2c(COeq \\al(2-,3))+c(OH-)
质子守恒:c(H2CO3)+c(H+)=c(OH-)+c(COeq \\al(2-,3))
各粒子浓度大小关系:c(Na+)>c(HCOeq \\al(-,3))>c(OH-)>c(H2CO3)>c(COeq \\al(2-,3))[或c(H+)]
混合溶液
等浓度、等体积的盐与酸的混合溶液
分子的电离程度大于对应离子的水解程度
在0.1 ml·L-1的CH3COOH、CH3COONa混合溶液,pH<7,溶液中粒子浓度关系:
粒子浓度大小关系:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
物料守恒:2c(Na+)=c(CH3COO-)+c(CH3COOH)
电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
分子的电离程度小于对应离子的水解程度
在0.1 ml·L-1的HCN和0.1 ml·L-1的NaCN混合溶液,pH>7,溶液中粒子浓度大小顺序:c(Na+)>c(CN-)>c(OH-)>c(H+),且c(HCN)>c(Na+)=0.1 ml·L-1。
等浓度、等体积的盐与碱的混合溶液
常温下,等浓度、等体积的NH4Cl和NH3·H2O混合溶液,pH>7,溶液中粒子浓度关系:
物料守恒:2c(Cl-)=c(NHeq \\al(+,4))+c(NH3·H2O)
电荷守恒:c(Cl-)+c(OH-)=c(NHeq \\al(+,4))+c(H+)
各粒子浓度大小关系:c(NHeq \\al(+,4))>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)
酸、碱中和型粒子浓度关系比较
盐酸
滴定氨水
常温下,用0.100 0 ml·L-1盐酸溶液滴定20.00 mL 0.100 0 ml·L-1氨水
关键点
溶液中溶质成分及粒子浓度关系
V(HCl)=10(点①)
溶质是:等物质的量的NH4Cl和NH3·H2O
粒子浓度大小关系:c(NHeq \\al(+,4))>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)
pH=7(点②)
粒子浓度大小关系:c(NHeq \\al(+,4))=c(Cl-)>c(OH-)=c(H+)
V(HCl)=20(点③)
溶质是:NH4Cl
粒子浓度大小关系:c(Cl-)>c(NHeq \\al(+,4))>c(H+)>c(OH-)
等浓度
碱与酸混合
等浓度的NaOH和CH3COOH溶液按体积比1∶2混合后pH<7,粒子浓度大小顺序:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。
pH和为14酸与碱混合
常温下pH=2的HCl溶液与pH=12的NH3·H2O溶液等体积混合,粒子浓度大小顺序:c(NH3·H2O)>c(NHeq \\al(+,4))>c(Cl-)>c(OH-)>c(H+)。
不同溶液中同一离子浓度比较
离子组成比例不同
Ⅰ. 浓度均为0.1 ml·L-1的①(NH4)2SO4 ②(NH4)2CO3 ③NH4Al(SO4)2 ④NH4HCO3溶液,NHeq \\al(+,4)的物质的量的浓度由大到小的顺序为:
离子组成比例相相
Ⅱ. 常温下物质的量浓度相等的①NH4HCO3 ②NH4HSO4 ③NH4Fe(SO4)2 ④NH4Cl:溶液中NHeq \\al(+,4)的浓度由大到小的顺序:②>③>④>①。
等pH不同溶液中同一离子浓度关系
pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液:c(NHeq \\al(+,4))大小顺序:②=①>③。
化学式
电离常数
相关试卷
这是一份专题05 卤代烃 醇 酚(考点清单)(讲+练)-2023-2024学年高二化学下学期期中考点大串讲(人教版2019),共29页。试卷主要包含了卤代烃,卤代烃中卤素原子的检验,制取卤代烃的方法,卤代烃的用途与危害等内容,欢迎下载使用。
这是一份专题04 烃(考点清单)(讲+练)-2023-2024学年高二化学下学期期中考点大串讲(人教版2019)(原卷版),共37页。试卷主要包含了甲烷的结构及性质,烷烃的结构和性质,环烷烃,烷烃的命名,烯烃的命名,烯烃的立体异构等内容,欢迎下载使用。
这是一份专题04 烃(考点清单)(讲+练)-2023-2024学年高二化学下学期期中考点大串讲(人教版2019),共42页。试卷主要包含了甲烷的结构及性质,烷烃的结构和性质,环烷烃,烷烃的命名,烯烃的命名,烯烃的立体异构等内容,欢迎下载使用。









