

山东省新泰市弘文中学2024-2025学年高三上学期期中检测 化学试题
展开
这是一份山东省新泰市弘文中学2024-2025学年高三上学期期中检测 化学试题,共11页。试卷主要包含了单选题,多选题,推断题,实验题等内容,欢迎下载使用。
一、单选题
1.反应的能量变化如图所示,下列说法不正确的是( )
A.该正反应为放热反应
B.该反应物总能量高于生成物总能量
C.吸热反应一定要加热后才能发生
D.一定量的(g)和(g)反应生成2ml(g),共放出(y-x)kJ能量
2.下列有关和混合溶液的叙述正确的是( )
A.该溶液中,、、、可以大量共存
B.该溶液中,、、、可以大量共存
C.向该溶液中滴入少量溶液,反应的离子方程式为:
D.向该溶液中加入浓盐酸,每产生1ml,转移电子约为个
3.常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:
B.的溶液中:
C.的溶液中:
D.能使甲基橙变红的溶液中:
4.下列反应过程中的能量变化情况不符合如图所示的是( )
A.
B.
C.
D.
5.下列事实不能用勒夏特列原理解释的是( )
A.溶液中存在:,对溶液加热,溶液由绿色变为黄绿色
B.、、组成的平衡体系,加压后体系颜色变深
C.已知:,将球浸泡在冷水中颜色变浅
D.夏天从冰箱拿出的啤酒刚一开启即涌出大量泡沫
6.已知,速率方程为,其中k为速率常数,只与温度、催化剂、固体接触面积有关,与浓度无关;n为该反应级数,可以为正数、0、负数;起始浓度消耗一半的时间叫半衰期,在某催化剂表面上分解的实验数据如表:
下列说法错误的是( )
A.该反应为0级反应
B.该反应速率常数为
C.表格中的
D.若起始浓度为,半衰期为60min
7.与反应可制得,下列有关说法正确的是( )
A.半径大小:B.非金属性:
C.是离子化合物D.气态氢化物的热稳定性:
8.是常用的绿色氧化剂,可用如图所示装置电解和制备。下列说法不正确的是( )
A.移向a电极
B.装置工作过程中a极消耗的量等于b极生成的量
C.b电极的电极反应式为
D.电解生成1ml时,电子转移的数目为
9.下列反应中的热量改变方式与其他三项不同的是( )
A.钠与冷水反应B.铝与氧化铁的反应
C.小苏打粉末与稀盐酸反应D.铁与氯气的反应
10.在相同条件下研究催化剂Ⅰ、Ⅱ对反应X→2Y的影响,各物质浓度c随反应时间t的部分变化曲线如图,则( )
A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化
D.使用催化剂Ⅰ时,0~2 min内,
11.离子化合物和与水的反应分别为①;②。下列说法正确的是( )
A.中均有非极性共价键
B.①中水发生氧化反应,②中水发生还原反应
C.中阴、阳离子个数比为,中阴、阳离子个数比为
D.当反应①和②中转移的电子数相同时,产生的和的物质的量相同
12.萤石是自然界中常见的含氟矿物,其晶胞结构如图所示。晶胞参数为,阿伏加德罗常数的值为。下列说法不正确的是( )
A.Y代表的离子是
B.X离子的配位数为8
C.X离子与Y离子的最小核间距为
D.该晶体的摩尔体积为
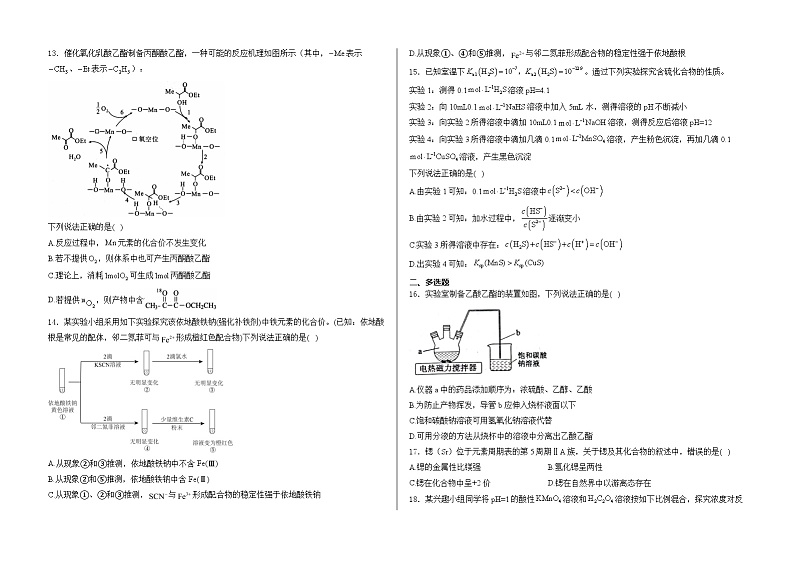
13.催化氧化乳酸乙酯制备丙酮酸乙酯,一种可能的反应机理如图所示(其中,表示、表示):
下列说法正确的是( )
A.反应过程中,元素的化合价不发生变化
B.若不提供,则体系中也可产生丙酮酸乙酯
C.理论上,消耗可生成丙酮酸乙酯
D.若提供,则产物中含
14.某实验小组采用如下实验探究该依地酸铁钠(强化补铁剂)中铁元素的化合价。(已知:依地酸根是常见的配体,邻二氮菲可与形成橙红色配合物)下列说法正确的是( )
A.从现象②和③推测,依地酸铁钠中不含Fe(Ⅲ)
B.从现象②和⑤推测,依地酸铁钠中含Fe(Ⅱ)
C.从现象①、②和③推测,与形成配合物的稳定性强于依地酸铁钠
D.从现象①、④和⑤推测,与邻二氮菲形成配合物的稳定性强于依地酸根
15.已知室温下。通过下列实验探究含硫化合物的性质。
实验1:测得0.1溶液pH=4.1
实验2:向10mL0.1NaHS溶液中加入5mL水,测得溶液的pH不断减小
实验3:向实验2所得溶液中滴加10mL0.1NaOH溶液,测得反应后溶液pH=12
实验4:向实验3所得溶液中滴加几滴0.1溶液,产生粉色沉淀,再加几滴0.1溶液,产生黑色沉淀
下列说法正确的是( )
A.由实验1可知:0.1溶液中
B.由实验2可知:加水过程中,逐渐变小
C.实验3所得溶液中存在:
D.出实验4可知:
二、多选题
16.实验室制备乙酸乙酯的装置如图,下列说法正确的是( )
A.仪器a中的药品添加顺序为:浓硫酸、乙醇、乙酸
B.为防止产物挥发,导管b应伸入烧杯液面以下
C.饱和碳酸钠溶液可用氢氧化钠溶液代替
D.可用分液的方法从烧杯中的溶液中分离出乙酸乙酯
17.锶(Sr)位于元素周期表的第5周期ⅡA族,关于锶及其化合物的叙述中,错误的是( )
A.锶的金属性比镁强B.氢化锶呈两性
C.锶在化合物中呈+2价D.锶在自然界中以游离态存在
18.某兴趣小组同学将pH=1的酸性溶液和溶液按如下比例混合,探究浓度对反应速率的影响。
现象:实验①溶液很快由紫色变为青绿色,而实验②慢一点;变为青绿色后,实验②溶液很快褪至无色,而实验①褪色慢一点。
资料:与很难形成配合物;(青绿色),Mn+有强氧化性,而氧化性极弱。
下列说法错误的是( )
A.
B.溶液中能通过加盐酸酸化调pH=1
C.溶液由青绿色褪至无色过程中,实验①中较小,导致褪色速率较慢D.由实验可知,加入越多,溶液由紫色褪至无色的速率越快
19.钙钛矿太阳能电池是当前世界最有前途的薄膜光伏技术之一,(相对分子质量为620)是最主要的有机无机杂化钙钛矿材料,其晶胞结构如图所示,A为有机阳离子,为阿伏伽德罗常数的值。下列说法正确的是( )
图1图2
A.H、C、N均属于P区元素
B.I基态原子的简化电子排布式为
C.若沿z轴向xy平面投影,则其投影图如图2所示
D.该晶体的密度为
20.砷的含氧酸砷是一种常见的元素,它在自然界中广泛存在。砷的含氧酸是指砷与氧形成的化合物,其中砷的氧化态不同,因此它们的性质也不同。其转化关系如下图所示:
已知:在193℃升华,微溶于水。下列说法正确的是( )
A.是共价晶体
B.反应①中还原剂与氧化剂的物质的量之比为1:2
C.反应②中离子方程式为:
D.生成,理论上消耗0.6m1稀
三、推断题
21.某有机化合物A经李比希法测得其中含碳为70.59%、含氢为 5.88%,其余含有氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的质谱图如图:
方法二:核磁共振仪测出A的核磁共振氢谱有4个峰,其面积之比为1:2:2:3。如图。
方法三:利用红外光谱仪测得A分子的红外光谱,如图。
(1)A的摩尔质量__________。
(2)A的分子式为__________。
(3)该物质属于哪一类有机物__________。
(4)A的分子中只含一个甲基的依据是__________(填序号)。
a.A的相对分子质量 b.A的分子式
c.A的核磁共振氢谱图 d.A分子的红外光谱图
(5)A的结构简式为__________。
22.某同学从基础化工原料A出发,设计了如图合成路线合成高分子化合物F:
已知:A的产量是一个国家石油化工产业发展水平的标志。
回答下列问题:
(1)A的结构简式为 ,D中官能团的名称为 。
(2)的反应类型为 ;与溴蒸气在光照条件下也能发生反应生成B,与图示流程相比,该方法的缺点是 。
(3)的化学方程式为 。
(4)D的同分异构体有多种,其中官能团与D相同的有 种(不包含D本身),分子结构中含有3个甲基的有机物的结构简式为 (填一种即可
四、实验题
23.如图所示,是原电池的装置图。请回答:
(1)若溶液C为稀溶液,电流表指针发生偏转,B电极材料为Fe且作负极,B电极反应式为___________;在反应中溶液中的阴离子移向____________(填“A”或“B”),反应进行一段时间后溶液C中H+浓度___________。(填“增大”“减小”或“基本不变”)
(2)若需将反应设计成如图所示的原电池装置,则A极(负极)材料为___________,B极电极反应式为___________。
24.下面是某化学兴趣小组测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
甲同学利用如图装置测定化学反应速率。
(1)除如图装置所示的实验用品外,还需要的一件实验用品是___________。
(2)圆底烧瓶中所发生反应的离子方程式为___________。
(3)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该内的反应速率为__________设圆底烧瓶内混合溶液的总体积为100mL,且反应过程中体积不变),而该测定值比实际值偏小,其原因可能是___________。
Ⅱ.探究一定条件下反应物浓度对硫代硫酸钠溶液与硫酸溶液反应速率的影响。乙同学利用浊度计探究一定条件下反应物浓度对硫代硫酸钠溶液与硫酸溶液反应速率的影响。已知:浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
用图1所示装置进行如下表所示的5个实验,分别测量混合后溶液达到相同浑浊度的过程中,浑浊度随时间的变化。实验①~⑤所得数据如图2曲线①~⑤所示。
【分析与解释】
(4)实验③中,x=_________。
(5)实验①、②、③的目的是________。
(6)通过比较Ⅰ组(①、②、③)与Ⅱ组(③④、⑤)两组实验,可推断反应物浓度的改变对与硫酸反应的化学反应速率的影响,溶液浓度的改变影响更大。该推断的证据是________。
参考答案
1.答案:C
解析:A.从图中可知,反应物总能量高于生成物总能量,正反应为放热反应,A正确;
B.从图中可知,该反应的反应物总能量高于生成物总能量,B正确;
C.吸热反应不一定需要加热才能发生,如氯化铵和氢氧化钡的反应为吸热反应,但是不需要加热,C错误;
D.该反应的ΔH=生成物总能量-反应物总能量=-(y-x)kJ/ml,故生成2ml(g)时,共放出热量(y-x)kJ,D正确;
故答案选C。
2.答案:D
解析:A.和NaCl混合溶液中,氢离子会和次氯酸根离子结合成弱酸次氯酸,次氯酸可以把溴离子氧化为溴单质,不可以大量共存,故A错误;
B.NaClO和NaCl混合溶液中氯离子和银离子会生成氯化银沉淀,不共存,故B错误;
C.滴入少量溶液,亚铁离子被氧化为铁离子,铁离子和次氯酸根离子发生双水解会生成氢氧化铁沉淀,离子方程式为,故C错误;
D.加入浓盐酸,发生反应方程式为,根据方程式知,每生成1ml氯气转移电子1ml,数目约为个,故D正确;
故选D。
3.答案:B
解析:呈棕黄色,且与会发生络合反应而不能大量共存,A错误;的溶液呈碱性,、彼此不反应,且均与不反应,在碱性溶液中能大量共存,B正确;的溶液中,亚铁离子会与高锰酸根离子发生氧化还原反应而不能大量共存,C错误;能使甲基橙变红的溶液呈酸性,碳酸氢根离子在酸性溶液中不能大量存在,D错误。
4.答案:D
解析:由图可知,该反应中生成物的能量高于反应物,为吸热反应。
、、均是吸热反应,生成物的能量高于反应物,能量变化情况符合图像,是放热反应,生成物的能量低于反应物,能量变化情况不符合图像,故选D。
5.答案:B
解析:对反应的加热,平衡正移,溶液由绿色变为黄绿色A项正确;减小体积,平衡不移动,但增大,颜色变深,B项错误;温度降低,平衡正移,变小,增大,颜色变浅,C项正确;啤酒中存在二氧化碳的溶解平衡,夏天从冰箱拿出啤酒并开启,压强减小,温度升高,都会使溶解平衡向着二氧化碳析出的方向进行,故会涌出大量泡沫,故能用勒夏特列原理解释,D项正确;
6.答案:B
解析:根据表格中的数据,浓度变化与时间成正比,即速率是一个常数,为常数,说明,该反应是零级反应,A正确:当,,,,可知,B项错误;根据表格中数据分析,C项正确;设起始浓度为cml/L,半衰期可知半衰期与起始浓度成正比,表中起始浓度为0.3ml/L时,半衰期为30min,若起始浓度为0.6ml/L,则半衰期为60min,D项正确
7.答案:D
解析:A.氯离子有三个电子层,氮离子有二个电子层,电子层数多的微粒半径大,故半径大小:,A错误;
B.同周期从左往右非金属性增强,同主族从上往下非金属性减弱,故非金属性:H
相关试卷
这是一份山东省新泰市弘文中学2024-2025学年高三上学期期中检测 化学试题,共11页。试卷主要包含了单选题,多选题,推断题,实验题等内容,欢迎下载使用。
这是一份山东省新泰市弘文中学2024-2025学年高一上学期期中检测 化学试题,共8页。试卷主要包含了单选题,多选题,推断题,实验题等内容,欢迎下载使用。
这是一份山东省新泰市弘文中学2024-2025学年高三上学期10月月考化学试卷,共12页。试卷主要包含了单选题,多选题,推断题,实验题等内容,欢迎下载使用。








