

2023北京清华附中高二上学期期中化学试卷(教师版)(1)
展开
这是一份2023北京清华附中高二上学期期中化学试卷(教师版)(1),共15页。
1.本试卷共10页,满分100分,练习时间90分钟。
2.在试卷和答题纸上准确填写学校名称、姓名和准考证号。
3.答案一律填涂或书写在答题纸上,在试卷上作答无效。
4.在答题纸上,选择题用2B铅笔作答,其他题用黑色字迹签字笔作答。
可能用到的相对原子质量:H1 C12 N14 O16 Na23 S32 C135.5 Zn 65
第Ⅰ卷 选择题
本卷共25小题,每题只有1个选项符合题意(每题2分,共50分)
1.下列装置或过程能实现电能转化为化学能的是( )
2.下列物质属于弱电解质的是( )
A.NaClB.NaOHC.D.
3.与化合生成NO是自然界固氮的重要方式之一。下图显示了该反应中的能量变化。
下列说法不正确的是( )
A.键的键能大于键的键能
B.完全断开1mlNO中的化学键需吸收1264kJ能量
C.该反应中产物所具有的总能量高于反应物所具有的总能量
D.生成NO反应的热化学方程式为:
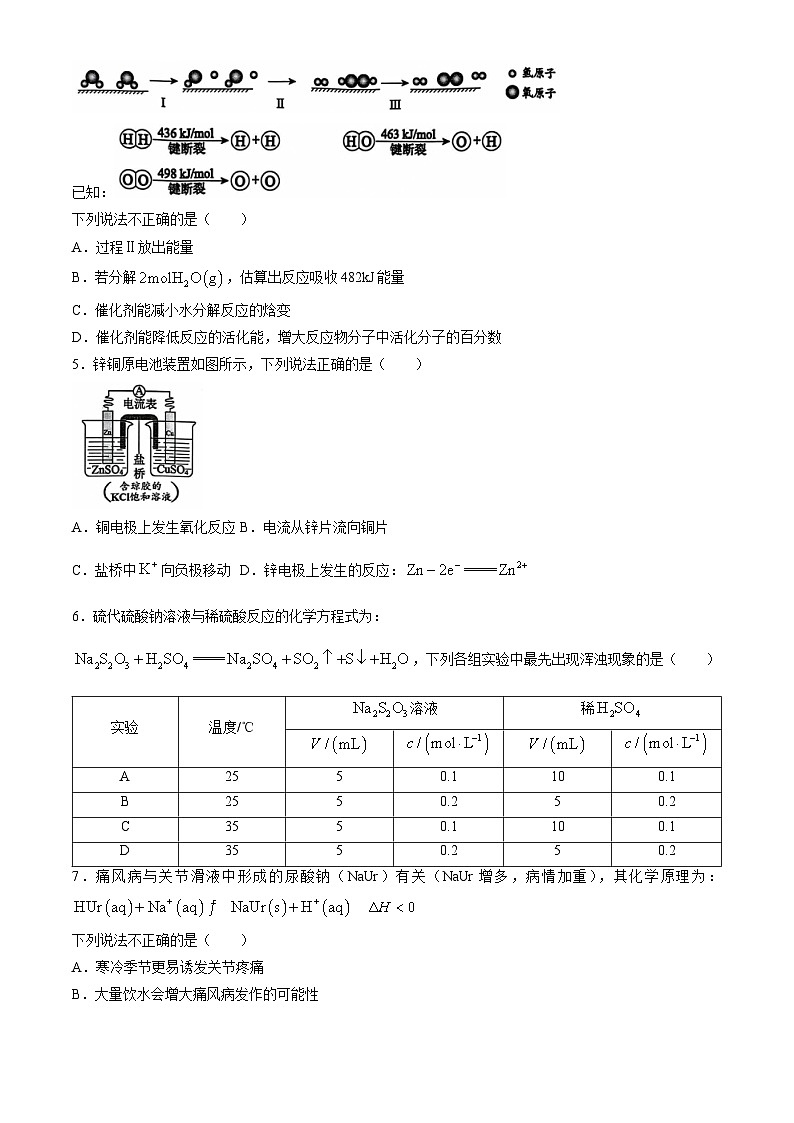
4.我国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如下图所示。
已知:
下列说法不正确的是( )
A.过程Ⅱ放出能量
B.若分解,估算出反应吸收482kJ能量
C.催化剂能减小水分解反应的焓变
D.催化剂能降低反应的活化能,增大反应物分子中活化分子的百分数
5.锌铜原电池装置如图所示,下列说法正确的是( )
A.铜电极上发生氧化反应B.电流从锌片流向铜片
C.盐桥中向负极移动D.锌电极上发生的反应:
6.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:,下列各组实验中最先出现浑浊现象的是( )
7.痛风病与关节滑液中形成的尿酸钠(NaUr)有关(NaUr增多,病情加重),其化学原理为:
下列说法不正确的是( )
A.寒冷季节更易诱发关节疼痛
B.大量饮水会增大痛风病发作的可能性
C.饮食中摄入过多食盐,会加重痛风病病情
D.患痛风病的人应少吃能代谢产生更多尿酸的食物
8.下列解释事实的离子方程式不正确的是( )
A.电解精炼铜的阴极反应:
B.碳酸钙与醋酸反应:
C.铜在潮湿空气中被腐蚀:
D.使酸性溶液褪色:
9.下列关于电化学腐蚀、防护与利用的说法中,正确的是( )
10.为减少二氧化碳排放,我国科学家设计熔盐电解池捕获二氧化碳的装置,如下图所示。
下列说法不正确的是( )
A.过程①中有碳氧键断裂
B.过程②中在a极上发生了还原反应
C.过程③中的反应可表示为:
D.过程总反应:
11.利用电解技术,以氯化氢为原料回收氯气的过程如下图所示,下列说法不正确的是( )
A.由阳极向阴极迁移
B.阳极电极反应:
C.阴极电极反应:
D.阴极区发生的反应有:
12. 。相同温度下,按初始物质不同进行两组实验,浓度随时间的变化如下表。下列分析不正确的是( )
A.0~20s,实验a中
B.60~80s,实验a中反应处于平衡状态,的转化率为60%
C.实验b中,反应向生成的方向移动,直至达到平衡
D.实验a、b达到化学平衡后,提高温度,反应体系颜色均加深
13.已知 ,体系中C的物质的量分数与温度的关系如下图所示。
下列说法正确的是( )
A.其它条件不变,增大压强平衡不移动B.该反应的平衡常数表达式
C.上述图像中,b点已达到化学平衡状态D.化学平衡常数
14.采用电化学方法使与反应,可生成非常活泼的(羟基自由基)中间体用于降解废水中的有机污染物,原理如下图所示。下列说法不正确的是( )
A.X上发生的电极反应为:
B.可将X电极上产生的收集起来,输送到Y电极继续使用
C.根据装置推测,Y电极是阳极,在该电极侧产生
D.起始时,在Y电极附近加入适量或,均能让装置正常工作
15.下图是溶液与KSCN溶液反应的实验示意图。下列分析不正确的是( )
A.溶液中存在平衡:
B.滴加溶液达平衡后,降低
C.滴加溶液达平衡后,观察到溶液红色加深
D.滴加溶液,平衡正向移动,体系中降低
16.某实验小组用溶液和溶液为反应物,探究外界条件对化学反应速率的影响,实验记录如下表。
已知:
下列说法不正确的是( )
A.实验Ⅱ中
B.实验Ⅲ中
C.对比实验Ⅰ、Ⅱ、Ⅲ可得:温度相同时,反应物浓度越大,反应速率越快
D.对比实验Ⅰ、Ⅳ可得:在浓度保持不变的情况下,温度越高,反应速率越快
17.下列反应在任何温度下都无法自发进行的是( )
A.
B.
C.
D.
18.我国科学家设计可同时实现制备和海水淡化的新型电池,装置示意图如下。下列说法不正确的是( )
A.电极a是正极
B.电极b的反应式:
C.每生成,有2mlNaCl发生迁移
D.离子交换膜c、d分别是阳离子交换膜和阴离子交换膜
19.向体积为1L的密闭容器中充入一定量,发生反应:
下列说法不正确的是( )
A.
B.,该反应的平衡常数
C.Ⅱ中存在:
D.时,向该容器中充入物质的量均为0.2ml的3种气体,反应将逆向进行
20.实验小组探究双氧水与KI的反应,实验方案如下表。
下列说法不正确的是( )
A.KI对的分解有催化作用
B.对比②和③,酸性条件下氧化KI的速率更大
C.对比②和③,②中的现象可能是因为分解的速率大于氧化KI的速率
D.实验②③中的温度差异说明,氧化KI的反应放热
21.某同学进行如下实验(溶液的浓度均为1ml/L)。
下列对实验现象的解释或推测不合理的是( )
A.①中:
B.溶液酸碱性会影响的氧化性
C.②中:
D.③中使湿润pH试纸变蓝的气体是
22.我国研究锂硫电池获得突破,电池的总反应是,充放电曲线如图所示,下列说法不正确的是( )
A.充电时,电能转化为化学能
B.放电时,锂离子向正极移动
C.放电时,转化为得
D.充电时,阳极总电极反应式是
23.催化重整的反应为
①
其中,积炭是导致催化剂失活的主要原因。产生积炭的反应有:
②
③
科研人员研究压强对催化剂活性的影响:在1073K时,将恒定组成的、混合气体,以恒定流速通过反应器,测得数据如下。
下列分析不正确的是( )
A.
B.压强越大,Ra降低越快,其主要原因是反应①平衡逆向移动
C.保持其他条件不变,适当增大投料时,可减缓Ra的衰减
D.研究表明“通入适量有利于重整反应”,因为能与C反应并放出热量
24.一定温度下,探究铜与稀的反应,反应过程如下:
下列说法不正确的是( )
A.过程Ⅰ中生成无色气体的离子方程式是
B.步骤Ⅲ反应速率比Ⅰ快的原因是溶于水,使增大
C.由实验可知,对该反应具有催化作用
D.当活塞不再移动时,再抽入空气,铜可以继续溶解
25.研究小组进行如下表所示的原电池实验:
下列关于该实验的叙述中,正确的是( )
A.两装置的盐桥中,阳离子均向右侧移动
B.实验①中,左侧的铜被腐蚀
C.实验②中,左侧电极的电极反应式为
D.实验①和实验②中,均有得电子的反应发生
第Ⅱ卷 非选择题(本大题有4题,共50分)
26.(10分)根据要求,回答下列问题:
(1)某温度下,纯水中的,则纯水中的__________,该温度时的水的离子积__________。保持温度不变,滴入稀盐酸使溶液中的,则溶液中的__________。
(2)常温下,某NaOH溶液的氢氧根离子浓度,则该溶液的__________。
(3)常温下,某溶液的,则该溶液中水电离出的浓度__________。
27.(14分)二氧化碳的综合利用是实现碳达峰、碳中和的关键。减排能有效降低温室效应,同时,也是一种重要的资源,因此捕集与转化技术研究备受关注。用制备可实现的能源化利用,反应如下:
(1)①温度为523K时,测得上述反应中生成放出的热量为12.3kJ,反应的热化学方程式为______________________________。
②写出上述反应的平衡常数表达式______________________________。
③T℃时,向容积为2L的恒容密闭容器中通入和,5分钟时反应达到平衡,的转化率为50%,在0~5min内容器中__________。
(2)工业上用制备的过程中存在以下副反应:
①在恒温、恒容条件下,下列事实能说明上述反应达到平衡状态的是__________(填字母序号)
A.体系内B.体系压强不再发生变化
C.体系内混合气体的密度保持不变D.体系内CO的物质的量分数不再发生变化
②升高温度,该反应的化学平衡常数__________(填“变大”“变小”或“不变”)。
③理论上,能提高平衡转化率的措施有____________________(写出一条即可)。
④将反应物混合气按进料比通入反应装置,选择合适的催化剂,发生反应在不同温度和压强下,平衡产率和平衡转化率分别如图1、图2。
图1 图2
图2中,压强为,温度高于503K后,平衡转化率随温度升高而增大的原因是__________。
(3)实际生产中,测得压强为时,相同时间内不同温度下的产率如图3
图3
图3中523K时的产率最大,可能的原因是__________(填字母序号)
a.此条件下主反应限度最大
b.此条件下主反应速率最快
c.523K时催化剂的活性最强
28.(12分)氯碱工业是化工产业的重要基础,其装置示意图如图。生产过程中产生的氯酸盐副产物需要处理。
已知:当pH升高时,易歧化为和。
(1)电解饱和食盐水的离子方程式为______________________________。
(2)下列关于产生的说法中,合理的是__________ (填序号)。
a.主要在阴极室产生
b.在电极上放电,可能产生
c.阳离子交换膜破损导致向阳极室迁移,可能产生
(3)测定副产物含量的方法如下图。
①加入的目的是消耗水样中残留的和。若测定中未加入,则水样中的浓度将__________(填“偏大”“偏小”或“不受影响”)。
②用酸性溶液测定未反应完的,消耗酸性溶液,水样中的计算式为______________________________。
(4)可用盐酸处理淡盐水中的,并回收。
①反应的离子方程式为______________________________。
②处理时,HCl可能的作用是:
ⅰ.提高,使氧化性提高或还原性提高;
ⅱ.提高,______________________________。
29.(14分)文献表明:相同条件下,草酸根()的还原性强于。为检验这一结论,完成如下实验。
资料:ⅰ.三水三草酸合铁酸钾[]为翠绿色晶体,光照易分解。其水溶液中存在:
ⅱ.为黄色固体,微溶于水,可溶于强酸。
【实验1】通过和在溶液中的反应比较和的还原性强弱。
(1)中碳元素的化合价是__________。
(2)经检验,翠绿色晶体为。设计实验,确认实验1中没有发生氧化还原反应的操作和现象是____________________。实验1中未发生氧化还原反应的原因是______________________________。
(3)取实验1中的翠绿色溶液光照一段时间,产生黄色浑浊且有气泡产生。补全反应的离子方程式:__________+__________。
【实验2】通过比较与、反应的难易,判断二者还原性的强弱。
(4)证明被氧化的实验现象是______________________________。
(5)欲比较与、反应的难易应关注的实验步骤为____________________。
(6)以上现象能否说明没有被氧化。请判断并说明理由:______________________________。最终通过其他实验方案比较了和的还原性强弱。
参考答案
一、选择题(50分)
1.C2.C3.B4.C
5.D6.D7.B8.B
9.B10.B11.B12.C
13.B14.C15.D16.A
17.D18.C19.D20.D
21.C22.C23.B24.B
25.D
二、填空题(50分)
26.(10分) (没有单位不扣分)
27.(14分)
(1)① (2分)
②(2分)
③(2分)
(2)①D
②变大
③升温/增大浓度/减小生成物浓度(2分) 有1个即可。
④主反应放热,升温平衡左移,副反应吸热,升温平衡右移;升高温度对副反应的影响大于对主反应的影响,故转化率增大(2分)。分号前1分,分号后1分。
(3)bc(2分)(有a0分,b、c一个1分)
28.(12分)
(1)(2分)条件1分
(2)bc(2分)
(3)①偏大(2分)
②(2分)
(4)①(2分)
②使还原性增强(2分)
29.(14分,每空2分)
(1)+3
(2)取少量实验1中的翠绿色溶液,滴加溶液;不出现蓝色沉淀;
与生成稳定的,浓度降低,的氧化性和的还原性减弱
(3)
(4)Ⅱ中产生少量红褐色沉淀;或Ⅲ中产生大量红褐色沉淀和Ⅳ中得到翠绿色溶液。
(5)Ⅱ
(6)不能说明。有+4价碳的化合物生成,才能说明被氧化,以上现象无法判断是否生成了+4价碳的化合物,因此不能说明没有被氧化。
A
B
C
D
锌锰干电池
燃气燃烧
电池充电
水力发电
实验
温度/℃
溶液
稀
A
25
5
0.1
10
0.1
B
25
5
0.2
5
0.2
C
35
5
0.1
10
0.1
D
35
5
0.2
5
0.2
A.铜板打上铁铆钉后,铜板更易被腐蚀
B.暖气片表面刷油漆可防止金属腐蚀
C.连接锌棒后,电子由铁管道流向锌
D.阴极的电极反应式为
时间/s
初始物质
0
20
40
60
80
实验a:
0.10
0.07
0.045
0.04
0.04
0.10+0.20
……
实验序号
温度
出现沉淀所需的时间
Ⅰ
0℃
5mL
5mL
10mL
12s
Ⅱ
0℃
5mL
10mL
5mL
ts
Ⅲ
0℃
5mL
7mL
amL
10s
Ⅳ
30℃
5mL
5mL
10mL
4s
编号
温度(℃)
起始物质的量(ml)
平衡物质的量(ml)
Ⅰ
0.40
0.16
0.16
Ⅱ
0.20
0.09
0.09
序号
①
②
③
实验装置及操作
实验现象
溶液无明显变化
溶液立即变为黄色,产生大量无色气体;溶液温度升高;最终溶液仍为黄色
溶液立即变为棕黄色,产生少量无色气体,溶液颜色加深,温度无明显变化,最终有紫黑色沉淀析出
实验
现象
产生无色气泡
产生无色气泡
液面上方呈浅红棕色
产生无色气泡
(能使湿润pH试纸变蓝)
实验编号
①
②
实验装置
实验现象
连接装置5分钟后,灵敏电流计指针向左偏转,铜片表面均无明显现象
左侧铁片表面持续产生气泡,连接装置5分钟后,灵敏电流计指针向右偏转,右侧铁片表面无明显现象
操作
现象
在避光处,向溶液中缓慢加入溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤
得到翠绿色溶液和翠绿色晶体
步骤
操作
现象
Ⅰ
向溶液中加入溶液,过滤
立即产生黄色沉淀
Ⅱ
洗涤Ⅰ中的黄色沉淀,向洗涤液中加入少量的溶液,振荡,静置
产生少量的红褐色沉淀和无色气体
Ⅲ
向洗净的黄色沉淀中加入过量的溶液,振荡,静置
剧烈放热,产生大量的红褐色沉淀和无色气体
Ⅳ
待Ⅲ中充分反应后,向其中加入稀硫酸,调节pH约为4
得到翠绿色溶液
相关试卷
这是一份2023北京北师大附中高二上学期期中化学试卷(教师版),共25页。试卷主要包含了本试卷有2道大题,共12页,考生务必将答案填写在答题纸上,可能用到的相对原子质量, 时,水中存在电离平衡, 医学研究证实等内容,欢迎下载使用。
这是一份2023北京清华附中高一上学期期末化学试卷及答案(教师版),共18页。
这是一份北京市海淀区清华附中2023年第一学期期中化学试卷及答案,共18页。试卷主要包含了5 Zn, 下列物质中,不属于电解质的是, 下列物质属于纯净物旳是, 下列分类不正确的是, 下列电离方程式中,正确的是, 下列叙述正确的是等内容,欢迎下载使用。









