






还剩29页未读,
继续阅读
第1章 总结与检测课件(1)
展开
这是一份第1章 总结与检测课件(1),共37页。
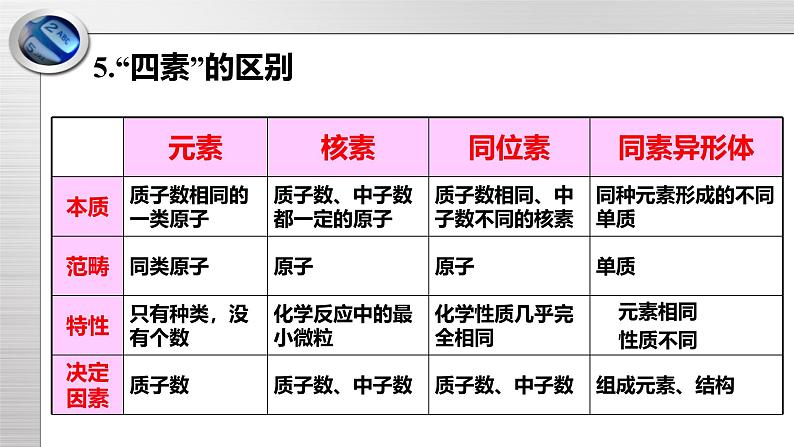
第1章原子结构 元素周期律复习课件一、原子核 核素【知识回顾】1.原子由原子核和核外电子构成,而原子核由质子和中子构成。2.在原子中,核电荷数=质子数=中子数3.人们将原子核中质子数和中子数之和称为质量数。4.具有相同数目的质子和相同数目的中子的一类原子称为核素。5.质子数相同而中子数不同的同一种元素的不同核素互为同位素。5.“四素”的区别【交流与研讨】1.质子和中子的相对质量都近似等于1,则质量数应该如何计算?质量数(A)=质子数(Z)+中子数(N)2.为什么质子数和中子数之和会叫做质量数呢?在某种程度上可以代表原子的质量,即质量数越大,原子的质量越大 【牛刀小试】1.对符号Cl的理解正确的是( )A.氯元素的一种原子的相对原子质量是35B.氯元素的一种原子的质子数是35C.氯元素的一种原子的质量数是17D.氯元素的一种原子的原子核内中子数是182.下列说法错误的是( )A.H、H+和H2是氢元素的三种不同粒子B.Ca和Ca、石墨和金刚石均为同位素C.H和H是不同的两种核素D.12C和14C互为同位素,物理性质不同,但化学性质几乎相同3、下列说法不正确的是A. 质量数是将原子核内所有的质子和中子的相对质量取整数值之和B. AZX表示一种X元素的一种原子,中子数为A-ZC. AZX中,A为该原子的相对原子质量的近似值D. 原子都质子和中子、电子组成,原子不带电二、核外电子排布【知识回顾】1.研读表格,说规律(1)K层为最外层时,最多容纳2个电子,其余层为最外层,最多容纳8个电子。(2)次外层最多容纳18个电子。(3)第n层最多容纳2×n2个电子。原子的核外电子排布规律: (1)电子总是尽先由里向外排列;(2)每个电子层最多可以容纳2×n2个电子;(3)最外层最多可以容纳8个电子(K层为最外层时,最多容纳2个);(4)次外层最多容纳18个电子。【交流与研讨】1.元素的性质与原子的最外层电子数密切相关吗?元素的性质与原子的最外层电子数密切相关。2.元素的化合价与原子的电子层结构,特别是最外层电子数有关。这种说法你同意吗?同意3.写出33号元素的原子结构示意图【牛刀小试】1.某元素原子的原子核外有三个电子层,最外层电子数是4,该原子核内的质子数是( )A.14 B.15 C.16 D.172.电子在核外运动时,离核最近,能量最低的在( )A. N层 B. M层 C. K层 D. L层3.关于原子结构的叙述正确的是A. 所有的原子核都是由质子和中子组成的B. 原子的最外层电子数不超过8个C. 稀有气体原子的最外层电子数均为8D. 原子的次外层电子数都是8个三、原子结构与元素原子得失电子能力【知识回顾】1.元素原子得失电子能力与原子的最外层电子数、核电荷数和电子层数均有关系。2.若原子电子层数相同,则核电荷数越大,最外层电子离核越近,原子越难失电子,越容易得电子;若原子的最外层电子数相同,则电子层数越多,最外层电子离核越远,原子越容易失电子,越难得电子。【交流与研讨】理解:1.元素的性质与原子的最外层电子数密切相关。元素的性质与原子的最外层电子数密切相关。稀有气体元素的原子最外层电子数为8(氦原子除外),原子结构稳定,原子既不容易获得电子也不易失去电子;金属元素原子最外层电子数一般小于4,原子较易失去电子形成阳离子;非金属元素原子最外层电子数一般大于4或等于4,原子较易获得电子形成阴离子。2.理解:化合价是元素的一种重要性质。化合价是元素的一种重要性质。元素化合价与原子的电子层结构,特别是最外层电子数有关。稀有气体元素原子的电子层已达到稳定结构,元素通常表现为0价;钠原子的最外层只有1个电子,原子容易失去1个电子形成钠离子而达到稳定结构,因此钠元素在化合物中呈+1价;氯原子的最外层有7个电子,原子容易获得1个电子形成氯离子而达到稳定结构,因此氯元素在氯化钠、氯化镁等氯化物中呈-1价。【牛刀小试】1.aAm+和bBn-核外电子层结构相同,则a值为 ( )A. b+n -m B. b-m- n C. b+n+m D. b-n+m2.某阴离子X2-有m个电子,其质量数a,则核内中子数为()A. m+2 B. m+5 C. a﹣m+2 D. a﹣m﹣2四、元素周期表【知识回顾】1.元素周期表:将电子层数相同的元素按照原子序数递增的顺序由左向右排成横行,再把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上向下排成纵列。2.周期表分为7个周期(短周期和长周期),16个族,族有主族和副族之分。【交流与研讨】1.碱土金属元素包括哪些?碱土金属元素包括:铍、镁、钙、锶、钡、镭元素周期表中位置:第IIA族元素的原子核外电子排布特点:最外层电子数为2,易失2个电子达到稳定结构自然界存在:化合态(化学性质活泼)单质物理性质特性:银白色、良好的导电性2.焰色试验用途是什么呢?多种金属或其化合物在灼烧时能使火焰呈现特殊的颜色,这在化学上叫焰色试验,亦称焰色反应。根据焰色试验可以判断某种元素的存在。3.氮族元素包括哪些?氮族元素包括:氮、磷、砷、锑、铋、镆元素周期表中位置:第VA族元素的原子核外电子排布特点:最外层电子数为5在最高价氧化物中的化合价为+5价既有非金属元素也有金属元素4.过渡元素,你如何理解?过渡元素元素周期表中第3----12列(副族和VIII族)中的元素称为过渡元素。过渡元素包括了大部分金属元素,如铁、铜、镍、银和金等。大部分过渡元素的单质既坚硬又有金属光泽;所有过渡元素的单质都具有良好的导电性;多数过渡元素的单质比较稳定,与空气和水反应缓慢或根本不能反应。 【牛刀小试】1.关于现行的元素周期表的说法正确的是( )A.元素周期表有8个主族B.元素周期表有7个周期C.短周期是指第一、二周期D.ⅠA族的元素全部是金属元素2.原子序数为x的元素位于周期表中的第ⅡA族,则x+1的元素不可能处在( )A.ⅢA族 B.ⅠA族C.镧系元素 D.ⅢB族3.下图是元素周期表的一部分(数字为原子序数),其中x为35的是( D )4.我国的纳米基础研究能力已跻身于世界前列,曾制得一种合成纳米材料,其化学式为RN。已知该化合物中的Rn+核外有28个电子。则R元素位于元素周期表的( )A.第三周期第ⅤA族 B.第四周期第ⅢA族C.第五周期第ⅢA族 D.第四周期第ⅤA族五、元素周期律、元素周期表应用【知识回顾】1.随着原子序数的递增,原子的核外电子排布、原子半径、化合价呈现周期性的变化。2.在同一周期中,虽然各元素的原子核外电子层数相同,但由左向右,核电荷数依次递增,原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强,因此金属性逐渐减弱,非金属性逐渐增强。元素的金属性和非金属随着原子序数的递增,而呈现周期性的变化3.元素周期律:元素的性质随着元素原子序数的递增而呈周期性变化的规律。4.元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。5.同主族元素原子最外层电子数相同,从上至下电子层数依次递增。原子半径依次变大,原子核对最外层电子的吸引力和束缚力依次变小,原子失电子能力依次增强,得电子能力依次减弱,元素金属性依次增强,非金属性依次减弱。【交流与研讨】1.利用元素周期表能干什么?元素周期表已成为化学家的得力工具,为研究物质结构、发现新元素、合成新物质、寻找新材料提供了许多有价值的指导。①在金属和非金属分界线处,寻找半导体材料。②寻找用于制农药的材料(非金属F、Cl、S、P等)③寻找优良催化剂,寻找耐高温耐酸碱腐蚀的特种合金,用来制造火箭、导弹、宇宙飞船等2.从物质类别、元素化合价、物质所含有关元素在元素周期表中的位置的角度可以认识有关物质的化学性质。请你预测硅及其化合物性质。硅的化学性质与非金属单质反应:Si+2F2=SiF4与氧化物反应:Si+2FeO======2Fe+SiO2与氢氟酸反应:Si+4HF=SiF4↑+2H2↑与碱反应:Si+2NaOH+H2O=Na2SiO3+2H2↑高温二氧化硅的化学性质与氢氟酸反应 SiO2 + 4HF == SiF4↑+ 2H2O 用于雕刻玻璃与碳反应 SiO2+2C ==== Si+2CO↑与镁反应 SiO2+2Mg====Si+2MgO与氧化钙反应 SiO2+CaO ==== CaSiO3 与碱溶液反应 SiO2+2NaOH == Na2SiO3+H2O高温高温高温硅酸如何制取硅酸可以由较强酸(碳酸、盐酸、硫酸等)和可溶性硅酸盐反应制硅酸的制备Na2SiO3+CO2+H2O==Na2CO3+H2SiO3↓2HCl + Na2SiO3 == H2SiO3↓+ 2NaCl 【牛刀小试】1.A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,原子半径按D、E、B、C、A顺序依次减小,B和E是同族,则下列推断中不正确的是:A.A、B、E一定不在同一周期 B.A、D可能在同一主族C.C的最高氧化物的水化物可能显碱性 D.C和D的单质可能化合成D2C22.某主族元素R的最高正化合价与负化合价的代数和为4,下列有关叙述正确的是A、R一定是第四周期元素 B、R的气态氢化物分子式为H2RC、R的气态氢化物比同周期其他元素的气态氢化物稳定 D、R的气态氢化物的水溶液显碱性已知铍(Be)的原子序数为4。下列相关叙述中,正确的是A.铍的原子半径大于硼的原子半径 B.氯化铍分子的化学式为BeCl2C.氢氧化铍的碱性比氢氧化钙的弱 D.单质铍跟冷水反应产生氢气3、电子层数相同的三种元素X、Y、Z,它们最高氧化物对应的水化物的酸性由强到弱的顺序是:HXO4>H2YO4>H3ZO4。下列判断中不正确的是( )A、原子序数:XY>ZC、元素的非金属性:X>Y>Z D、气态氢化物的稳定性:X>Y>Z六、金属性、非金属性比较【知识回顾】(一)证明金属性强弱的方法有:1、单质与水(或酸)反应生成氢气的难易(金属性越强反应越容易)2、最高价氧化物的水化物——氢氧化物的碱性强弱(金属性越强氢氧化物的碱性越强)(二)证明非金属性强弱的方法有:1、单质与氢气反应生成气态氢化物的难易(非金属性越强反应越容易)2、最高价氧化物的水化物的酸性强弱(非金属性越强酸性越强)3、气态氢化物的稳定性(非金属性越强气态氢化物越稳定)【交流与研讨】短周期主族元素中最高价氧化物的水化物酸性最强的是 HClO4 。碱性最强的是 NaOH 。气态氢化物稳定性最强的是 HF 。【牛刀小试】1.下列说法能够证明氯元素的非金属性比硫元素强的是( )A.氯气与氢气化合的条件比硫与氢气化合的条件更容易B. HCl的酸性比H2S强C. HCl的稳定性比H2S强D. HClO3的酸性比H2SO3强2、下列说法能证明钾元素比镁元素金属性强的是( )A.金属钾与冷水剧烈反应,镁与冷水几乎没有现象。B.KOH的碱性比Mg(OH)2强C.金属钾与MgCl2的水溶液反应可置换出金属镁D.在化学反应中,钾失去1个电子,镁失去2个电子谢谢听讲!
第1章原子结构 元素周期律复习课件一、原子核 核素【知识回顾】1.原子由原子核和核外电子构成,而原子核由质子和中子构成。2.在原子中,核电荷数=质子数=中子数3.人们将原子核中质子数和中子数之和称为质量数。4.具有相同数目的质子和相同数目的中子的一类原子称为核素。5.质子数相同而中子数不同的同一种元素的不同核素互为同位素。5.“四素”的区别【交流与研讨】1.质子和中子的相对质量都近似等于1,则质量数应该如何计算?质量数(A)=质子数(Z)+中子数(N)2.为什么质子数和中子数之和会叫做质量数呢?在某种程度上可以代表原子的质量,即质量数越大,原子的质量越大 【牛刀小试】1.对符号Cl的理解正确的是( )A.氯元素的一种原子的相对原子质量是35B.氯元素的一种原子的质子数是35C.氯元素的一种原子的质量数是17D.氯元素的一种原子的原子核内中子数是182.下列说法错误的是( )A.H、H+和H2是氢元素的三种不同粒子B.Ca和Ca、石墨和金刚石均为同位素C.H和H是不同的两种核素D.12C和14C互为同位素,物理性质不同,但化学性质几乎相同3、下列说法不正确的是A. 质量数是将原子核内所有的质子和中子的相对质量取整数值之和B. AZX表示一种X元素的一种原子,中子数为A-ZC. AZX中,A为该原子的相对原子质量的近似值D. 原子都质子和中子、电子组成,原子不带电二、核外电子排布【知识回顾】1.研读表格,说规律(1)K层为最外层时,最多容纳2个电子,其余层为最外层,最多容纳8个电子。(2)次外层最多容纳18个电子。(3)第n层最多容纳2×n2个电子。原子的核外电子排布规律: (1)电子总是尽先由里向外排列;(2)每个电子层最多可以容纳2×n2个电子;(3)最外层最多可以容纳8个电子(K层为最外层时,最多容纳2个);(4)次外层最多容纳18个电子。【交流与研讨】1.元素的性质与原子的最外层电子数密切相关吗?元素的性质与原子的最外层电子数密切相关。2.元素的化合价与原子的电子层结构,特别是最外层电子数有关。这种说法你同意吗?同意3.写出33号元素的原子结构示意图【牛刀小试】1.某元素原子的原子核外有三个电子层,最外层电子数是4,该原子核内的质子数是( )A.14 B.15 C.16 D.172.电子在核外运动时,离核最近,能量最低的在( )A. N层 B. M层 C. K层 D. L层3.关于原子结构的叙述正确的是A. 所有的原子核都是由质子和中子组成的B. 原子的最外层电子数不超过8个C. 稀有气体原子的最外层电子数均为8D. 原子的次外层电子数都是8个三、原子结构与元素原子得失电子能力【知识回顾】1.元素原子得失电子能力与原子的最外层电子数、核电荷数和电子层数均有关系。2.若原子电子层数相同,则核电荷数越大,最外层电子离核越近,原子越难失电子,越容易得电子;若原子的最外层电子数相同,则电子层数越多,最外层电子离核越远,原子越容易失电子,越难得电子。【交流与研讨】理解:1.元素的性质与原子的最外层电子数密切相关。元素的性质与原子的最外层电子数密切相关。稀有气体元素的原子最外层电子数为8(氦原子除外),原子结构稳定,原子既不容易获得电子也不易失去电子;金属元素原子最外层电子数一般小于4,原子较易失去电子形成阳离子;非金属元素原子最外层电子数一般大于4或等于4,原子较易获得电子形成阴离子。2.理解:化合价是元素的一种重要性质。化合价是元素的一种重要性质。元素化合价与原子的电子层结构,特别是最外层电子数有关。稀有气体元素原子的电子层已达到稳定结构,元素通常表现为0价;钠原子的最外层只有1个电子,原子容易失去1个电子形成钠离子而达到稳定结构,因此钠元素在化合物中呈+1价;氯原子的最外层有7个电子,原子容易获得1个电子形成氯离子而达到稳定结构,因此氯元素在氯化钠、氯化镁等氯化物中呈-1价。【牛刀小试】1.aAm+和bBn-核外电子层结构相同,则a值为 ( )A. b+n -m B. b-m- n C. b+n+m D. b-n+m2.某阴离子X2-有m个电子,其质量数a,则核内中子数为()A. m+2 B. m+5 C. a﹣m+2 D. a﹣m﹣2四、元素周期表【知识回顾】1.元素周期表:将电子层数相同的元素按照原子序数递增的顺序由左向右排成横行,再把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上向下排成纵列。2.周期表分为7个周期(短周期和长周期),16个族,族有主族和副族之分。【交流与研讨】1.碱土金属元素包括哪些?碱土金属元素包括:铍、镁、钙、锶、钡、镭元素周期表中位置:第IIA族元素的原子核外电子排布特点:最外层电子数为2,易失2个电子达到稳定结构自然界存在:化合态(化学性质活泼)单质物理性质特性:银白色、良好的导电性2.焰色试验用途是什么呢?多种金属或其化合物在灼烧时能使火焰呈现特殊的颜色,这在化学上叫焰色试验,亦称焰色反应。根据焰色试验可以判断某种元素的存在。3.氮族元素包括哪些?氮族元素包括:氮、磷、砷、锑、铋、镆元素周期表中位置:第VA族元素的原子核外电子排布特点:最外层电子数为5在最高价氧化物中的化合价为+5价既有非金属元素也有金属元素4.过渡元素,你如何理解?过渡元素元素周期表中第3----12列(副族和VIII族)中的元素称为过渡元素。过渡元素包括了大部分金属元素,如铁、铜、镍、银和金等。大部分过渡元素的单质既坚硬又有金属光泽;所有过渡元素的单质都具有良好的导电性;多数过渡元素的单质比较稳定,与空气和水反应缓慢或根本不能反应。 【牛刀小试】1.关于现行的元素周期表的说法正确的是( )A.元素周期表有8个主族B.元素周期表有7个周期C.短周期是指第一、二周期D.ⅠA族的元素全部是金属元素2.原子序数为x的元素位于周期表中的第ⅡA族,则x+1的元素不可能处在( )A.ⅢA族 B.ⅠA族C.镧系元素 D.ⅢB族3.下图是元素周期表的一部分(数字为原子序数),其中x为35的是( D )4.我国的纳米基础研究能力已跻身于世界前列,曾制得一种合成纳米材料,其化学式为RN。已知该化合物中的Rn+核外有28个电子。则R元素位于元素周期表的( )A.第三周期第ⅤA族 B.第四周期第ⅢA族C.第五周期第ⅢA族 D.第四周期第ⅤA族五、元素周期律、元素周期表应用【知识回顾】1.随着原子序数的递增,原子的核外电子排布、原子半径、化合价呈现周期性的变化。2.在同一周期中,虽然各元素的原子核外电子层数相同,但由左向右,核电荷数依次递增,原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强,因此金属性逐渐减弱,非金属性逐渐增强。元素的金属性和非金属随着原子序数的递增,而呈现周期性的变化3.元素周期律:元素的性质随着元素原子序数的递增而呈周期性变化的规律。4.元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。5.同主族元素原子最外层电子数相同,从上至下电子层数依次递增。原子半径依次变大,原子核对最外层电子的吸引力和束缚力依次变小,原子失电子能力依次增强,得电子能力依次减弱,元素金属性依次增强,非金属性依次减弱。【交流与研讨】1.利用元素周期表能干什么?元素周期表已成为化学家的得力工具,为研究物质结构、发现新元素、合成新物质、寻找新材料提供了许多有价值的指导。①在金属和非金属分界线处,寻找半导体材料。②寻找用于制农药的材料(非金属F、Cl、S、P等)③寻找优良催化剂,寻找耐高温耐酸碱腐蚀的特种合金,用来制造火箭、导弹、宇宙飞船等2.从物质类别、元素化合价、物质所含有关元素在元素周期表中的位置的角度可以认识有关物质的化学性质。请你预测硅及其化合物性质。硅的化学性质与非金属单质反应:Si+2F2=SiF4与氧化物反应:Si+2FeO======2Fe+SiO2与氢氟酸反应:Si+4HF=SiF4↑+2H2↑与碱反应:Si+2NaOH+H2O=Na2SiO3+2H2↑高温二氧化硅的化学性质与氢氟酸反应 SiO2 + 4HF == SiF4↑+ 2H2O 用于雕刻玻璃与碳反应 SiO2+2C ==== Si+2CO↑与镁反应 SiO2+2Mg====Si+2MgO与氧化钙反应 SiO2+CaO ==== CaSiO3 与碱溶液反应 SiO2+2NaOH == Na2SiO3+H2O高温高温高温硅酸如何制取硅酸可以由较强酸(碳酸、盐酸、硫酸等)和可溶性硅酸盐反应制硅酸的制备Na2SiO3+CO2+H2O==Na2CO3+H2SiO3↓2HCl + Na2SiO3 == H2SiO3↓+ 2NaCl 【牛刀小试】1.A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,原子半径按D、E、B、C、A顺序依次减小,B和E是同族,则下列推断中不正确的是:A.A、B、E一定不在同一周期 B.A、D可能在同一主族C.C的最高氧化物的水化物可能显碱性 D.C和D的单质可能化合成D2C22.某主族元素R的最高正化合价与负化合价的代数和为4,下列有关叙述正确的是A、R一定是第四周期元素 B、R的气态氢化物分子式为H2RC、R的气态氢化物比同周期其他元素的气态氢化物稳定 D、R的气态氢化物的水溶液显碱性已知铍(Be)的原子序数为4。下列相关叙述中,正确的是A.铍的原子半径大于硼的原子半径 B.氯化铍分子的化学式为BeCl2C.氢氧化铍的碱性比氢氧化钙的弱 D.单质铍跟冷水反应产生氢气3、电子层数相同的三种元素X、Y、Z,它们最高氧化物对应的水化物的酸性由强到弱的顺序是:HXO4>H2YO4>H3ZO4。下列判断中不正确的是( )A、原子序数:X
相关资料
更多









