

2025届山东省高三上学期10月第一次备考监测联考化学试题
展开
这是一份2025届山东省高三上学期10月第一次备考监测联考化学试题,共13页。试卷主要包含了可能用到的相对原子质量,一种生成高铁酸钠的反应为,下列装置能达到实验目的的是等内容,欢迎下载使用。
本试卷满分100分,考试用时90分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.可能用到的相对原子质量:
H1 C12 N14 O16 S32 K39 Mn55 Fe56 Cu64 Zn65 Ba137
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.每一种生肖都有其独特的文化内涵。下列与生肖有关的文物中,主要材质为金属材料的是( )
2.幸福不会从天而降,美好生活靠劳动创造。下列劳动领目与所述的化学知识没有关联的是( ).
3.化学实验是化学探究的一种重要途径。下列有关实验的描述正确的是( )
A.进行焰色试验时,可用玻璃棒替代铂丝
B.可用氢氟酸清洗做过硅酸分解实验的瓷坩埚
C.容量瓶、滴定管、分液漏斗使用前均需要检验是否漏液
D.制备金属镁的电解装置失火时,可以使用二氧化碳灭火器灭火
4.宏观辨识与微观探析是化学学科核心素养之一,下列离子方程式书写错误的是( )
A.溶液与少量的溶液混合:
B.向“84”消毒液中通入过量:
C.固体与氢碘酸反应:
D.向溶液中滴加足量NaOH溶液:
5.下列选项中的物质按图示路径不能一步转化的是( )
6.钠和钠的化合物有许多重要的用途,如碳酸钠可用于从海水中提取溴,涉及的反应为。下列说法错误的是( )
A.用双线桥法标出电子的转移:
B.该反应中氧化剂与还原剂的物质的量之比是5∶1
C.等物质的量的和分别与足量的盐酸反应,在相同条件下产生的体积小于产生的
D.碳酸氢钠溶于水显碱性,可用于去除油污
7.关于元素及其化合物的性质,下列说法正确的是( )
A.漂白粉和洁厕净可混合使用以提高消毒效果
B.浓硫酸具有吸水性,所以用浓硫酸在纸上书写时字迹变黑
C.硝酸见光、受热易分解,一般保存在棕色试剂瓶中,并放置在阴凉处
D.La-Ni储氢合金在加热条件下可与氢气反应生成稳定的金属氢化物
8.一种生成高铁酸钠的反应为。设为阿伏加德罗常数的值,下列说法正确的是( )
A.常温下,1 L 的溶液中,水电离出的数为
B.该反应中每生成2.24 L(标准状况下)的,转移的电子数为
C.等物质的量的和分别与水反应,生成的NaOH均为
D.浓度均为0.1 ml⋅L的溶液和溶液中,数目均为
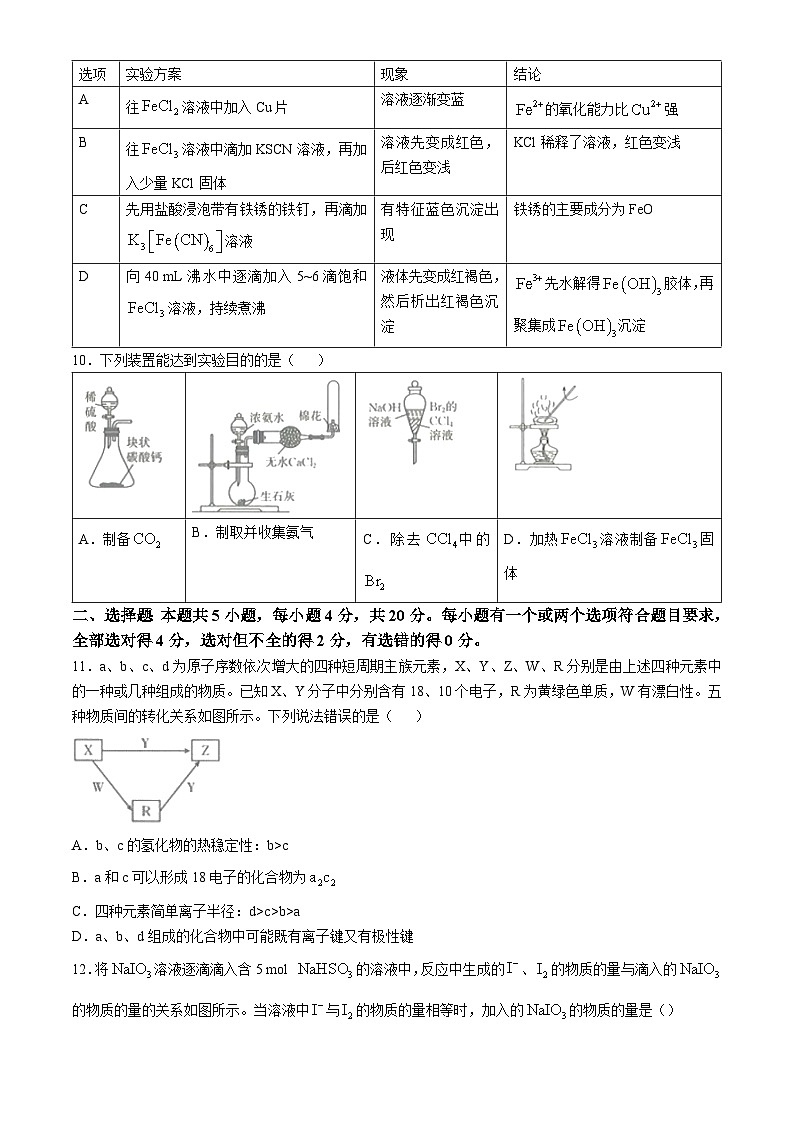
9.探究铁及其化合物的性质,下列实验方案、现象和结论都正确的是( )
10.下列装置能达到实验目的的是( )
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.a、b、c、d为原子序数依次增大的四种短周期主族元素,X、Y、Z、W、R分别是由上述四种元素中的一种或几种组成的物质。已知X、Y分子中分别含有18、10个电子,R为黄绿色单质,W有漂白性。五种物质间的转化关系如图所示。下列说法错误的是( )
A.b、c的氢化物的热稳定性:b>c
B.a和c可以形成18电子的化合物为
C.四种元素简单离子半径:d>c>b>a
D.a、b、d组成的化合物中可能既有离子键又有极性键
12.将溶液逐滴滴入含5 ml 的溶液中,反应中生成的、的物质的量与滴入的的物质的量的关系如图所示。当溶液中与的物质的量相等时,加入的的物质的量是()
A.1.525 mlB.1.875 mlC.2.225 mlD.2.275 ml
13.现有一包固体粉末,可能由,,,NaCl,中的一种或几种组成。为确定其成分,进行下列实验。
已知:加入的试剂均过量,硫酸银可溶于稀硝酸。
以下说法正确的是( )
A.白色沉淀A的成分是和
B.无色溶液B中的溶质一定有,和NaCl
C.该固体粉末中一定有,,和
D.该固体粉末中一定有、和,可能有和NaCl
14.铁盐法是处理含砷废水的主要方法之一,已知As(Ⅲ)比As(Ⅴ)毒性大且不易沉降,砷(Ⅴ)酸铁、砷(Ⅴ)酸钙的溶解度很小。硫酸厂酸性废水[主要含有硫酸和含砷(Ⅲ)化合物]的处理步骤如下:
(1)向废水中加入消石灰,调节废水的pH至5~6,过滤后再加入一定量绿矾,得到混合溶液;
(2)向上述混合溶液中加入高浓度双氧水作为氧化剂,搅拌,至溶液变为黄褐色浑浊液;
(3)再加入碱调节反应后的浑浊液pH至7~9,出现大量褐色沉淀,搅拌,充分反应后,静置、过滤,回收滤渣,检测滤液中砷含量,达标后外排。
下列说法正确的是( )
A.步骤(1)中过滤出的滤渣的主要成分是
B.步骤(2)中双氧水的作用只是将三价砷氧化为五价砷
C.亚砷酸()和砷酸()均为强酸
D.步骤(3)中,工业上调节反应后的浑浊液的pH所用的碱最好是
15.化学上常用标准电极电势(氧化型/还原型)比较物质的氧化能力。值越高,氧化型物质的氧化能力越强,值越低,还原型物质的还原能力越强。值与体系的pH有关。根据表格信息,判断下列说法错误的是( )
A.实验室可用与浓盐酸反应制备
B.酸性条件中,氧化性强弱顺序为
C.已知V,则的还原性弱于的还原性
D.向硫酸酸化含的溶液中加入,充分反应后滴加KSCN溶液,可观察到溶液变红
三、非选择题:本题共5小题,共60分。
16.(12分)五水硫酸铜俗称蓝矾、胆矾或铜矾,具有催吐、去腐、解毒等功效,但有一定的副作用,易溶于水,难溶于乙醇。回答下列问题:
(1)铜与过量溶液反应的探究如下:
实验②中Cu溶解的离子方程式为______。
(2)某学习小组利用含铜90%的废铜屑制取硫酸铜晶体,有两种途径可供选择:
途径A:
途径B:
①写出途径A的化学方程式:____________。
②与途径A相比,途径B的优点是______。
(3)硫酸铜溶液经加热蒸发、______、过滤、______、干燥实验操作,得到胆矾。
(4)将制得的晶体进行热重分析,其热重曲线(即样品质量随温度变化的曲线,T℃时,已完全失去结晶水)如图所示。______。
(5)下列操作中,会导致结晶水数目测定值偏低的是______(填标号)。
①制得的结晶水合物未充分干燥②坩埚未置于干燥器中冷却③加热时有少量固体迸溅出来
17.(12分)硫的化合物在生产、生活和科学研究中有着广泛的应用,但含硫化合物的开发和利用时需要防治环境污染。
Ⅰ.氨法脱硫技术可吸收硫酸工业尾气中的,同时制得硫酸铵,主要工艺流程如图所示。
(1)的随意排放易造成的环境问题是____________。
(2)用氨水吸收能得到含和的吸收液,写出生成反应的离子方程式:____________。
(3)若向吸收后的吸收塔中通入可将转化为,写出与发生反应生成和的化学方程式:____________。
(4)通入空气的目的是将转化为。某实验小组为测定被空气氧化的程度,设计了以下实验方案。
已知:①氧化率
②“氧化”后的溶液中 ml⋅L
【方案一】取100 mL“氧化”后的溶液于烧杯中,先加入足量的稀盐酸,充分反应后,再加入足量溶液,过滤、洗涤、烘干,得到沉淀18.64g。则的氧化率______(用含的计算式表示)。
【方案二】取20.00 mL“氧化”后的溶液于锥形瓶中,用浓度为c ml⋅L的标准溶液(经硫酸酸化)滴定,滴定过程中锰元素被还原成。重复操作三次,恰好完全反应时平均消耗标准溶液的体积是V mL。该滴定过程发生反应的离子方程式为______,的氧化率______(用含、c、V的计算式表示)。
Ⅱ.用硫酸酸化的浆液可吸收工业废气中的生成。
(5)已知浆液中含量为a%,工业废气中含量为b g⋅m,的吸收率可达90%,则处理1000m3该工业尾气,可得到的质量为______(用含字母的代数式表示)kg。
18.(11分)和可以作为锂离子电池的正极材料。根据所学知识,回答下列问题:
Ⅰ.一种制备的流程如图所示:
(1)中Fe的化合价为______。
(2)“共沉淀”反应投料时,不将和LiOH溶液直接混合的原因是____________。
(3)检验产品中是否混有或杂质的实验操作是____________。
(4)“共沉淀”反应可得到和,该反应的化学方程式为____________。
Ⅱ.工业上可用磷酸亚铁粗产品(混有氢氧化铁)制备磷酸铁
()。其他条件一定,制备时测得Fe的有效转化率与溶液pH的关系如图所示。
(5)某研究小组设计制备磷酸铁的实验方案:边搅拌边向磷酸亚铁粗产品中加入______溶液至完全溶解,向溶液中加入足量的______溶液充分反应,边搅拌边逐滴加入______溶液至溶液pH约为1.5,充分反应至沉淀不再产生,过滤、洗涤、干燥,得到产品。(实验中须使用的试剂:1 ml⋅L 溶液、30%溶液1 ml⋅L 溶液)
19.(12分)柠檬酸铁铵易溶于水,不溶于乙醇等有机溶剂,是一种含铁量较高的补铁剂。实验室利用柠檬酸()制备柠檬酸铁铵的流程和装置如图。
已知:柠檬酸铁铵是柠檬酸铁()和柠檬酸铵的复盐。
回答下列问题:
(1)仪器A的名称是______。
(2)该实验所用的氨水(主要溶质为)的质量分数为15%,密度为0.94 g⋅mL则该氨水的物质的量浓度为______ml⋅L。实验室配制该物质的量浓度氨水的过程中,不需要用到的仪器是______(填标号)。
(3)写出反应生成柠檬酸亚铁()的化学方程式:____________.
(4)制备柠檬酸亚铁铵和柠檬酸铁铵时均需控温40℃,其原因是____________.
(5)测定柠檬酸铁铵组成的实验方案如下:取适量样品溶于蒸馏水,配成100 mL溶液。取20.00 mL溶液,加入足量NaOH溶液充分反应,过滤、洗涤,灼烧至恒重,测得固体质量为0.32 g。另取20.00 mL溶液于锥形瓶中,依次加入足量EDTA、HCHO溶液充分反应,滴入2滴酚酞试液,用1.00 ml⋅L NaOH标准溶液滴定至终点,消耗标准溶液12.00mL。,]
柠檬酸铁铵化学式为______。
20.(13分)过渡金属在日常生活、工业生产和医疗化工中随处可见,它们渗透到我们生活的方方面面。请回答下列问题:
Ⅰ.几种铬(Cr)的化合物的转化关系如图所示:
溶液溶液
(1)反应②的离子方程式为______;碱性条件下,氧化性:______(填“>”或“<”)。
(2)已知铬的化合物色彩众多,如(紫色)、(灰蓝色沉淀)、(绿色)等。向溶液中滴加NaOH溶液至过量,可观察到的现象是____________。
(3)已知晶体{配合物化学式可表示为}有3种不同颜色,其配位数均为6,实验测得1 ml不同颜色的晶体分别与足量的硝酸银溶液反应,生成沉淀的物质的量如表所示:
若晶体为深绿色,则______.
钒性能优良,用途广泛,有金属“维生素”之称。
(4)将废钒催化剂(主要成分为)与稀硫酸、溶液混合,充分反应后生成,该反应中氧化剂和还原剂的物质的量之比为______。
(5)能与盐酸反应生成和一种黄绿色气体,该黄绿色气体能与溶液反应而被吸收,则:,,的还原性由强到弱的顺序是____________。
(6)在氮气氛围、碳高温条件下还原氮化制备VN,还生成一种具有还原性的气体,则生成标准状况下22.4 L该还原性气体时,反应转移的电子数为______。
山东省第一次备考监测联考
化学参考答案
1.A【解析】本题主要考查化学与材料,侧重考查学生对基础知识的认知能力。错金杜虎符的主要材料为金属,A项符合题意。
2.A【解析】本题主要考查化学与生活,侧重考查学生对基础知识的认知能力。次氯酸钠具有氧化性,其溶液可以杀菌消毒,A项符合题意。
3.C【解析】玻璃中含有钠元素,不能代替铂丝进行焰色试验,A项错误;氢氟酸会与反应,不能用于清洗瓷坩埚,B项错误;金属镁会与二氧化碳反应,D项错误。
4.B【解析】本题主要考查离子方程式书写的正误判断,侧重考查学生对基础知识的理解和应用能力。“84”消毒液的主要成分是NaClO,将过量的气体通入NaClO溶液中会发生氧化还原反应,离子方程式为.B项错误。
5.D【解析】本题主要考查物质的转化,侧重考查学生对基础知识的认知能力。不能一步转化为,D项符合题意。
6.C【解析】本题主要考查物质转化与氧化还原反应相关知识,侧重考查学生对基础知识的理解和应用能力。根据碳原子守恒,等物质的量的和分别与足量的盐酸反应产生的物质的量相等,C项错误。
7.C【解析】两种物质混合使用会生成氯气,造成毒气污染,A项错误;浓硫酸使纸张变黑是由于浓硫酸的脱水性,B项错误;形成金属氢化物不需要加热,加热会使氢化物分解,D项错误。
8.B【解析】水电离出的与一样多,应为,A项错误;物质的量未知,无法计算,C项错误;体积未知,无法计算,D项错误。
9.D【解析】本题主要考查实验方案的设计与评价,侧重考查学生的实验探究能力。往溶液中加入Cu片,铜活动性小于铁,不能发生反应,A项错误;往溶液中滴加KSCN溶液•再加入少量KCl固体,溶液先变成红色,后不会变浅,KCl电离出的氯离子和钾离子不参与反应,KCl固体也不会稀释溶液,B项错误;铁锈的主要成分为,用盐酸浸泡带有铁锈的铁钉生成,再与铁反应生成,滴加溶液生成蓝色沉淀,C项错误。
10.C【解析】利用碳酸钙制备时不能使用硫酸,A项不符合题意;收集氨气时,导管要伸入试管底部,B项不符合题意;蒸发氯化铁溶液时,铁离子水解,制得的固体为,继续加热时,会分解生成氧化铁,D项不符合题意。
11.AC【解析】根据题意可知,R为氯气,X与W反应可制得R,同时X为18电子的分子,由此可知X为HCl,W为HClO,能与HCl反应的10电子的分子只有,由此可知Y为,综上分析可得,a、b、c、d分别为H、N、O、Cl。N和O的氢化物中,的热稳定性较差,A项错误;,C项错误。
12.B
13.B
14.AD【解析】本题主要考查实验方案的设计与评价,侧重考查学生的实验探究能力。由题意可知,步骤(2)中双氧水的作用是将溶液中的三价砷氧化为五价砷,同时将亚铁离子氧化为铁离子,使生成的铁离子与砷酸根离子反应生成难溶的砷酸铁沉淀,B项错误;亚砷酸()和砷酸()均为弱酸,C项错误。
15.C【解析】根据题意可知,值越低,还原性越强,故的还原性强于.C项错误。
16.(1)(2分)
(2)①(浓)(2分)
②不会产生二氧化硫且产生等量胆矾消耗硫酸少(硫酸利用率高)(2分)
(3)冷却结晶(1分);乙醇洗涤(1分)
(4)5(2分)
(5)②(2分)
【解析】本题主要考查硫酸铜的制备,考查学生对基础知识的理解能力和综合运用能力。
(3)胆矾易溶于水,难溶于乙醇,硫酸铜溶液制硫酸铜晶体,操作步骤有加热蒸发、冷却结晶、过滤、乙醇洗涤、干燥。
17.(1)酸雨(1分)
(2)(2分)
(3)(2分)
(4)(1分);(2分);(2分)
(5)或(2分)
【解析】本题主要考查含硫化合物的性质及其转化,考查学生对基础知识的理解和应用能力。
(4)生成的沉淀为,生成的质量为18.64 g,即0.08 ml,说明生成的硫酸铵的物质的量浓度为0.8 ml⋅L,则的氧化率为。用酸性溶液滴定亚硫酸铵,亚硫酸根离子被酸性高锰酸钾氧化成硫酸根离子,高锰酸根离子被还原为,反应的离子方程式为。滴定过程消耗高锰酸钾标准溶液的体积为V mL,消耗高锰酸钾的物质的量为ml,则消耗的的物质的量为ml,初始时20.00 mL亚硫酸铵溶液中有亚硫酸铵 ml,则亚硫酸铵的氧化率为。
(5)1000 m3该工业尾气中含有的的物质的量为ml,由可知,生成的物质的量为mlml,质量为mlg⋅mlg或)kg。
18.(1)+2(2分)
(2)和LiOH溶液直接混合会生成,而极易被氧化,最终产品中混有Fe(Ⅲ)化合物(2分)
(3)取少量产品于试管中,先加适量盐酸溶解,再向试管中滴加几滴KSCN溶液(2分)
(4)(2分)
(5)1 ml⋅L (1分);30%(1分);11 ml⋅L (1分)
19.(1)三颈烧瓶(2分)
(2)8.29(或8.3,2分);A(2分)
(3)(2分)
(4)温度低于40℃时,化学反应速率慢,温度高于40℃时,双氧水和氨水发生分解反应而损耗(2分)
(5)(2分)
20.(1)(2分):>(1分)
(2)开始有灰蓝色沉淀生成,后沉淀溶解,最终溶液变成绿色(2分)
(3)2∶1(2分)
(4)1∶1(2分)
(5)(2分)
(6)(或,2分)
【解析】本题主要考查过渡金属及其化合物的性质,考查学生对基础知识的理解和应用能力。
(3)因为深绿色晶体只生成1 ml AgCl,说明外界只有1 ml,根据配位数为6,可得出深绿色晶体配合物的化学式为,。
(6)根据题意可知,高温条件下与C、反应除生成VN外,还有一种具有还原性的气体,根据元素守恒,该气体应是CO,化学方程式为,该反应中C元素由0价上升到+2价,生成标准状况下22.4 L(物质的量为1 ml)CO时,反应转移的电子数为。
A.错金杜虎符
B.龙形玉佩
C.瓷猪(宋)
D.陶鸡
选项
劳动项目
化学知识
A
医院消毒:喷洒次氯酸钠溶液
次氯酸钠溶液显碱性
B
生产活动:海水晒盐
蒸发原理
C
家务劳动:用食醋洗水壶
醋酸可与水垢中的、反应
D
工业生产:技术人员开发高端耐腐蚀镀铝钢板
铝能形成致密氧化膜
选项
A
B
C
D
X
Cu₂O
Fe
Y
Z
选项
实验方案
现象
结论
A
往溶液中加入Cu片
溶液逐渐变蓝
的氧化能力比强
B
往溶液中滴加KSCN溶液,再加入少量KCl固体
溶液先变成红色,后红色变浅
KCl稀释了溶液,红色变浅
C
先用盐酸浸泡带有铁锈的铁钉,再滴加溶液
有特征蓝色沉淀出现
铁锈的主要成分为FeO
D
向40 mL沸水中逐滴加入5~6滴饱和溶液,持续煮沸
液体先变成红褐色,然后析出红褐色沉淀
先水解得胶体,再聚集成沉淀
A.制备
B.制取并收集氨气
C.除去中的
D.加热溶液制备固体
氧化型/还原型物质
(酸性条件中)
1.685V
1.51V
0.77V
1.36V
0.991V
1.423V
晶体颜色
深绿色
浅绿色
紫色
AgCl沉淀的物质的量/ml
1
2
3
相关试卷
这是一份山东省部分学校高三上学期第一次练考监测化学试题,共7页。
这是一份云南三校2025届高三上学期高考备考实用性联考卷(二)化学试题,共17页。
这是一份云南三校2025届高三上学期高考备考实用性联考卷(二)化学试题,文件包含云南三校2025届高三上学期高考备考实用性联考卷二化学试题docx、云南三校2025届高三上学期高考备考实用性联考卷二化学试题pdf等2份试卷配套教学资源,其中试卷共51页, 欢迎下载使用。








