
北京市第二十中学2024-2025学年高三上学期10月月考 化学试题
展开这是一份北京市第二十中学2024-2025学年高三上学期10月月考 化学试题,共12页。试卷主要包含了10,5Zn 65Cd 112,下列化学用语或图示表达正确的是,下列实验操作及现象表述错误的是等内容,欢迎下载使用。
班级:姓名:
相对原子质量:H 1C 12N 14O 16Cu 64Cl 35.5Zn 65Cd 112
第一部分(42分)
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1.下列资源利用中,在给定工艺条件下转化关系正确的是
A.煤煤油B.石油乙烯C.油脂甘油D.淀粉乙醇
2.下列化学用语或图示表达正确的是
A.的VSEPR模型:
B.用电子式表示Na和Cl形成NaCl的过程:
C.的电子式:
D.中共价键的电子云图:
3.下列物质性质的比较,与键的极性或分子的极性无关的是
A.酸性:B.硬度:金刚石>石英
C.水中溶解度:D.沸点:
4.工业制备硝酸反应之一:。表示阿伏加德罗常数,下列说法正确的是
A.室温下,22.4L 中所含原子总数为3
B.46g 和的混合气体中含有的氮原子总数为2
C.上述反应,生成1ml 转移电子的数目为
D.标准状况下,11.2L NO中所含电子总数为5
5.下列离子方程式正确的是
A.用足量的NaOH溶液吸收烟气中的:
B.溶液中滴加稀氨水:
C.用氯化铁溶液蚀刻覆铜板:
D.将等物质的量浓度的和溶液以体积比1∶1混合:
6.下列实验操作及现象表述错误的是
A.向溶液中加入溶液,产生白色沉淀并有无色气泡生成
B.向溶液中通入足量的气体,溶液先变浑浊,然后重新变清澈
C.向溶液中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝
D.化合物溶于溶于氢碘酸(HI),再加萃取,有机层呈紫红色
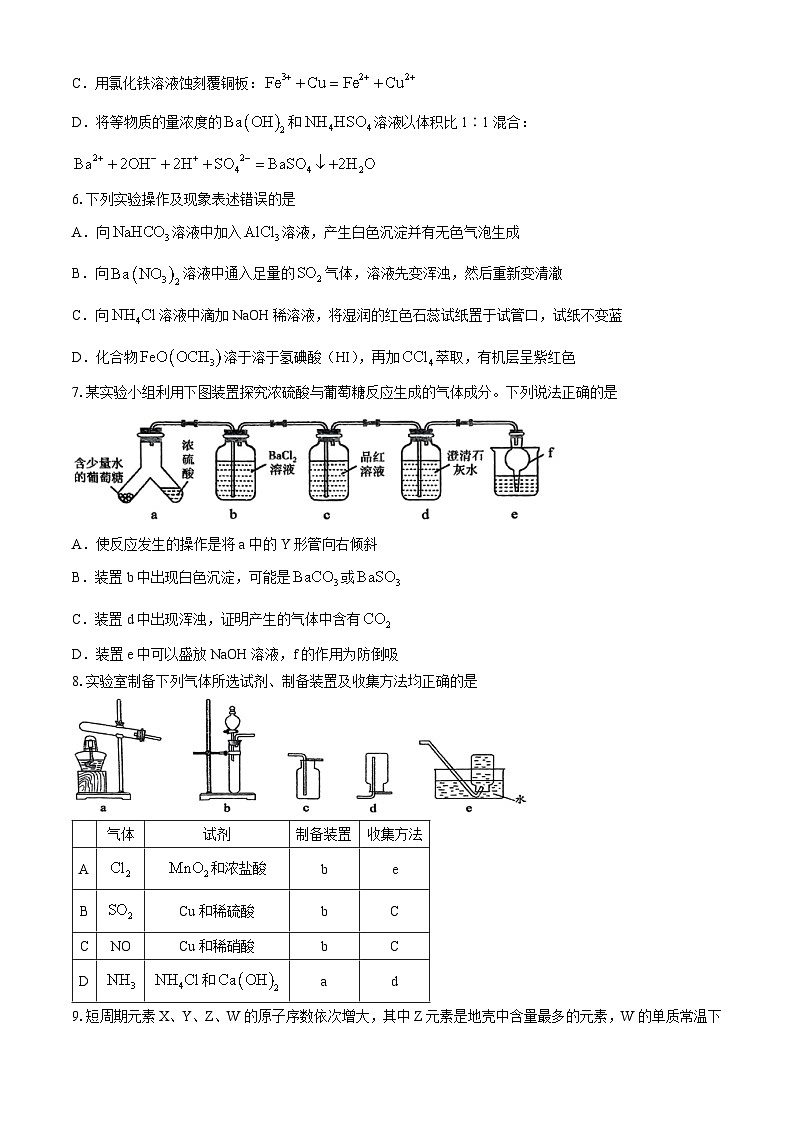
7.某实验小组利用下图装置探究浓硫酸与葡萄糖反应生成的气体成分。下列说法正确的是
A.使反应发生的操作是将a中的Y形管向右倾斜
B.装置b中出现白色沉淀,可能是或
C.装置d中出现浑浊,证明产生的气体中含有
D.装置e中可以盛放NaOH溶液,f的作用为防倒吸
8.实验室制备下列气体所选试剂、制备装置及收集方法均正确的是
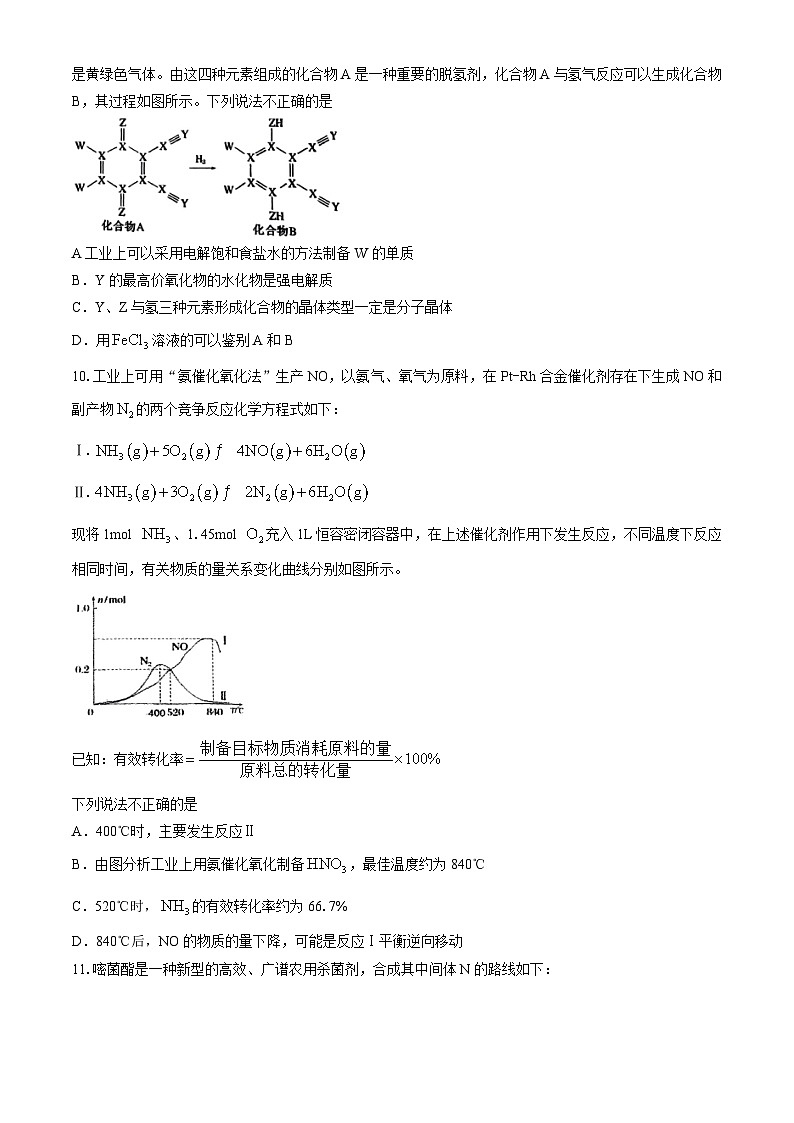
9.短周期元素X、Y、Z、W的原子序数依次增大,其中Z元素是地壳中含量最多的元素,W的单质常温下是黄绿色气体。由这四种元素组成的化合物A是一种重要的脱氢剂,化合物A与氢气反应可以生成化合物B,其过程如图所示。下列说法不正确的是
A工业上可以采用电解饱和食盐水的方法制备W的单质
B.Y的最高价氧化物的水化物是强电解质
C.Y、Z与氢三种元素形成化合物的晶体类型一定是分子晶体
D.用溶液的可以鉴别A和B
10.工业上可用“氨催化氧化法”生产NO,以氨气、氧气为原料,在Pt-Rh合金催化剂存在下生成NO和副产物的两个竞争反应化学方程式如下:
Ⅰ.
Ⅱ.
现将1ml 、1.45ml 充入1L恒容密闭容器中,在上述催化剂作用下发生反应,不同温度下反应相同时间,有关物质的量关系变化曲线分别如图所示。
已知:有效转化率
下列说法不正确的是
A.400℃时,主要发生反应Ⅱ
B.由图分析工业上用氨催化氧化制备,最佳温度约为840℃
C.520℃时,的有效转化率约为66.7%
D.840℃后,NO的物质的量下降,可能是反应Ⅰ平衡逆向移动
11.嘧菌酯是一种新型的高效、广谱农用杀菌剂,合成其中间体N的路线如下:
下列说法不正确的是
A.1ml K最多可以与2ml NaOH发生反应B.L的核磁共振氢谱有两组峰
C.N中含有两种含氧官能团D.生成物M与N的化学计量数之比是1∶1
12.镍电池芯废料中主要含有金属镍,还含有金属钴、铁、铝。一种从镍电池芯废料中回收金属的工艺流程如下,下列说法正确的是
A.“酸溶”时,若改用浓硫酸,反应速率更快,效果更好
B.在“氧化除杂”和“酸溶”中的作用不同
C.“钴镍分离”时发生反应的离子方程式为
D.“结晶”时,快速蒸发溶液,得到的晶体颗粒较大
13.中的Si原子均通过杂化轨道成键,与NaOH溶液反应Si元素均转化成。下列说法不正确的是
A.分子结构可能是B.与水反应可生成一种强酸
C.与NaOH溶液反应会产生D.沸点低于相同结构的
14.小组同学探究不同条件下氯气与二价锰化合物的反应,实验记录如下:
资料:水溶液中,为白色沉淀,呈绿色;浓碱性条件下,可被还原为;的氧化性与溶液的酸碱性无关;NaClO的氧化性随碱性增强而减弱。
下列说法不正确的是
A.对比实验①和②可知,碱性环境中,二价锰化合物可被氧化到更高价态
B.④中溶液紫色迅速变为绿色的可能原因是
C.④中绿色缓慢加深的可能原因是被氧化为
D.③中未得到绿色溶液,可能是因为被氧化为的反应速率快于被还原为的反应速率
第二部分(58分)
本部分共5题,请在答题纸指定位置答题。
15.(12分)
某钠离子电池以的碳酸丙烯酯溶液作电解质溶液,作正极材料,Na作负极材料。
(1)与环氧丙烷()在一定条件下反应制得碳酸丙烯酯。
①是 (填“极性”或“非极性”)分子。
②环氧丙烷中,O原子的杂化轨道类型是 杂化。
③沸点:环氧丙烷 (填“>”或“<”),解释其原因: 。
(2)溶液与溶液混合可制备晶体。
①基态Mn原子的电子排布式是 。
②的性质与卤素离子相近,被称为拟卤离子,被称为拟卤素。
ⅰ.与反应的生成物的结构式分别是H—C≡N、 。
ⅱ.HCN有酸性但乙炔无明显酸性,HCN的酸性比乙炔的强的原因是 。
③为防止晶体缺陷过多,制备时反应需缓慢且平稳。先将溶液与柠檬酸钠()溶液混合,发生反应:,再加入溶液以制备晶体。阐述制备晶体过程中柠檬酸钠溶液的作用: 。
(3)金属氢化物是非常有潜力的储氢材料。其晶胞形状为立方体,边长为a nm,如下图所示。
①晶胞中H原子个数为 。
②已知的摩尔质量是M ,阿伏加德罗常数为,该晶体的密度为 。()
16.(10分)
某钴矿石的主要成分有CO、、MnO、、MgO和等。由该矿石粉制备固体的方法如下(部分催化剂已略)。
已知:金属离子沉淀的pH:
(1)溶于浓硫酸,生成和一种可使带火星的木条复燃的气体,该气体是 。
(2)向溶液1中加入NaOH溶液,将转化为沉淀,应调节pH至少大于 。
(3)向溶液2中加入NaF溶液,去除的离子是 。
(4)向溶液3中加入氨水和过氧化氢溶液,将转化为。补充完整下列离子方程式:
(5)溶液4中,若将1ml 全部转化为沉淀,需要消耗 ml。
(6)关于上述流程,下列说法正确的是 (填序号)。
a.若矿石粉中存在少量FeO,经上述流程也可制得纯度相同的
b.向溶液3中加入氨水,作用仅是调节溶液的pH
c.流程中,仅通过调节溶液的pH无法将金属元素完全分离
17.(12分)
氮氧化物会造成环境污染,我国科学家正着力研究SCR技术(选择性催化还原氮氧化物)对燃煤电厂烟气进行脱硝处理。
(1)氮氧化物(以NO为主)直接排放到空气中会形成硝酸型酸雨,反应的化学方程式为 。
(2)催化还原NO的化学方程式为 。
(3)铁基催化剂在260~300℃范围内实现SCR技术的过程如下:
①反应ⅳ中消耗的与NO的物质的量之比为 。
②适当增大催化剂用量可以明显加快脱硝速率,结合上述过程解释原因: 。
③向反应体系中添加可显著提高NO脱除率。原因如下:
与NO发生反应;
与发生反应ⅲ和反应ⅳ转化为;
与发生反应 (填离子方程式)转化为。
(4)相比于铁基催化剂,使用锰基催化剂(活性物质为)时,烟气中含有的会明显降低NO脱除率。
①推测与会发生反应使催化剂失效,其化学方程式是 。
②持续通入含的烟气。不同温度下,每隔1h测定NO脱除率,结果如上图:相同时间,200℃时NO脱除率低于100℃,原因是 。
18.(9分)
某钒渣主要成分为(含有少量、CaO),以其为原料生产的工艺如下图:
已知:
ⅰ.钒酸()是强酸,(偏钒酸铵)难溶于水;+5价钒在溶液中的主要存在形式与溶液pH的关系如表所示。
ⅱ.室温下,,。
ⅲ.在溶液pH=3.3时开始沉淀,溶液pH=4.7时沉淀完全。
请回答以下问题:
(1)“酸浸”前需将块状固体粉碎,其目的是 ;焙烧过程中生成的化学方程式为 。
(2)已知难溶于水,可溶于盐酸。若“酸浸”时溶液的pH=5,则溶于盐酸的离子方程式为 。
(3)“转沉”时,发生反应,该反应的平衡常数K= (用含m、n的代数式表示)。
(4)“沉钒2”的沉钒率随温度的变化如右图所示,温度高于80℃沉钒率下降的原因是 。
(5)产品纯度测定:
将m g产品()溶于足量稀硫酸配成100mL 溶液。取20.00mL该溶液于锥形瓶中,用a 标准溶液进行滴定,经过三次滴定,达到滴定终点时平均消耗标准溶液的体积为20.00mL。
①完成下列滴定过程的离子方程式:
。
②产品的纯度为 (用质量分数表示,)。
19.(15分)
探究配制不同金属离子-氨配体溶液的差异性,实验操作及现象如下:
资料:
①饱和氨水的浓度约为14
②为浅青色沉淀
③溶液为红色,在活性炭催化下转化为橙黄色的溶液
(1)实验ⅰ-a中生成蓝色沉淀的离子方程式为 。
(2)有研究认为蓝色沉淀中还有成分,其可以溶于稀酸。检验蓝色沉淀中不止含的实验操作为:将蓝色沉淀过滤,充分洗涤后, 。(填后续操作和现象)
(3)对比实验ⅰ-a和实验ⅰ-b,从平衡移动角度,结合化学用语解释对生成有一定促进作用的原因 。
(4)对比实验ⅰ-a和实验ⅰ-c中再加入过量氨水前的反应,推测对生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验ⅰ-a的重复,再分别加入不同试剂。实验现象证实了预测。
①x的化学式是 ,c= 。
②实验现象是 。
(5)从平衡移动角度,解释对生成有一定促进作用的原因 。
(6)针对实验ⅱ未能成功配制溶液,结合以上分析,提出改进方案:
①在实验ⅱ-a的基础上继续加入 ,即可成功配制。
②验证配制成功的操作及实验现象是:取①的上层红色清液,加入少许活性炭振荡试管,溶液转为橙黄色,反应的离子方程式为: 。
(7)综合以上分析,配制不同金属离子氨配体溶液的难易程度存在差异性,推测可能与以下因素有关:配位数、 。
2025届高三十月月考化学答案
1-5CDBCB6-10BDDCC11-14DBAC
15.(12分)
(1)①非极性②③>
二者均为分子构成的物质,环氧丙烷的相对分子质量更大,分子的极性更大,范德华力更大
(2)①
②ⅰ.H—O—C≡N
ⅱ.N原子的电负性大,—CN具有吸电子效应,使HCN中H—C的极性更大,更易断裂
③柠檬酸钠与反应生成,降低了的浓度,使制备晶体的反应速率减小;随着反应进行,的浓度降低,逆向进行,释放出,使制备晶体的反应缓慢且平稳
(3)①24②
16.(共10分)
(1)
(2)2.8
(3)
(4)
(5)1.5
(6)ac
17.(12分)
(1),
(2)
(3)①1∶1
②反应ⅱ为脱硝反应的决速步,增大催化剂的用量可提高反应ⅱ的速率,进而提高脱硝反应速率
③
(4)①
②温度升高使催化剂失效速率加快,导致温度升高对NO脱除速率增大的影响不如催化剂失效对NO脱除速率降低的影响显著
18.(9分)
(1)增大固体反应物与酸的接触面积,加快酸浸的速率
(2)
(3)
(4)高于80℃时水解程度增大,减小(或其他合理答案)
(5)①2122②18.2a/m
19.(15分)
(1)
(2)加入足量稀HCl,固体全部溶解后再加入溶液,产生白色沉淀
(3),增大,,使沉淀溶解平衡正移,更多地转化为
(4)①;1
②试管1中沉淀溶解,2中不溶解
(5),增大时,与反应产生,增大了,同时减少了,使沉淀溶解平衡正移,增加,促进平衡正移。
(6)①10滴1ml/L 溶液
②
(7)氢氧化物提供金属阳离子的难易程度、金属阳离子和配位的难易程度
气体
试剂
制备装置
收集方法
A
和浓盐酸
b
e
B
Cu和稀硫酸
b
C
C
NO
Cu和稀硝酸
b
C
D
和
a
d
序号
实验方案
实验现象
实验装置
试剂a
①
水
产生黑色沉淀,放置后不发生变化
②
5% NaOH溶液
产生黑色沉淀,放置后溶液变为紫色,仍有沉淀
③
40% NaOH溶液
产生黑色沉淀,放置后溶液变为紫色,仍有沉淀
④
取③中放置后的悬浊液1mL,加入4mL 40% NaOH溶液
溶液紫色迅速变为绿色,且绿色缓慢加深
开始沉淀时
1.5
6.3
8.9
8.2
7.4
完全沉淀时
2.8
8.3
10.9
10.2
9.4
pH
4~6
6~8
8~10
10~12
主要离子
实验序号
操作
现象
实验ⅰ:的配制
实验ⅰ-a
在试管内混合溶液和NaOH溶液,再加入过量的2
产生蓝色沉淀,加入后沉淀少部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。
实验ⅰ-b
在试管内混合溶液和NaOH溶液,再加入过量的6
产生蓝色沉淀,加入后沉淀大部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。
实验ⅰ-c
在试管内混合溶液和溶液,再加入过量的2
产生蓝色沉淀,加入后沉淀完全溶解,得到澄清的深蓝色溶液。
实验ⅱ:的配制
实验ⅱ-a
在试管内混合溶液和过量6
得到浅青色沉淀,沉淀未见明显溶解。
实验ⅱ-b
在试管内混合溶液和过量14
得到浅青色沉淀,沉淀未见明显溶解。
实验ⅲ:的配制
实验ⅲ
在试管内混合溶液和NaOH溶液,再加入过量的2
产生白色沉淀,加入后沉淀完全溶解,得到无色溶液。
相关试卷
这是一份北京市首都师范大学附属中学2024-2025学年高三上学期10月月考化学试题,共10页。
这是一份北京市首都师范大学附属中学2024-2025学年高三上学期9月月考化学试题,共18页。
这是一份北京市第五十五中学2024-2025学年高三上学期10月月考 化学试题,共13页。试卷主要包含了下列方程式与所给事实不相符的是,下列事实不能用氢键解释的是,下列实验不能达到对应目的的是等内容,欢迎下载使用。












