

第02讲 氯气-新高一化学暑假精品课程(鲁科版2019)(原卷版)
展开1.了解氯元素单质及其重要化合物的主要性质及应用。
2.了解实验室制取Cl2的原理和实验装置。
【基础知识】
一、氯气的物理性质
1.色味态
(1)________色有________气味的有毒气体
(2)闻有毒气体气味方法:____________________________________________________
2.溶解性
(1)能溶于水,常温下1体积水约溶解_______体积氯气,得到氯水
(2)不溶于_______________溶液
3.密度:比空气的________
4.熔沸点:熔点-101℃,沸点-34.6℃,沸点相对较____
5.物理特性:易________,加压条件下变成________,保存在___________中
二、氯气的化学性质
1.氯气和金属反应——生成高价金属氯化物
(1)氯气和铁反应
(2)氯气和铜反应
(3)氯气和钠反应
2.氯气和氢气反应
(1)点燃
(2)光照
①反应:_______________________________
②现象:光照发生____________
3.氯气和水反应生成盐酸和次氯酸(HClO)
(1)反应:_______________________________
(2)现象:氯气部分和水反应,得到________色的氯水
(3)应用:生成的HClO可以作自来水的杀菌消毒剂
4.氯气和碱反应生成盐酸盐和次氯酸盐
(1)氯气和NaOH溶液反应
①反应:______________________________
②应用:制备84消毒液,吸收多余的氯气
(2)漂白粉的制备
①原料:氯气和__________
②反应原理:______________________________
③主要成分:__________和__________的混合物
④有效成分:__________
⑤漂白原理:______________________________
三、次氯酸的化学性质
1._______性:能使染料等有机色素褪色
2._______性:在光照或加热条件下易分解
(1)现象:氯水黄绿色逐渐消失,有______产生
(2)反应:________________________________
(3)保存:盛放在_________色瓶中放在阴暗处密封保存
3.弱酸性:酸性比碳酸的_____________
1.向氯水中加入少量碳酸钠溶液,会产生什么现象?
2.“液氯泄漏”时可以采取哪些防护措施?
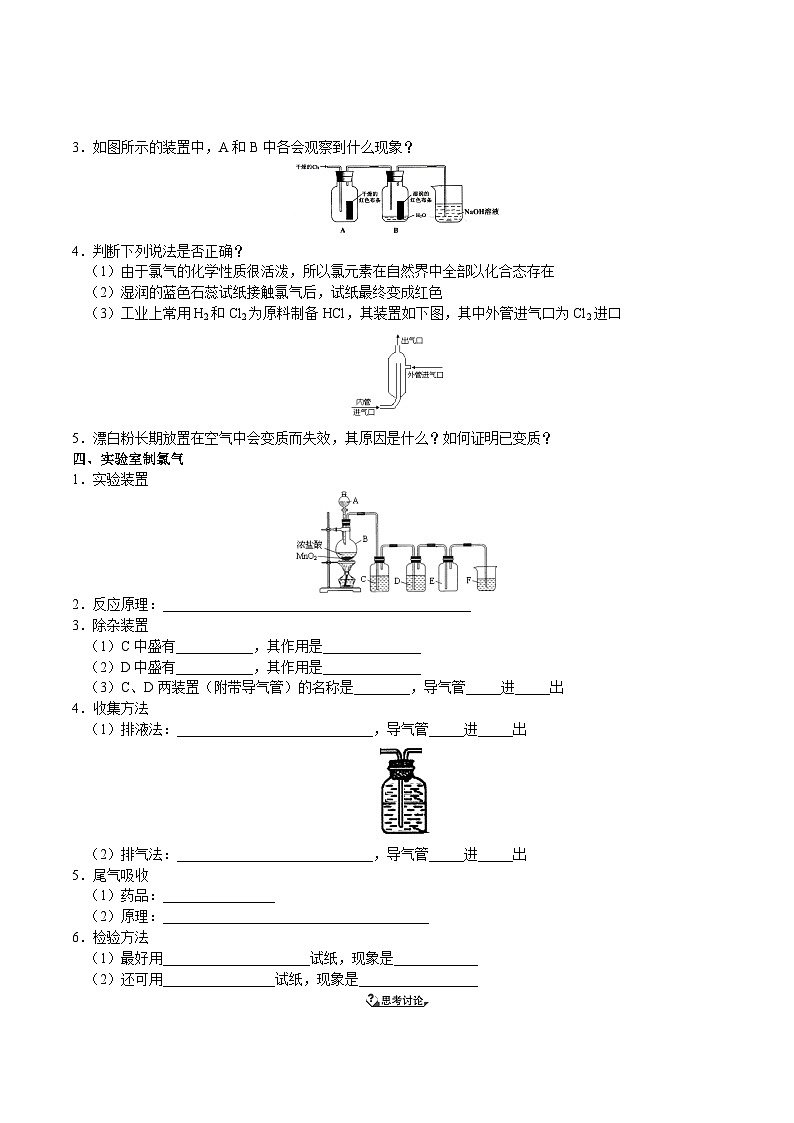
3.如图所示的装置中,A和B中各会观察到什么现象?
4.判断下列说法是否正确?
(1)由于氯气的化学性质很活泼,所以氯元素在自然界中全部以化合态存在
(2)湿润的蓝色石蕊试纸接触氯气后,试纸最终变成红色
(3)工业上常用H2和Cl2为原料制备HCl,其装置如下图,其中外管进气口为Cl2进口
5.漂白粉长期放置在空气中会变质而失效,其原因是什么?如何证明已变质?
四、实验室制氯气
1.实验装置
2.反应原理:____________________________________________
3.除杂装置
(1)C中盛有___________,其作用是______________
(2)D中盛有___________,其作用是______________
(3)C、D两装置(附带导气管)的名称是________,导气管_____进_____出
4.收集方法
(1)排液法:____________________________,导气管_____进_____出
(2)排气法:____________________________,导气管_____进_____出
5.尾气吸收
(1)药品:________________
(2)原理:______________________________________
6.检验方法
(1)最好用_____________________试纸,现象是____________
(2)还可用________________试纸,现象是_________________
1.能否用澄清石灰水作为吸收多余氯气的吸收剂?
2.已知KMnO4与浓HCl在常温下反应能产生Cl2。若用上图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中错误的是___。
【考点剖析】
考点一:氯水的成分和性质
例1.(2020·榆林高一检测)氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质作用(四种物质与氯水的重合部分代表物质间的反应,且氯水足量),请回答下列问题:
(1)能证明氯水具有漂白性的是______(填“a”“b”“c”“d”或“e”)。
(2)反应c过程中的现象是________________________,反应e的化学方程式为__________________,反应b的化学方程式为____________。
(3)久置的氯水最终会变成_________,用化学反应方程式表示为____________。
(4)实验室保存氯水的方法是__________________。
考点二:氯气的漂白性
例2.(2020·北京朝阳区高一检测)某实验小组对氯水成分和性质进行研究,实验如下:
(1)氯水呈黄绿色,说明其中含有_________(填化学式)。
(2)实验一的现象表明,氯水具有酸性和_________性。
(3)氯气与水反应的化学方程式为___________________。
(4)用化学用语说明实验二中“红色不褪去”的原因________________。
(5)实验四证明了实验三中“红色不褪去”不是因为氯水被稀释所致,补充所加试剂和现象。
【实验四】
①加入:____________,现象:___________;
(6)进一步探究实验三中“红色不褪去”的原因。
【实验五】取实验三的白色沉淀,洗涤,用饱和氯化钠溶液浸泡,取上层清液,滴加2滴紫色石蕊溶液,一段时间后,颜色褪去。写出氯水和硝酸银溶液反应的化学方程式______________________________。
考点三:氯气和金属反应
例3.(2021·无锡高一上期中)如图所示钠、镁、铝、铁分别跟足量的氯气反应时,消耗金属的质量与反应的氯气的质量之间的关系,其中表示铝与氯气反应的是( )。
A.a B.b C.c D.d
考点四:含氯漂白剂的制备和使用
例4.(2020·湖州高一检测)下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是:①氯气;②液氯;③新制的氯水;④盐酸;⑤盐酸酸化的漂白粉溶液( )。
A.①②③ B.①②④ C.③⑤ D.②③
考点五:实验室制取氯气
例5.(2020·绍兴高一检测)已知KMnO4在常温下与浓盐酸反应生成Cl2,如图是用KMnO4与浓盐酸反应制取Cl2的简易装置,下列叙述不正确的是( )。
A.在试管①中盛有饱和食盐水,用试管②收集Cl2
B.用试管①收集Cl2,试管②可防止NaOH溶液倒吸入试管①中
C.③用于吸收多余的Cl2,防止污染环境
D.用该装置收集到的Cl2中会混有HCl气体和水蒸气
【真题演练】
1.(2020•江苏学业考试)在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )。
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HCl
2.(2020·北京合格考真题)某学习小组验证氯水中具有漂白性的物质是HClO,实验如下(装置的气密性已检验)。
(1)NaOH溶液的作用是__________________________。
(2)实验Ⅰ,试剂a为H2O,制得氯水。氯水呈黄绿色是由于其中含有______。Cl2与H2O反应的化学方程式为______________________。
(3)实验Ⅱ,试剂a为CCl4,制得Cl2的CCl4溶液(Cl2与CCl4不反应)。取稀盐酸、新制氯水和Cl2的CCl4溶液,分别滴在三张红色纸条上,可观察到______________________,证实氯水中具有漂白性的物质是HClO。
3.(2019年7月·湖南学考真题)已知实验室制取Cl2的化学方程式为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O。请回答下列问题:
(1)左图为Cl2的发生装置。
①仪器a的名称为_____________。
②仪器a中盛放的试剂为_____________。
(2)右图为Cl2的收集即尾气处理装置。
①该收集氨气的方法为_____________。
A.向上排空气法 B.向下排空气法
②烧杯中发生反应的化学方程式为____________________。
【过关检测】
1.下列说法正确的是( )。
A.氯气和氯离子都呈黄绿色
B.干燥的氯气和新制氯水都能使鲜艳的红花褪色
C.常温下,液氯可以用钢瓶盛装
D.新制的氯水应该保存在无色的玻璃试剂瓶中
2.下列各化合物不能由单质直接化合制取的是( )。
A.FeCl3 B.CuCl2 C.AlCl3 D.FeCl2
3.下列说法中正确的是( )。
A.用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味
B.用排水集气法便可以收集到纯净的氯气
C.氯气有漂白性
D.自来水常用氯气来杀菌、消毒
4.用自来水(以Cl2为杀菌消毒剂)配制下列物质的水溶液,不会出现明显的药品变质问题的是( )。
A.Na2CO3 B.AgNO3 C.CuSO4 D.NaOH
5.(2020·兴隆高一检测)下列关于漂白粉的叙述正确的是( )。
A.漂白粉的有效成分是Ca(ClO)2和CaCl2
B.漂白粉在空气中久置能变质
C.漂白粉是由Cl2与石灰乳制得的纯净物
D.漂白粉可用浓盐酸制得
6.(2020·贵阳高一检测)根据氯气的物理性质,有人设计了如图所示的装置收集氯气,下列说法中正确的是( )。
A.排空气法收集氯气:A进气,B出气
B.排空气法收集氯气:B进气,A出气
C.排饱和食盐水法收集氯气:A进气,B出液
D.排氢氧化钠溶液法收集氯气:B进气,A出液
7.在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。下列收集Cl2的装置正确的是( )。
8.(2020·商丘高一检测)检验Cl2是否充满了集气瓶的正确操作为( )。
A.用玻璃棒粘上湿润的KI-淀粉试纸伸到集气瓶口附近,观察试纸是否变蓝
B.将AgNO3溶液滴入集气瓶中,观察有无白色沉淀生成
C.用玻璃棒蘸取少许NaOH溶液放入集气瓶口附近,看是否反应
D.用手将湿润的KI-淀粉试纸放在集气瓶口上方,观察颜色是否变蓝
9.(2020·北京顺义区高一检测)氯水中含有多种成分,因而具有多种性质,根据氯水分别与右图中四种物质发生的反应(a、b、c、d重合部分代表物质间可反应,且氯水足量)。能证明氯水具有漂白性的是( )。
A.a B.b C.c D.d
10.(2020·衢州高一检测)现有盐酸、NaCl溶液、NaOH溶液和新制氯水,可用来区别它们的一种试剂是( )。
A.AgNO3溶液 B.酚酞溶液
C.紫色石蕊溶液 D.饱和食盐水
11.实验室为了使用方便,通常将氯气溶解于水中形成氯水或将其降温加压形成液氯来使用。下列有关这两种液体的描述都正确的是( )。
A.两种液体都可以使干燥的布条褪色
B.两种液体都可以使干燥的蓝色石蕊试纸变红
C.用这两种液体都可给自来水消毒
D.分别向这两种液体中投入几颗金属锌粒均有气泡产生
12.(2020·盐城高一检测)下列关于Cl2的制备、净化、收集及尾气处理的装置和原理能达到实验目的的是( )。
A.用装置甲制取氯气 B.用装置乙除氯气中的氯化氢
C.用装置丙收集氯气 D.用装置丁吸收尾气
13.(2020·唐山高一检测)某同学用下列装置进行有关Cl2的实验。下列说法不正确的是( )。
14.(2020·鄂尔多斯高一上期末)实验室利用下图装置制取无水AlCl3(183℃升华,遇潮湿空气即产生大量白雾),下列说法正确的是( )。
A.①的试管中盛装二氧化锰,用于常温下制备氯气
B.②、③、⑥、⑦的试管中依次盛装浓H2SO4、饱和食盐水、浓H2SO4、NaOH溶液
C.滴加浓盐酸的同时点燃④的酒精灯
D.⑤用于收集AlCl3,⑥、⑦可以用一个装有碱石灰的干燥管代替
15.如图是一些含氯产品。
(1)储氯钢瓶上应贴的标签为________(填标号)。
A.易燃品 B.有毒品 C.爆炸品
(2)某清洗剂使用注意事项中特别说明在使用时切勿与漂白剂一同使用,否则会产生有害气体。84消毒液的有效成分是次氯酸钠,写出84消毒液与该清洗剂(有效成分为盐酸)混合后反应的离子方程式:_____________________________。
(3)漂白粉的有效成分是________(填化学式)。
16.为了探究HClO的漂白性,某同学设计了如图的实验。
(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是___________________________________________________;从集气瓶B中湿润的红色布条的现象可得出的结论是__________。
(2)为了证明是HClO使湿润的红色布条褪色,你认为还应增加的实验是__________________________________。
(3)写出氯气与氢氧化钙反应的化学方程式:_______________________。
17.(2020·舟山高一检测)如图所示,A、B、C、D是氯气或含氯的化合物。
(1)推断(写化学式):A_________,B_________,C__________,D____________。
(2)写出①~⑤各步反应的化学方程式。
①_______________________;
②_______________________;
③_______________________;
④_______________________;
⑤_______________________。
18.实验室用如图所示的仪器药品制取氯化铁粉末,已知氯化铁粉末很容易吸水生成结晶水化合物:FeCl3+6H2O=FeCl3·6H2O。
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序)①接________,________接_______,_______接________。
(2)装置A中发生反应的还原剂是________,B中反应的化学方程式是___________________________。
(3)容器D的作用是____________________________,容器E的作用是____________。
(4)A、B中的酒精灯应先点燃________处(填“A”或“B”)的酒精灯,理由是__________________________。
(5)这套实验装置是否完整?________(填“是”或“否”),若不完整还需补充____________装置(若第一问填“是”,则此问不需要作答)。
选项
A
B
C
D
图示
实验及目的
闻Cl2的气味
生成棕黄色的烟
若气球干瘪,证明Cl2可与NaOH反应
浸有NaOH溶液的棉球用于吸收过量的氯气,以免其污染空气
第16讲 硝酸-新高一化学暑假精品课程(鲁科版2019)(原卷版): 这是一份第16讲 硝酸-新高一化学暑假精品课程(鲁科版2019)(原卷版),共8页。
第15讲 氨气和铵盐-新高一化学暑假精品课程(鲁科版2019)(原卷版): 这是一份第15讲 氨气和铵盐-新高一化学暑假精品课程(鲁科版2019)(原卷版),共9页。
第13讲 硫的转化-新高一化学暑假精品课程(鲁科版2019)(原卷版): 这是一份第13讲 硫的转化-新高一化学暑假精品课程(鲁科版2019)(原卷版),共10页。












