
河南省部分校2024-2025学年高二上学期10月青桐鸣联考化学试题
展开化学(人教版)
注意事项:
1.答卷前,考生务必将自己的姓名、班级、考场号、座位号、考生号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列措施或做法与化学反应速率无关的是( )
A.在月饼包装袋内放置抗氧化剂B.用铝粉代替铝片在空气中燃烧
C.向门窗合页里注油D.向炉膛内鼓风
2.下列事实不能用平衡移动原理解释的是( )
A.在的平衡体系中,缩小容器容积可使体系颜色变深
B.氯气在水中的溶解度大于在饱和食盐水中的溶解度
C.实验室向浓氨水中加入NaOH固体制取少量氨气
D.光照新制氯水,颜色变浅
3.研究化学反应能否自发进行在工业生产中有着重要的意义。下列说法中正确的是( )
A.若一个反应、,则该反应在低温下不能自发进行
B.反应在低温下能自发进行,则该反应的
C.反应的
D.温度升高到一定程度,化学反应均可实现自发进行
4.关于中和反应反应热的测定实验,下列叙述正确的是( )
A.为防止溶液溅出导致实验失败,向盛有稀盐酸的量热计内筒中加入氢氧化钠溶液时应缓慢倾倒
B.当混合溶液的温度不再变化时,记录该温度进行计算
C.可选择稀盐酸和溶液进行实验
D.用NaOH固体代替稀氢氧化钠溶液进行测定,不会影响实验结果
5.化学反应均伴随着能量变化,研究化学反应中的能量变化对于人类的生产生活有着重要的意义。下列说法正确的是( )
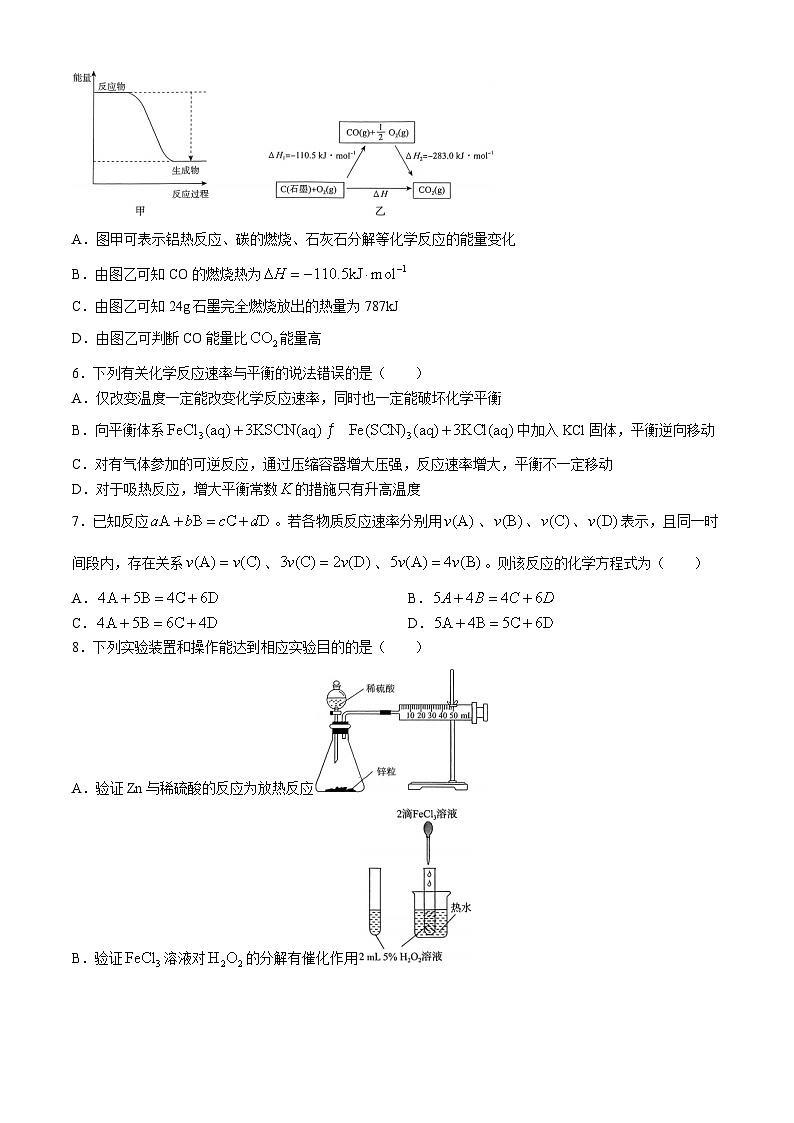
A.图甲可表示铝热反应、碳的燃烧、石灰石分解等化学反应的能量变化
B.由图乙可知CO的燃烧热为
C.由图乙可知24g石墨完全燃烧放出的热量为787kJ
D.由图乙可判断CO能量比能量高
6.下列有关化学反应速率与平衡的说法错误的是( )
A.仅改变温度一定能改变化学反应速率,同时也一定能破坏化学平衡
B.向平衡体系中加入KCl固体,平衡逆向移动
C.对有气体参加的可逆反应,通过压缩容器增大压强,反应速率增大,平衡不一定移动
D.对于吸热反应,增大平衡常数的措施只有升高温度
7.已知反应。若各物质反应速率分别用、、、表示,且同一时间段内,存在关系、、。则该反应的化学方程式为( )
A.B.
C.D.
8.下列实验装置和操作能达到相应实验目的的是( )
A.验证Zn与稀硫酸的反应为放热反应
B.验证溶液对的分解有催化作用
C.探究温度对反应速率的影响
D.中和反应反应热的测定
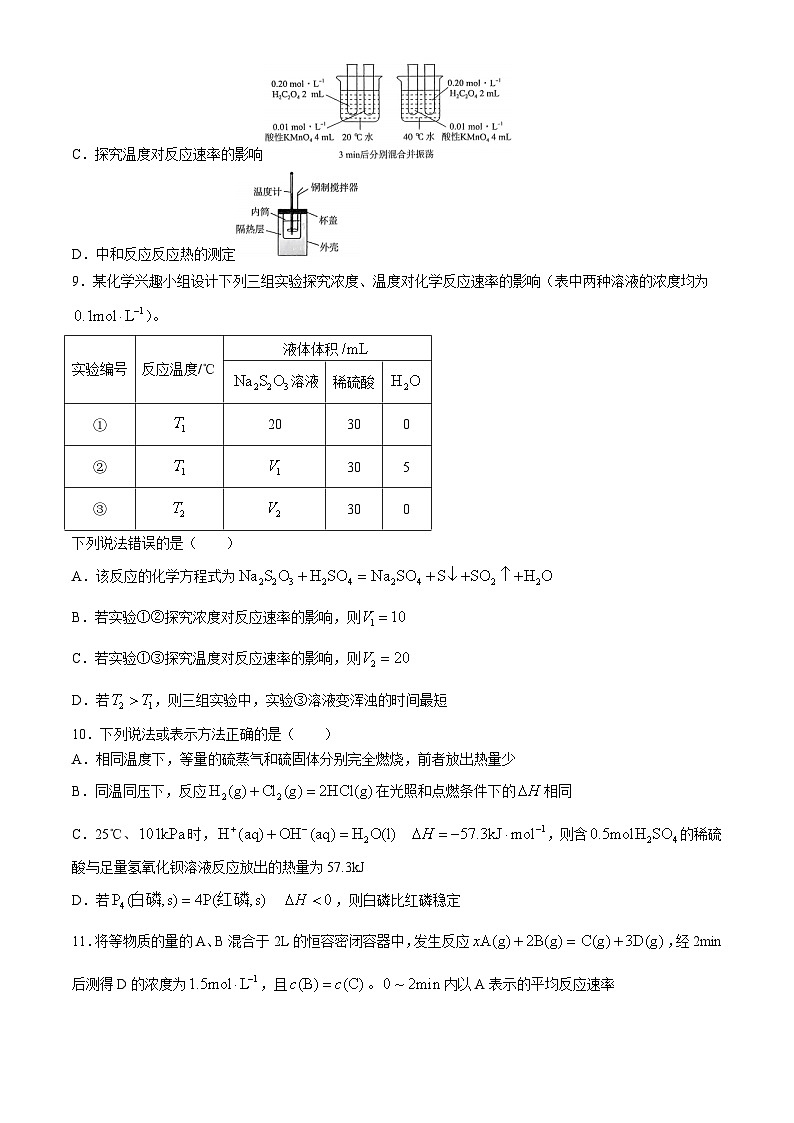
9.某化学兴趣小组设计下列三组实验探究浓度、温度对化学反应速率的影响(表中两种溶液的浓度均为)。
下列说法错误的是( )
A.该反应的化学方程式为
B.若实验①②探究浓度对反应速率的影响,则
C.若实验①③探究温度对反应速率的影响,则
D.若,则三组实验中,实验③溶液变浑浊的时间最短
10.下列说法或表示方法正确的是( )
A.相同温度下,等量的硫蒸气和硫固体分别完全燃烧,前者放出热量少
B.同温同压下,反应在光照和点燃条件下的相同
C.25℃、时,,则含的稀硫酸与足量氢氧化钡溶液反应放出的热量为57.3kJ
D.若 ,则白磷比红磷稳定
11.将等物质的量的A、B混合于2L的恒容密闭容器中,发生反应,经2min后测得D的浓度为,且。内以A表示的平均反应速率,下列说法错误的是( )
A.内
B.反应过程中,容器内混合气体的总物质的量保持不变
C.起始时,A的物质的量为2.5ml
D.反应过程中,A、B的转化率始终相等
12.在催化剂作用下,某可逆反应的反应历程如图所示。
下列说法错误的是( )
A.该可逆反应中,断开旧化学键所吸收的总能量小于形成新化学键所放出的总能量
B.该反应的决速步骤为ⅰ→ⅱ
C.升高温度可提高反应速率,但反应物的平衡转化率降低
D.使用催化剂可降低反应焓变,从而加快化学反应速率
13.对下列图像的分析错误的是( )
A.对于反应,图甲可表示时增大容器容积(其他条件不变)的速率变化
B.根据图乙可判断反应为吸热反应
C.根据图丙可求出反应中
D.图丁中b曲线变为a曲线可能是反应使用了催化剂
14.在相同的恒容密闭容器中,加入相同量的氯化氢和晶体硅,发生反应,间隔相同时间测得在不同催化剂下HCl的转化率随温度的变化如图所示(图中温度范围内催化剂的活性变化可忽略)。
下列说法正确的是( )
A.选用催化剂①可加快反应速率,同时提高平衡时HCl的转化率
B.该反应的正反应为放热反应,图中a、b点均有
C.化学平衡常数:
D.加压、适当升温、及时分离出,均有利于提高硅的转化率
二、非选择题:本题共4小题,共58分。
15.(14分)
氨气是一种重要的含氮化合物,在工农业生产、生活中有着重要作用。
回答下列问题:
(1)图甲为和反应生成时的能量变化。则和反应的热化学方程式为______。
(2)已知部分化学键的键能数据如表所示:
则______。
(3)在2L恒温恒容密闭容器中充入,发生反应,的转化率随反应时间的变化如图乙所示:
①内,______。
②反应的平衡常数______(写出计算式即可);气体的总压强______。
③下列说法能表明上述反应已达到平衡状态的是______(填选项字母,下同)。
A.B.混合气体密度不再改变
C.混合气体的平均相对分子质量不再改变D.容器内压强不再变化
④反应达到平衡后,为提高的转化率,可采取的措施有______。
A.改用高效催化剂B.升高温度C.缩小容器的容积
16.(14分)
二氧化碳的再利用是当今科研的一项重要课题。回答下列问题:
(1)工业上用和反应合成二甲醚。已知反应:
Ⅰ. ;
Ⅱ. 。
则反应的______。
(2)在容积为1L的恒容密闭容器中,充入和,一定条件下只发生反应Ⅰ,测得和的浓度随时间的变化如图甲所示:
①从,用表示的平均反应速率______(保留两位有效数字);第9min时______(填“>”“=”或“<”)第3min时。
②下列措施中能增大该反应的反应速率且利于平衡正向移动的是______(填选项字母。)
A.充入增大体系的压强B.将分离出去
C.使用高效催化剂D.增大浓度
(3)在2L刚性密闭容器中充入和只发生反应Ⅰ,的平衡转化率与温度和投料比的关系如图乙所示,已知点的投料为和。
①从图中可知:______(填“>”或“<”);原因为______。
②温度时,反应的平衡常数______。
17.(15分)
环氧乙烷是一种最简单的环醚,结构简式为,其熔点为-112.2℃,沸点为10.8℃,被广泛应用于洗涤、制药、印染等行业。以乙烯为原料生产环氧乙烷(银催化法)的合成原理为。回答下列问题:
(1)已知某些共价键的键能(25℃、下)如表所示:
表中的键能为未知数,但据表中已知数据也可求出的反应热,原因是______,反应热______。
(2)25℃,下,环氧乙烷的燃烧热。
①写出表示环氧乙烷燃烧热的热化学方程式:______。
②25℃,下,乙烯的燃烧热为______。
(3)环氧乙烷是一种易燃易爆气体。当一定量环氧乙烷发生爆炸,生成水蒸气、和时,释放出431.5kJ的热量。写出该反应的热化学方程式:______。
(4)以乙烯为原料生产环氧乙烷,过去主要使用的是氯代乙醇法,其总反应方程式为,该反应的______(填“>”或“<”)0;与氯代乙醇法相比,银催化法的优点为______。
18.(15分)
石油的催化裂解可获得多种短链烃,如工业用丙烯主要来自石脑油的催化裂解,涉及反应如下。
主反应:
副反应:
回答下列问题:
(1)将和催化剂(催化剂体积忽略不计)置于1L恒温恒容密闭容器中,在(之间的某一恒定温度)下发生上述裂解反应,反应进行到10min时达到平衡,测得的平衡转化率为,且所得混合气体中含有。
①内,用表示的平均反应速率______。
②平衡时混合气体总的物质的量为______。
③时副反应的化学平衡常数______。
④其他条件不变,改变容器温度,反应相同时间,的产率随容器温度的变化如图甲所示。的产率在890℃之前随温度升高而增大的可能原因是______;在890℃之后随温度升高而减小的可能原因是______。
(2)工业上也常采用直接裂解丁烷的方法获得丙烯: 。在两个相同的刚性密闭容器中充入等量丁烷,分别加入,两种不同催化剂,反应相同时间,丙烯的产率与温度的关系如图乙所示。工业上宜选择催化剂______(填“a”或“b”);某温度下反应达到平衡后,再充入少量丁烷,下列推断正确的是______(填选项字母)。
A.平衡向正反应方向移动,丁烷的转化率增大B.平衡向正反应方向移动,丁烷的转化率减小
C.平衡向逆反应方向移动,丁烷的转化率增大D.平衡向逆反应方向移动,丁烷的转化率减小
2026届普通高等学校招生全国统一考试
青桐鸣高二联考参考答案
化学(人教版)
1.C 解析:在月饼包装袋内放置抗氧化剂,降低了氧气浓度,可减慢反应速率,A不符合题意;铝粉与空气接触面积大,能加快反应速率,B不符合题意;向门窗合页里注油,是为了增加润滑度,与化学反应速率无关,C符合题意;向炉膛内鼓风可以增大氧气的浓度,有利于加快燃烧的速率,D不符合题意。故选C。
2.A 解析:密闭容器中反应达平衡后,压缩容器容积,平衡正向移动,颜色变浅,故颜色加深是因为容积缩小使的浓度增大,不能用平衡移动原理解释,A符合题意;氯气溶于水存在平衡,在饱和食盐水中氯离子浓度较大,会使平衡逆向移动,因此氯气在饱和食盐水中的溶解度小于在水中溶解度,可以用平衡移动原理解释,B不符合题意;浓氨水中存在平衡,当加入NaOH固体时,溶液中增大,平衡右移,释放出氨气,可用平衡移动原理解释,C不符合题意;光照新制氯水时发生反应,使平衡右移,氯水颜色变浅,可用平衡移动原理解释,D不符合题意。故选A。
3.C 解析:当时反应可自发进行,则、的反应在任何温度下均能自发进行,A错误;反应在低温下能自发进行,可知,从化学方程式知,则,B错误;为反应前后气体分子数减小的反应,故,C正确;对于、的反应,在任何温度下都不能自发进行,D错误。故选C。
4.C 解析:向盛有稀盐酸的量热计内筒中加入氢氧化钠溶液时,一定要一次性迅速加入,减少热量损失,A错误;酸碱恰好反应完全时放热最多,所以混合溶液的温度要随时记录,取最高温度进行计算,B错误;为了保证盐酸完全被中和,氢氧化钠溶液浓度可略大于盐酸,C正确;因氢氧化钠固体溶于水放热,所以用NaOH固体代替稀氢氧化钠溶液进行测定会使实验结果不准确,D错误。故选C。
5.C 解析:图甲表示反应放热,而石灰石分解为吸热反应,A错误;燃烧热是指1ml可燃物完全燃烧生成稳定氧化物所放出的热量,由图乙可知CO的燃烧热为,B错误;由图乙数据结合盖斯定律可得石墨的燃烧热,24g石墨的物质的量为2ml,完全燃烧放出的热量为787kJ,C正确;CO燃烧有氧气参与,由图乙无法判断CO和的能量高低,D错误。故选C。
6.B 解析:仅改变温度,化学反应速率一定改变,平衡一定发生移动,A正确;平衡体系的反应本质为,加入KCl固体,平衡不移动,B错误;对有气体参加的可逆反应,通过压缩容器增大压强,气体浓度增大,反应速率增大,若反应前后气体的物质的量不变,平衡不移动,若反应前后气体的物质的量改变,则平衡发生移动,C正确;由于只与温度有关,所以对吸热反应来说,升高温度,平衡正向移动,平衡常数增大,D正确。故选B。
7.A 解析:由同一时间段内,各物质反应速率关系可得,A正确。故选A。
8.C 解析:Zn与稀硫酸反应放出的热量和生成的气体都可使注射器的活塞外移,所以不能证明反应为放热反应,A错误;温度和催化剂都可以加快反应速率,没有控制单一变量,B错误;两组装置只有温度不同,可以用来探究温度对反应速率的影响,C正确;铜制搅拌器导热,会对反应热的测定造成干扰,D错误。故选C。
9.B 解析:溶液和稀硫酸反应的化学方程式为,A正确;采用控制变量法进行研究,根据实验①可知混合溶液总体积是50mL,则实验②加入溶液体积应该是,B错误;实验①和实验③只有反应温度不同,其他条件须相同,故,C正确;由于实验③温度高,溶液浓度与①相同,故反应速率最快,出现浑浊的时间最短,D正确。故选B。
10.B 解析:硫气化吸热,相同温度下,等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多,A错误;反应热与反应条件无关,只与物质的始态和终态有关,因此同温同压下,在光照和点燃条件下的相同,B正确;含的稀硫酸与足量氢氧化钡溶液反应生成硫酸钡沉淀时也会释放能量,所以放出的热量不是57.3kJ,C错误;为放热反应,说明红磷能量低于白磷,故红磷比白磷稳定,D错误。故选B。
11.C 解析:由题意可知,2min后,D的浓度为,即,则,则,A正确;由内,可得,则反应过程中容器内气体的总物质的量一直保持不变,B正确;设起始A、B的物质的量均为,由题意可列三段式(单位为ml):
由2min末,可得,则,C错误;由于反应物A、B的起始物质的量相同,且化学计量数相同,则转化率始终相同,D正确。故选C。
12.D 解析:由题图中信息可知,该可逆反应为放热反应,则断键吸收的总能量小于成键释放的总能量,A正确;ⅰ→ⅱ的活化能为,ⅱ→ⅲ的活化能为0.85eV,所以决速步骤为ⅰ→ⅱ,B正确;该反应为放热反应,升高温度,反应速率增大,但平衡逆向移动,反应物的平衡转化率减小,C正确;使用催化剂可降低反应的活化能,但不能改变反应的焓变,D错误。故选D。
13.B 解析:时刻改变的条件使反应速率减小,但平衡未移动,对于反应可能是增大了容器容积,A正确;图乙中先出现拐点,,平衡时的小于平衡时的,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,B错误;由图丙可知,2min内消耗0.2mlB的同时生成0.2mlC,两者反应速率相等,则,C正确;图丁中曲线a与曲线b相比,反应速率加快,平衡没有移动,可能是反应使用了催化剂,D正确。故选B。
14.B 解析:催化剂只能改变反应速率,不能改变HCl的平衡转化率,A错误;点之后,反应达到平衡,继续升高温度,HCl转化率下降,说明升温平衡逆向移动,正反应为放热反应,a、b点均未达到平衡,因此,B正确;该反应为放热反应,温度升高减小,C错误;升温,平衡逆向移动,硅的转化率降低,D错误。故选B。
15.(14分)
(1) (2分,合理即可)
(2)391(2分)
(3)①0.0375(2分)②(2分)3:2(2分)
(3)CD(2分)(4)B(2分)
解析:(1)由图甲可知生成的,则热化学方程式为。(2)由键能与反应热的关系得,解得,即断开需要吸收391kJ能量。
(3)①内,消耗,则。
②由题中数据可列三段式:
则平衡常数,由于反应在恒温恒容密闭容器中进行,所以气体的压强之比等于物质的量之比,故气体的总压强。
③反应速率之比等于化学计量数之比,达到平衡时物质的正逆反应速率相等,根据方程式得,则不能说明反应达到平衡状态,A错误;反应前后气体质量和容器体积不变,气体密度始终不变,不能说明反应达到平衡状态,B错误;反应前后气体质量不变,气体物质的量增大,混合气体的平均相对分子质量不再改变,说明反应达到平衡状态,C正确;反应前后气体物质的量增大,恒温恒容下,气体的压强与物质的量成正比,则压强是变量,当容器内压强不再变化,说明反应达到平衡状态,D正确。故选CD。
④改用高效催化剂,只改变反应速率,不影响平衡移动,转化率不变,A错误;该反应是吸热反应,升高温度,平衡正向移动,转化率增大,B正确;该反应是气体体积增大的反应,缩小容器的容积造成压强增大,平衡逆向移动,转化率减小,C错误。故选B。
16.(14分)
(1)-387.7(2分)
(2)①(2分)<(2分)②D
(3)①<(2分)该反应为放热反应,当投料比一定时,升高温度,平衡逆向移动,的平衡转化率降低(2分,合理即可)
②12.5(2分)
解析:(1)根据盖斯定律,反应反应Ⅱ得到,反应的。
(2)①从,用表示的平均反应速率。后,的浓度仍在减小,的浓度仍在增大,说明平衡向正反应方向移动,点时;根据化学方程式可知,任意时候都有,第9min时第3min时,第9min时第3min时,第9min时第3min时。
②充入,体系压强增大,但各物质的分压不变,反应速率不变,平衡不移动,A项不符合题意;将分离出去,反应速率减小,平衡正向移动,B项不符合题意;使用高效催化剂只改变反应速率,不影响平衡的移动,C项不符合题意;增大浓度可以增大反应速率,使平衡正向移动,D项符合题意。故选D。
(3)①该反应为放热反应,当投料比一定时,升高温度,平衡逆向移动,的平衡转化率降低,因此。
②温度时,由图中点可知,的平衡转化率为,可列三段式(单位为ml):
则平衡常数。
17.(15分)
(1)和1ml中都含有共价键(3分,合理即可)
-372.1(2分)
(2)① (2分)
②(或)(2分)
(3)(2分)
(4)<(2分)原子利用率为100%且无污染(2分,合理即可)
解析:(1)。(2)①根据燃烧热的定义及环氧乙烷的燃烧热数值可写出1ml环氧乙烷完全燃烧生成二氧化碳和液态水的热化学方程式为 。
②设 为反应①, 为反应②。根据盖斯定律,由①②得,则乙烯的燃烧热。
(3)根据题意可得反应的化学方程式为,由于生成水蒸气、和时放出431.5kJ的热量,则对应的热化学方程式为 。
(4)由氯代乙醇法的化学方程式可知,反应前后气体的化学计量数减小,则。与氯代乙醇法相比,银催化法的优点为原子利用率为且无污染。
18.(15分)
(1)①(2分)②4.5ml(2分)
③2.5(2分)
④温度升高,速率加快,反应相同时间,的产率增大(3分,合理即可,从催化剂、平衡移动等角度回答也给分)温度过高,催化剂可能活性降低或发生其他副反应(2分,合理即可)
(2)a(2分)B(2分)
解析:(1)根据平衡时混合气体中含有可得:
根据的起始量为2ml和的平衡转化率为可得:
则平衡时,混合气体的组成为、、,。
①内,用表示的平均反应速率。
②平衡时混合气体总的物质的量为。
③平衡时,、、的物质的量浓度分别为、、,则时副反应的化学平衡常数。
④的产率在890℃之前随温度升高而增大的可能原因有温度升高,速率加快;而在890℃之后,温度过高可能引起催化剂活性降低或失去活性,也可能引起其他副反应,都会导致的产率随温度升高而减小。
(2)根据题图乙可知工业上宜选择催化效率高的催化剂a。在恒温恒容条件下,平衡常数不变,平衡后充入少量丁烷,平衡向正反应方向移动;充入丁烷后相当于将原平衡体系加压,丁烷的平衡转化率减小,B正确。故选B。
实验编号
反应温度/℃
液体体积
溶液
稀硫酸
①
20
30
0
②
30
5
③
30
0
化学键
断开1ml化学键需要吸收的能量
436
946
共价键
键能
615
497.3
351
347.7
青桐鸣2024年高二上学期9月联考化学试题+答案: 这是一份青桐鸣2024年高二上学期9月联考化学试题+答案,共11页。
+河南省青桐鸣2024-2025学年高二上学期9月联考化学试题: 这是一份+河南省青桐鸣2024-2025学年高二上学期9月联考化学试题,共11页。试卷主要包含了性质决定用途等内容,欢迎下载使用。
河南省青桐鸣大联考2024-2025学年高二上学期开学考试化学试题(PDF版附解析): 这是一份河南省青桐鸣大联考2024-2025学年高二上学期开学考试化学试题(PDF版附解析),共12页。












