




湖北省华中师范大学第一附属中学2023-2024学年高二上学期10月月考化学试题(Word版附解析)
展开一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 下列关于化学反应速率的说法正确的是
A. 升高温度可降低化学反应的活化能,提高活化分子百分数,加快化学反应速率
B. 反应物浓度增大,单位体积活化分子数增多,有效碰撞的几率增加,反应速率增大
C. 催化剂能提高活化分子的活化能,从而加快反应速率
D. 有气体参加的化学反应,若增大压强(即缩小反应容器的容积),可增加活化分子的百分数,从而使反应速率加快
2. 下列事实不能用勒夏特列原理(平衡移动原理)解释的有几项
①可用浓氨水和氢氧化钠固体快速制取氨气
②铁在潮湿的空气中易生锈
③二氧化氮与四氧化二氮的平衡体系,增大压强后颜色加深
④新制氯水中加后,溶液漂白性增强
⑤钠与氯化钾共融制备钾:
⑥用高压氧舱治疗CO中毒
⑦打开啤酒瓶盖,逸出大量气泡
⑧合成氨选择500℃高温反应以提高反应物的转化率
⑨铁钉放入浓中,待不再变化后,加热能产生大量红棕色气体
⑩氯化铁溶液加铁粉后颜色变浅
A. 3B. 4C. 5D. 6
3. 我国古代哲学认为物质是阴阳组成的对立统一体,下列化学知识正确且最能体现阴阳对立统一的是
A. 绝大多数的化学反应是有限度的,限度越高的反应,化学反应速率越大
B. 化学反应伴随能量变化
C. C、N、O的电负性随其核电荷数的增大而增大
D. 溶液中既有的转换关系又有的转换关系
4. 下列有关说法不正确的是( )
A. Na与H2O的反应是熵增的放热反应,该反应能自发进行
B. 某吸热反应能自发进行,因此该反应一定是熵增反应
C. 通常情况下,一个放热且熵增的反应也有可能非自发进行
D. 反应NH3(g)+HCl(g)====NH4Cl(s)在室温下可自发进行,则该反应的ΔH <0
5. 下列离子方程式与所给事实相符的是
A. 往溶液中滴加几滴浓NaOH溶液,溶液由橙色变黄:
B 往淀粉KI溶液中滴入硫酸,溶液变蓝:
C. 加热溶液,溶液由蓝色变为黄绿色:
D. 草酸使高锰酸钾褪色的总反应为:
6. 我国科研人员研究发现合成氨的反应历程有多种,其中有一种反应历程如图所示(吸附在催化剂表面的物质用*表示)。下列说法正确的是
A. N2生成NH3是通过多步氧化反应生成的
B. 过程I和Ⅲ中能量变化相同
C. 对于N2(g)→*N2(g),适当提高N2分压,可以加快反应速率,提高N2(g)转化率
D. 若有大量氨分子吸附在催化剂表面,将降低化学反应速率
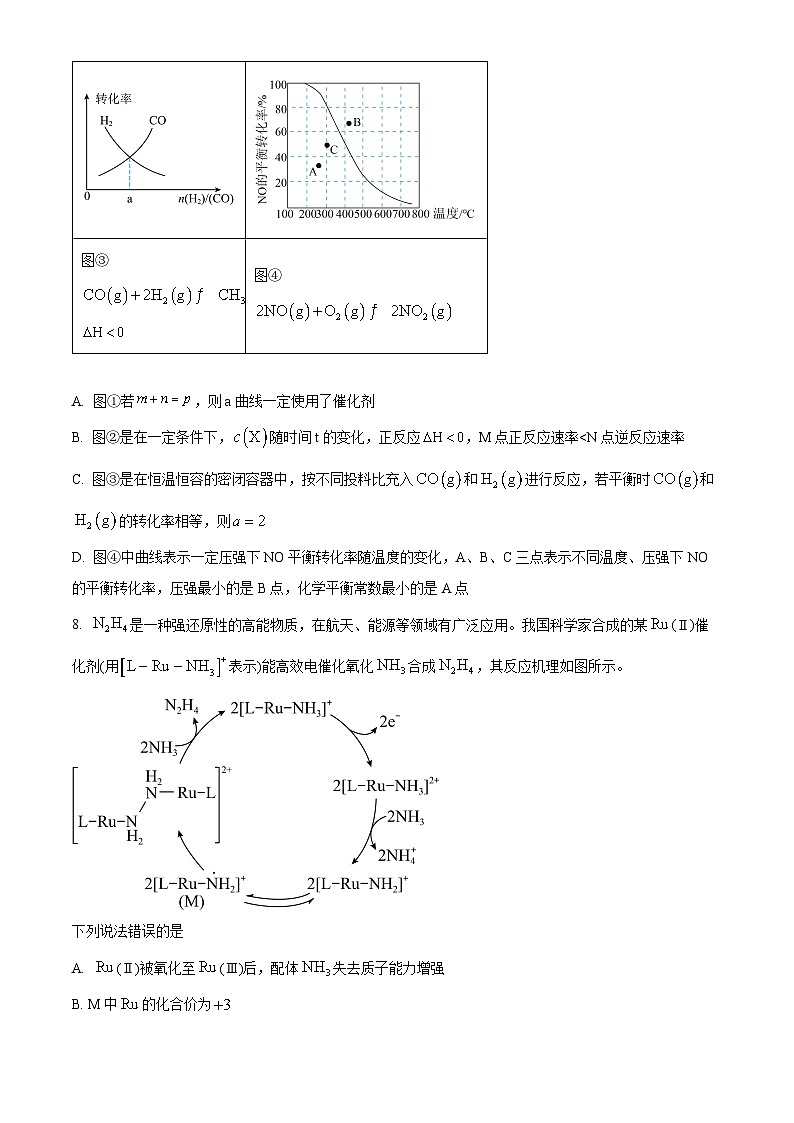
7. 下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图象,其中图象和实验结论表达均正确的是
A. 图①若,则a曲线一定使用了催化剂
B. 图②是在一定条件下,随时间t的变化,正反应,M点正反应速率
D. 图④中曲线表示一定压强下NO平衡转化率随温度的变化,A、B、C三点表示不同温度、压强下NO的平衡转化率,压强最小的是B点,化学平衡常数最小的是A点
8. 是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某(Ⅱ)催化剂(用表示)能高效电催化氧化合成,其反应机理如图所示。
下列说法错误的是
A. (Ⅱ)被氧化至(Ⅲ)后,配体失去质子能力增强
B. M中的化合价为
C. 该过程有非极性键的形成
D. 该过程的总反应式:
9. E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g)Mx(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法正确的是
A. M的沸点比同主族下一周期元素的气态氢化物沸点低
B. 该反应的化学方程式是2HF(HF)2
C. t1时刻,保持温度不变,再充入1 ml M,重新达到平衡时, 将增大
D. 平衡时混合气体的平均摩尔质量是33
10. 室温下,下列实验探究方案不能达到探究目的的是
A. AB. BC. CD. D
11. 在盛有足量A的体积可变的密闭容器中,保持压强一定,加入B,发生反应:A(s)+2B(g)=4C(g)+D(g) △H<0,在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如图。 下列说法正确的是
A. 当温度升高后,则图中θ>45°
B. 若再加入B,则正、逆反应速率均逐渐增大
C. 平衡时B转化率为50%
D. 上述反应只能在高温下才能自发进行
12. 在CuO催化下,经过氯化、氧化等步骤,有机氯化工业的副产品HCl可被O2转化为Cl2,总反应为,下列说法正确的是
A. 反应的平衡常数可表示为
B. 该反应ΔS<0、ΔH>0
C. 是基元反应
D. 提高HCl的转化率,需要研发在低温区高效的催化剂
13. ,400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入6ml 和3ml ,乙容器恒温恒容,充入6ml ,丙容器恒温恒压,充入6ml ,充分反应达到平衡,下列说法正确的是
A. 乙中的体积分数大于丙B. 转化率:
C. D. 甲和丙中反应的化学平衡常数互为倒数
14. 已知[C(H2O)6]2+呈粉红色、[CCl4]2—呈蓝色、[ZnCl4]2—为无色。现将CCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:[C(H2O)6]2++4Cl—[CCl4]2—+6H2O △H,将该溶液分为三份做实验,溶液的颜色变化如表:
以下结论和解释正确的是
A. 等物质的量的[C(H2O)6]2+和[CCl4]2—中σ键数之比为3:2
B. 由实验①可知:△H<0,由实验②可推知加水稀释,浓度熵Q
D. 实验①②③可知:配合物的形成与温度、配体的浓度及配体的种类等有关
15. 逆水煤气变换体系中存在以下两个反应:
反应Ⅰ:
反应Ⅱ:
在恒容条件下,按投料比进行反应,平衡时含碳物质体积分数随温度的变化如图所示。下列说法正确的是
A. 反应Ⅰ的,反应Ⅱ的
B. 点反应Ⅰ的平衡常数
C. 点的压强是的3倍
D 若按投料,则曲线之间交点位置不变
二、非选择题:本题共4小题,共55分。
16. 已知碘的四氯化碳溶液能与溶液发生反应:,甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下:
(1)甲组:通过测定单位时间内生成气体的体积来比较化学反应速率的大小,实验装置如图1所示。
实验Ⅰ.在光亮处将M溶液一次性放入锥形瓶中并不断搅拌,然后关闭活塞。
实验Ⅱ.用黑纸袋包住锥形瓶后再将M溶液一次性放入锥形瓶中并不断搅拌,然后关闭活塞。
两次实验所用M溶液与N溶液相同。
①检查图1装置气密性的方法为___________。
②盛装M溶液的仪器名称为___________,a的作用是___________。
③该实验探究的是___________对化学反应速率的影响。
④在反应停止前,相同时间内注射器中所得的体积较多的是___________(填“实验Ⅰ”或“实验Ⅱ”)。
(2)乙组:通过测定溶液褪色所用时间来比较化学反应速率的大小,实验装置如图2所示。
实验时将M溶液和N溶液同时加入三颈烧瓶中,并不断搅拌,M、N的成分以及水浴温度如下表:
①该实验探究的是___________对化学反应速率的影响。
②该组同学始终没有观察到实验A的溶液褪色,其原因是___________。
17. 完成下列问题。
(1)铬及其化合物在催化、金属防腐等方面具有重要应用。催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。
①完成化学方程式:___________。
②基态Cr原子的价层电子轨道表示式为___________
(2)T℃,2NO2(g)N2O4(g) ,该反应正、逆反应速率与浓度的关系为,(、为速率常数)。结合图像,下列说法错误的是___________
A. 图中表示的线是n
B. 当时,说明反应达到平衡状态
C. T℃时,向2L的容器中充入5ml气体和1ml气体,此时
D. T℃时,向刚性容器中充入一定量气体,平衡后测得为1.0,则平衡时,的数值为
(3)某研究团队利用2CO2(g)+6H2(g)C2H4(g)+4H2O(g)生产乙烯。
在三个容积均为1L的密闭容器中以不同的氢碳比[]充入和,在一定条件下的平衡转化率与温度的关系如图所示。
①下列说法不正确的是___________。
A.该反应的正反应活化能逆反应活化能
B.氢碳比:①>②
C.在氢碳比为2.0时,Q点:
D.该反应发生前后C原子的杂化方式发生改变
②已知Arhenius经验公式为(为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效率,进行了实验探究,依据实验数据获得如图所示曲线。在n催化剂作用下,该反应的活化能___________。从图中信息获知催化效率较高的催化剂是___________ (填“m”或“n”)。
18. 回答下列问题:
(1)亚硝酰氯()气体是有机合成的重要试剂,它可由Cl2和NO在通常条件下反应制得, △H,相关化学键的键能如下表所示:
该反应的△H为___________。
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08ml NO和0.04ml Cl2发生上述反应,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则△H3<0,原因是___________;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图I虚线所示,则改变的条件是___________;在5min时,再充入0.08ml NO和0.04ml Cl2,则混合气体的平均相对分子质量将___________(填“增大”、“减小”或“不变”)。
(3)图Ⅱ是甲、乙两同学描绘上述反应的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是___________(填“甲”或“乙”),a值为___________。25℃时测得反应在某时刻,、、的浓度分别为0.7、0.1、0.3,则此时___________(填“>”“<”或“=”)。
19. 2030年实现“碳达峰”,2060年达到“碳中和”的承诺,体现了我国的大国风范。二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
二氧化碳加氢制甲醇涉及的反应可表示为:
①
②
③
(1)根据上述反应求:④的___________。
(2)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上反应④的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
写出该历程中决速步骤的化学方程式:________。
(3)一体积可变的密闭容器中,在保持a MPa下,按照投料,平衡时,CO和CH3OH在含碳产物中物质的量分数及CO2的转化率随温度的变化如图所示:
①图中m曲线代表的物质为________。
②下列说法正确的是________(填标号)。
A.180~380℃范围内,H2的平衡转化率始终低于CO2
B.温度越高,越有利于工业生产CH3OH
C.一定时间内反应,加入选择性高的催化剂,可提高CH3OH的产率
D.150~400℃范围内,随着温度的升高,CO2的反应速率先减小后增大
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数,270℃时反应①的分压平衡常数为________(保留2位有效数字)。
(4)在一定条件下,密闭容器中加入一定量的CO、H2O(g)和催化剂仅发生反应,其速率方程为,,其中、为正、逆反应速率,、分别为速率常数,p为气体的分压。已知降低温度时,增大,调整CO和H2O初始投料比,测得CO的平衡转化率如图,A、B、C、D四点中温度由高到低的顺序是________,在C点所示投料比下,当CO转化率达到40%时,________。
图①
图②
图③
图④
选项
探究目的
探究方案
A
浓度对化学反应速率的影响
向2支盛有3mL不同浓度溶液的试管中同时加入2mL5%NaClO溶液,观察实验现象
B
温度对化学反应速率的影响
在两支试管中各加入3mL12%溶液,将其中一支用水浴加热,观察并比较实验现象
C
反应的可逆性
向5mLKI溶液中滴加1mL溶液,振荡,用苯多次萃取后,取水层分装在两支试管,向其中一支滴加几滴KSCN溶液,对比两试管中溶液的颜色
D
对与反应的催化作用
在两支试管中各加入4mL酸性溶液和2mL溶液,再向其中一支试管中加入少量固体,观察并比较褪色所需时间
装置
序号
操作
现象
①
将试管置于冰水浴中
溶液均呈粉红色
②
加水稀释
③
加少量ZnCl2固体
序号
M溶液
N溶液
水浴温度
A
含0.01ml碘的四氯化碳溶液20mL
20mL的溶液
40℃
B
含0.01ml碘的四氯化碳溶液20mL
20mL的溶液
40℃
C
含0.01ml碘的四氯化碳溶液20mL
20mL的溶液
50℃
化学键
键能/( kJ∙ml-1)
243
630
200
607
湖北省武汉市华中师范大学第一附属中学2024-2025学年高三上学期8月月考化学试题(Word版附解析): 这是一份湖北省武汉市华中师范大学第一附属中学2024-2025学年高三上学期8月月考化学试题(Word版附解析),文件包含湖北省武汉市华中师范大学第一附属中学2024-2025学年高三上学期8月月考化学试题Word版含解析docx、湖北省武汉市华中师范大学第一附属中学2024-2025学年高三上学期8月月考化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共33页, 欢迎下载使用。
湖北省武汉市华中师范大学第一附属中学2023-2024学年高二上学期期末检测化学试题+: 这是一份湖北省武汉市华中师范大学第一附属中学2023-2024学年高二上学期期末检测化学试题+,共13页。试卷主要包含了下列关于化学用语的说法正确的是,下列装置能达到相应实验目的的是,下列有关烃的说法正确的是,下列离子方程式书写正确的是等内容,欢迎下载使用。
湖北省武汉市华中师范大学第一附属中学2023-2024学年高一上学期1月期末化学试题(Word版附答案): 这是一份湖北省武汉市华中师范大学第一附属中学2023-2024学年高一上学期1月期末化学试题(Word版附答案),共12页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












