
2023-2024学年北京市大兴区高一下学期期末考试化学试题(含答案)
展开一、选择题:本大题共17小题,1-9每小题2分,10-17每小题3分,共42分。
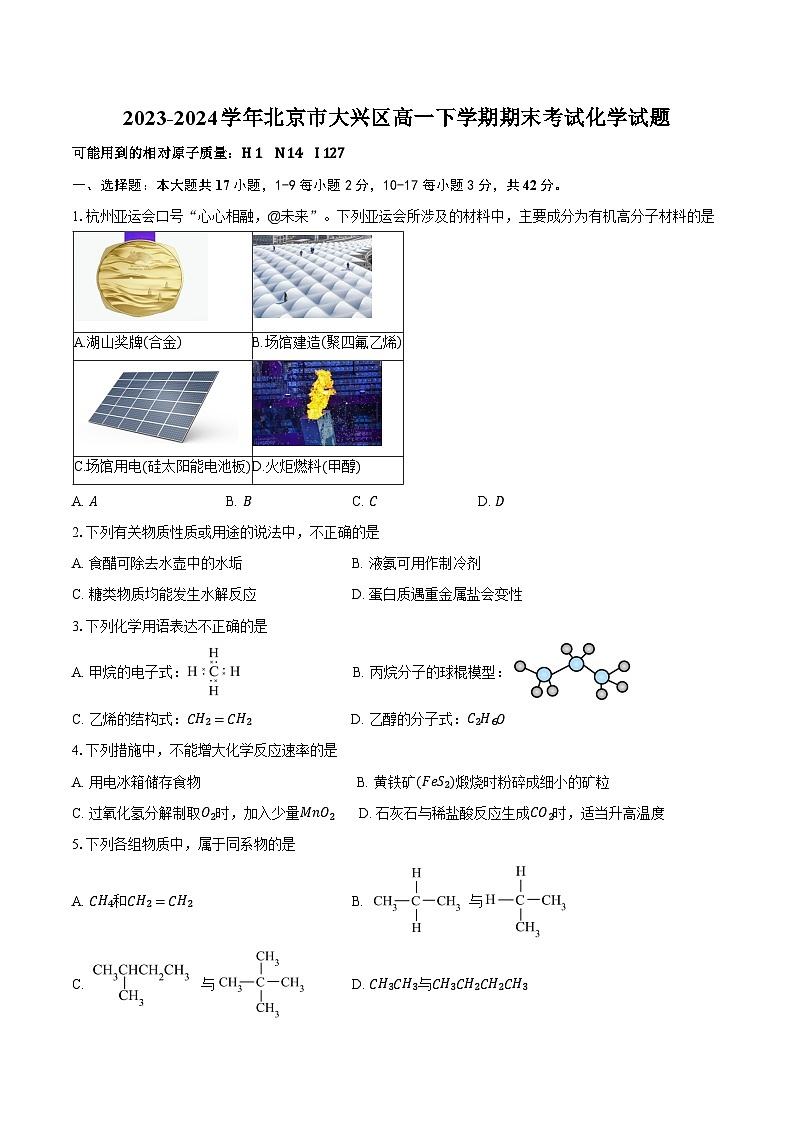
1.杭州亚运会口号“心心相融,@未来”。下列亚运会所涉及的材料中,主要成分为有机高分子材料的是
A. AB. BC. CD. D
2.下列有关物质性质或用途的说法中,不正确的是
A. 食醋可除去水壶中的水垢B. 液氨可用作制冷剂
C. 糖类物质均能发生水解反应D. 蛋白质遇重金属盐会变性
3.下列化学用语表达不正确的是
A. 甲烷的电子式: B. 丙烷分子的球棍模型:
C. 乙烯的结构式:CH2=CH2 D. 乙醇的分子式:C2H6O
4.下列措施中,不能增大化学反应速率的是
A. 用电冰箱储存食物 B. 黄铁矿(FeS2)煅烧时粉碎成细小的矿粒
C. 过氧化氢分解制取O2时,加入少量MnO2 D. 石灰石与稀盐酸反应生成CO2时,适当升高温度
5.下列各组物质中,属于同系物的是
A. CH4和CH2=CH2B. 与
C. 与D. CH3CH3与CH3CH2CH2CH3
6.下列解释现象(或事实)的方程式中,不正确的是
A. 氨的催化氧化:4NH3+5O2催化剂Δ4NO+6H2O
B. 工业上用电解法制取金属钠:2NaCl(熔融)电解 2Na+Cl2↑
C. 铁与稀硫酸反应有无色气体生成:2Fe+6H+=2Fe3++3H2↑
D. 稀硝酸与铜反应产生无色气体:3Cu+ 2NO3−+8H+=3Cu2++2NO↑+4H2O
7.下列关于如图所示的原电池装置及原理的说法中,不正确的是
A. 该装置可将化学能转化为电能
B. Zn是负极,其质量逐渐减小
C. 电流从Zn片经导线流向Cu片
D. Cu表面产生无色气泡,电极反应式为:2H++2e−=H2↑
8.实验室用乙酸、乙醇和浓硫酸制取乙酸乙酯的装置如图。下列说法中,不正确的是
A. 右侧试管中盛放的是饱和Na2CO3溶液
B. 右侧试管中导管不伸入液面下,是为了防止倒吸
C. 加入过量乙醇,可使乙酸完全转化为乙酸乙酯
D. 实验结束,右侧试管内液体上层为无色透明的油状液体
9.下列反应属于加成反应的是
A.
B. CH2=CH2+Br2→CH2BrCH2Br
C. 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
D. +HO−NO2→Δ浓硫酸+H2O
10.在密闭容器中发生反应:2SO2(g)+O2(g)⇀↽2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4ml·L−1、0.2ml·L−1、0.4ml·L−1,当反应达到平衡时,可能存在的数据是
A. SO2为0.6ml·L−1,O2为0.3ml·L−1
B. SO3为0.8ml·L−1
C. SO2为0.2ml·L−1,O2为0.3ml·L−1
D. SO2、SO3均为0.3ml·L−1
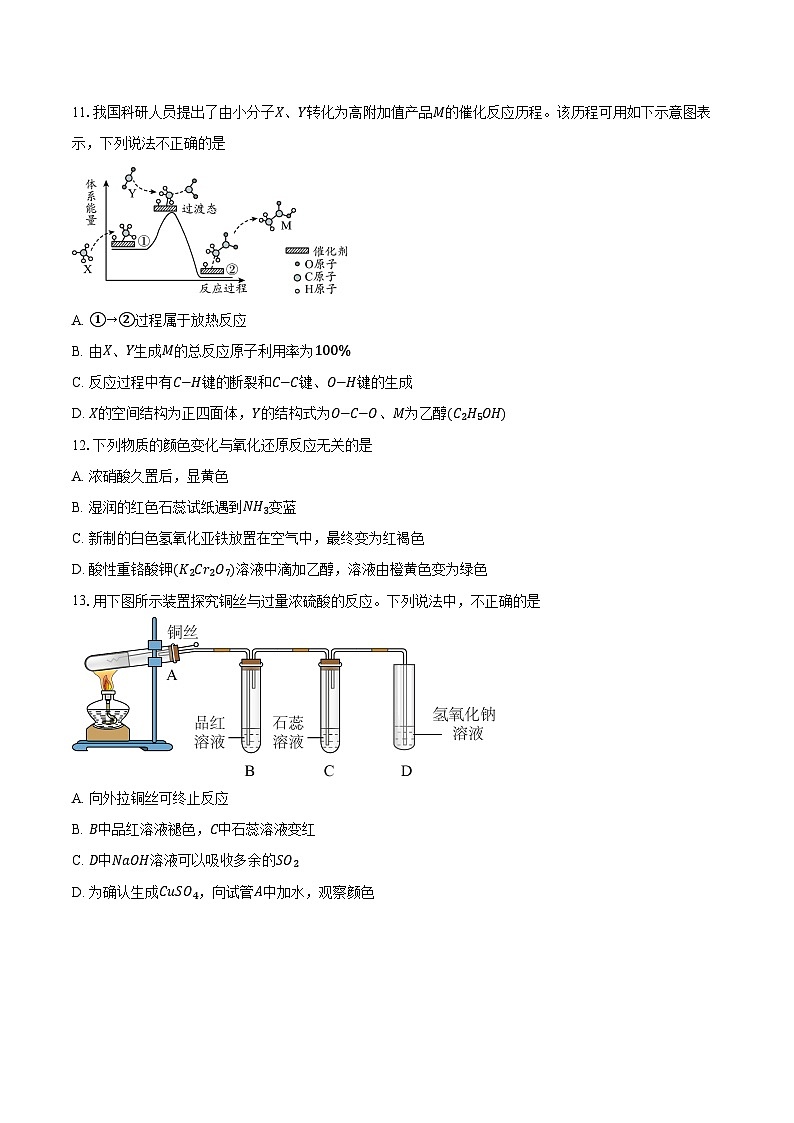
11.我国科研人员提出了由小分子X、Y转化为高附加值产品M的催化反应历程。该历程可用如下示意图表示,下列说法不正确的是
A. ①→②过程属于放热反应
B. 由X、Y生成M的总反应原子利用率为100%
C. 反应过程中有C−H键的断裂和C−C键、O−H键的生成
D. X的空间结构为正四面体,Y的结构式为O−C−O、M为乙醇(C2H5OH)
12.下列物质的颜色变化与氧化还原反应无关的是
A. 浓硝酸久置后,显黄色
B. 湿润的红色石蕊试纸遇到NH3变蓝
C. 新制的白色氢氧化亚铁放置在空气中,最终变为红褐色
D. 酸性重铬酸钾(K2Cr2O7)溶液中滴加乙醇,溶液由橙黄色变为绿色
13.用下图所示装置探究铜丝与过量浓硫酸的反应。下列说法中,不正确的是
A. 向外拉铜丝可终止反应
B. B中品红溶液褪色,C中石蕊溶液变红
C. D中NaOH溶液可以吸收多余的SO2
D. 为确认生成CuSO4,向试管A中加水,观察颜色
14.关于下图的说法不正确的是
A. 1 ml I2(g)变为1 ml I2(s)时需要放出17 kJ的能量
B. 1 ml I2(s)与1 ml H2(g)化合生成2 ml HI(g)气体时,需要吸收5 kJ的能量
C. 2 ml HI(g)气体分解生成1 ml I2(g)与1 ml H2(g)时需要吸收12 kJ的能量
D. I2(g)与H2(g)生成HI(g)气体的反应是吸热反应
15.下列实验结论与实验现象的对应关系,正确的一组是
A. AB. BC. CD. D
16.下述实验方案能达到实验目的的是
A. AB. BC. CD. D
17.某化学兴趣小组同学进行如下实验:①分别向CuSO4溶液和FeSO4溶液中滴加KSCN溶液,均无明显现象。②向CuSO4和FeSO4的混合液中滴加少量KSCN溶液,溶液立刻变红,振荡后,红色褪去,产生白色沉淀,继续滴加过量KSCN溶液,红色不再褪去,并产生大量白色沉淀。③过滤②中白色沉淀并洗涤干净,向其中加入过量氨水,白色沉淀溶解得无色溶液,放置过程中,无色溶液变蓝色。已知:CuSCN为白色、难溶性物质;CuNH32+为无色离子;CuNH342+为深蓝色离子。下列说法不正确的是
A. 实验①说明Cu2+不能与SCN反应生成CuSCN
B. 实验②中红色褪去的原因是振荡后cFe3+降低
C. 实验③中无色溶液变蓝色的原因是:4CuNH32++O2+8NH3⋅H2O=4CuNH342++4OH−+6H2O
D. 依据实验①、②、③推测,②中由于生成CuSCN,使Cu2+氧化性增强,将Fe2+氧化为Fe3+
二、非选择题:本大题共5小题,共58分。
18.实验室常用如图所示装置可制取干燥的NH3。
(1)写出A中反应的化学方程式__________。
(2)B中碱石灰的作用是__________。
(3)在上图方框内画出用试管收集NH3的示意图。__________
(4)若将A中固体混合物换成NH4Cl固体,__________(填“能” 或“不能”)制取NH3,原因是__________(用化学方程式表示)。
(5)根据氨溶于水(滴有少量酚酞)的喷泉实验,可以得出的结论__________、__________。
19.汽车尾气中含有CO、NO等有害气体。
(1)汽车尾气中NO生成过程的能量变化示意图如下:
该条件下,1ml N2和1ml O2完全反应生成NO,会__________(填“吸收”或“放出”)__________kJ能量。
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:
NiO电极上发生的是__________反应(填“氧化”或“还原”),写出该电极的电极反应式__________。
(3)利用催化技术可将汽车尾气中的CO和NO转化为CO2和N2.该反应的化学方程式为:2NO+2CO催化剂 2CO2+ N2。
①某温度下,在容积不变的密闭容器中通入CO和NO,测得不同时间CO的浓度如下表:
用CO的浓度变化表示0∼2 s的平均反应速率为__________ ml·L−1·s−1。
②下列情况可说明该反应达到化学平衡状态的是__________(填序号)。
a.CO的浓度不再改变
b.容器中的气体质量保持不变
c.NO、CO、CO2、N2的物质的量之比为2︰2︰2︰1
d.相同时间内,反应消耗2 ml NO同时消耗1 ml N2
③已知:增大催化剂的比表面积可提高该反应速率。
为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
i.将表中数据补充完整:a__________;b__________。
ii.实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线__________(填“甲”或“乙”)。
20.某研究性学习小组为了从海带中提取碘,设计并进行了如下实验:
已知:萃取是利用物质在互不相溶的溶剂里的溶解度不同,用一种溶剂(萃取剂)把物质从它与另一种溶剂所组成的溶液里提取出来。
(1)步骤①灼烧海带时,除需要三脚架、泥三角和酒精灯外,还需要用到的实验仪器是__________。
(2)步骤③的实验操作名称是__________。
(3)写出步骤④反应的离子方程式__________。
(4)操作⑤选用CCl4做萃取剂,原因是__________(填序号)。
a.CCl4不溶于水 b.CCl4的密度比水大
c.I2在CCl4中比在水中溶解度更大 d.CCl4与碘水不反应
(5)从I2的CCl4溶液中提取碘可用反向萃取的方法,其流程如下:
①I2的CCl4溶液加入少量6 ml·L−1NaOH溶液,写出反应的离子方程式__________。
②操作1中应将含I2的碱溶液从仪器的__________(填“上”或“下”)口倒入烧杯中。
③上层溶液(含I−、IO 3−)中加入几滴45%的H2SO4溶液并搅拌,溶液立即变为棕黄色,并析出碘晶体,若生成7.62g I2单质时转移__________ ml电子。
(6)已知:溶液中I2的浓度越大吸光度越大。
用色度计测得溶液的吸光度随海带灼热(灰化)的时间变化如图所示。当时间超过40min时,溶液的吸光度逐渐降低的原因是__________。
21.已知:A是石油化学工业重要的原料,其产量可以用来衡量一个国家的石油化学工业的发展水平;H是一种合成高分子材料。(部分反应条件已略去)
请按要求回答下列问题:
(1)D中所含官能团的名称是__________。
(2)写出B → C的反应类型__________;试剂a是__________。
(3)写出A → H反应的化学方程式__________。
(4)写出D → E反应的化学方程式__________。
(5)C是一种速效局部冷冻麻醉剂,可由反应①或②制备,请指出用哪一个反应制备较好__________(填“①”或“②”),说明理由__________。
(6)写出D + F → G反应的化学方程式__________。
(7)下列说法正确的是__________ (填序号)。
a.等物质的量的A和D完全燃烧时消耗O2的量相等
b.B的同系物中,当碳原子数 ≥ 4时开始出现同分异构现象
c.A和H都能使溴水或酸性KMnO4溶液褪色
d.D和F均能与NaOH溶液、Na2CO3溶液反应
22.某化学学习小组探究浓度对硝酸氧化能力的影响。
Ⅰ.该小组同学通过对比NO通入浓、稀硝酸的现象,比较浓、稀硝酸氧化性的相对强弱,实验装置如下图所示(夹持仪器已略去,气密性已检查)。
资料:i.NaOH溶液能吸收NO2,但不能吸收NO。
ii.NO2溶于水的过程产生HNO2(亚硝酸)。
iii.HNO2(亚硝酸):无色易溶于水的弱酸,不稳定,可由亚硝酸盐与强酸反应制得。
请按要求回答下列问题:
(1)装置a的名称是__________。
(2)写出装置①中反应的离子反应方程式__________。
(3)滴加浓硝酸前需先通入N2,目的是__________。
(4)NaOH溶液的作用是吸收尾气,补全该反应的化学方程式:__________。
▫NaOH+▫___________=▫___________+NaNO2+▫H2O
(5)滴加浓硝酸后,出现__________现象,可得出结论:浓硝酸的氧化性强于稀硝酸。
Ⅱ.实验结束后,该小组同学将装置①中的绿色溶液加水稀释后得到蓝色溶液A[其中的c(HNO3)=3ml·L−1],发现在室温下,向溶液A加铜片立即产生气泡,而相同条件下,3 ml·L−1稀硝酸(溶液B)中加铜片短时间内无明显变化,一段时间后才产生气泡。针对这一现象,该小组同学又进一步研究。
(6)该小组同学推测Cu与浓HNO3反应后溶液呈绿色的原因是溶液中溶解了生成的气体所致,分析加水稀释过程溶液变为蓝色的原因__________(用化学方程式表示)。
(7)探究溶液A与铜片立即产生气泡,而相同条件下,3 ml·L−1稀硝酸(溶液B)遇铜片短时间内无明显变化的原因。
①小组同学提出假设:HNO2对该反应有催化作用。通过实验验证了该假设,实验方案是:向盛有铜片的B溶液中__________(填实验操作和现象)。
②催化剂能够加快化学反应速率的原因是:改变反应历程,先参加反应,后又生成,反应前后催化剂的质量和性质不发生改变。由此同学们推测Cu与稀硝酸反应中HNO2起催化作用的过程如下:
i.__________(用离子方程式表示)。
ii.NO 3−+2NO+H++H2O=3HNO2。
参考答案
1.B
2.C
3.C
4.A
5.D
6.C
7.C
8.C
9.B
10.A
11.D
12.B
13.D
14.D
15.A
16.C
17.B
18.(1)2NH4Cl+Ca(OH)2Δ CaCl2+2NH3↑+2H2O
(2)干燥NH3
(3)
(4) 不能 NH3+HCl=NH4Cl
(5) 氨气极易溶于水 氨水呈碱性
19.(1)吸收 180
(2) 氧化 NO−2e−+O2−=NO2
(3) 3.75×10−4 a、d 280 1.20×10−3 乙
20.(1)坩埚
(2)过滤
(3)2I−+H2O2+2H+=I2+2H2O
(4)acd
(5) 3I2+6OH−=5I−+IO3−+3H2O 上 0.05
(6)I−被氧化成I2,I2挥发造成碘元素流失
21.(1)羟基
(2) 取代反应 HCl
(5) ① 反应①为加成反应,无副反应发生,原子利用率高
(6)CH3CH2OH+CH3COOH⇌浓H2SO4ΔCH3COOCH2CH3+H2O
(7)a、b
22.(1)分液漏斗
(2)Cu+2NO3−+4H+=Cu2++2NO2↑+2H2O
(3)赶尽O2,防止NO被氧化为NO2
(4)2NaOH + 2NO2=NaNO3+NaNO2+H2O
(5)装置③中液面上方会产生红棕色气体,装置④中液面上方为无色气体
(6)3NO2+H2O=2HNO3+NO
(7) 加入少量亚硝酸钠,溶液B中铜片上立即产生气泡 2H++Cu+2HNO2=Cu2++2NO↑+2H2O
A.湖山奖牌(合金)
B.场馆建造(聚四氟乙烯)
C.场馆用电(硅太阳能电池板)
D.火炬燃料(甲醇)
选项
实验
现象
结论
A
Na2CO3粉末中加入稀硫酸,将产生的气体通入Na2SiO3溶液
出现白色沉淀
非金属性:S>C>Si
B
某溶液中加入盐酸酸化的BaCl2溶液
出现白色沉淀
该溶液中一定含有SO 42−
C
蔗糖中滴加浓硫酸
蔗糖变黑
浓硫酸具有吸水性
D
淀粉溶液中加入少量稀H2SO4,加热,冷却后再加少量新制的Cu(OH)2,加热
无砖红色沉淀生成
淀粉未发生水解反应
方案
目的
A.除去甲烷中的乙烯气体
B.在光照条件下制取纯净的一氯甲烷
方案
目的
C.蒸馏法实现海水淡化
D.探究Fe3+、Cu2+对H2O2分解速率的影响
时间/s
0
1
2
3
……
c(CO) / ×10−3ml·L−1
3.60
3.05
2.85
2.75
……
实验编号
t (℃)
NO初始浓度(ml·L−1)
CO初始浓度(ml·L−1)
催化剂的比表面积(m2·g−1)
Ⅰ
280
1.20×10−3
5.80×10−3
82
Ⅱ
a
1.20×10−3
5.80×10−3
124
Ⅲ
350
b
5.80×10−3
82
北京市大兴区2023-2024学年高二上学期期末考试化学试题: 这是一份北京市大兴区2023-2024学年高二上学期期末考试化学试题,共13页。试卷主要包含了01,下列化学用语的表述正确的是,是由钛精矿的重要中间产物,已知等内容,欢迎下载使用。
北京市大兴区2022-2023学年高一下学期期末考试化学试题含答案: 这是一份北京市大兴区2022-2023学年高一下学期期末考试化学试题含答案,共21页。试卷主要包含了下列物质互为同分异构体的是,下列说法不正确的是,下列化学用语表达不正确的是,下列各组物质反应时,反应条件,根据乙烯的化学性质可以推测丙烯等内容,欢迎下载使用。
北京市大兴区2022-2023学年高一下学期期末考试化学试题(Word版无答案): 这是一份北京市大兴区2022-2023学年高一下学期期末考试化学试题(Word版无答案),共11页。试卷主要包含了07,5倍.转化过程如下图所示,595,753等内容,欢迎下载使用。












