

2024-2025学年北京一六一中学高三上学期开学测试化学试题(含答案)
展开1.下列对于生产、生活中现象和事实的分析不合理的是
A. 节日燃放的焰火绚丽多彩与原子核外电子跃迁有关
B. 宇宙飞船返回舱外壳用网状结构的酚醛树脂制造与网状结构高分子的热固性有关
C. 注入钢水前,模具须干燥与铁与水能发生反应有关
D. 植物油氢化所得硬化油不易被空气氧化与植物油中含有酯基有关
2.下列图示正确的是
A. 3p电子的电子云轮廓图:
B. SO3的VSEPR模型:
C. As的原子结构示意图:
D. HCl的形成过程:
3.7−羟基香豆素的结构简式如图所示,下列说法不正确的是
A. 分子式为C9H6O3
B. 所有碳原子可能在同一平面上
C. 1ml该物质与足量溴水反应,最多消耗3mlBr2
D. 1ml该物质与足量NaOH溶液反应,最多消耗2mlNaOH
4.下列事实不能直接从原子结构角度解释的是
A. 化合物ICl中I为+1价B. 第一电离能:B>Al
C. 沸点:CS2>CO2D. 热稳定性:NH3>PH3
5.向含HCN的废水中加入铁粉和K2CO3可制备K4[Fe(CN)6],反应如下:6HCN+Fe+2K2CO3=K4[Fe(CN)6]+H2↑+2CO2↑+2H2O。下列说法不正确的是
A. 依据反应可知:Ka(HCN)>Ka1(H2CO3)
B. HCN的结构式是H—C≡N
C. 反应中每1mlFe转移2ml电子
D. [Fe(CN)6]4−中Fe2+的配位数是6
6.下列说法不正确的是
A. 纤维素能够发生酯化反应,不能被银氨溶液等弱氧化剂氧化
B. 核苷与磷酸通过醚键结合形成核苷酸,如
C. 攀登高山时佩戴护目镜,防止强紫外线引起皮肤和眼睛的蛋白质变性灼伤
D. 丙醛糖()分子中含有手性碳原子,存在对映异构体
7.下列颜色变化与氧化还原反应无关的是
A. 用小刀切开金属钠,表面逐渐变暗
B. 推进盛有NO2的密闭针筒的活塞,气体颜色变深
C. 将酸性KMnO4溶液滴入H2C2O4溶液中,溶液紫色褪去
D. 将FeSO4溶液加入NaOH溶液中,最终生成红褐色沉淀
8.下列依据相关数据作出的推断中,不正确的是
A. 依据相同温度下可逆反应的Q与K大小的比较,可推断反应进行的方向
B. 依据一元弱酸的Ka,可推断它们同温度同浓度稀溶液的pH大小
C. 依据第二周期主族元素电负性依次增大,可推断它们的第一电离能依次增大
D. 依据F、Cl、Br、I的氢化物分子中氢卤键的键能,可推断它们的热稳定性强弱
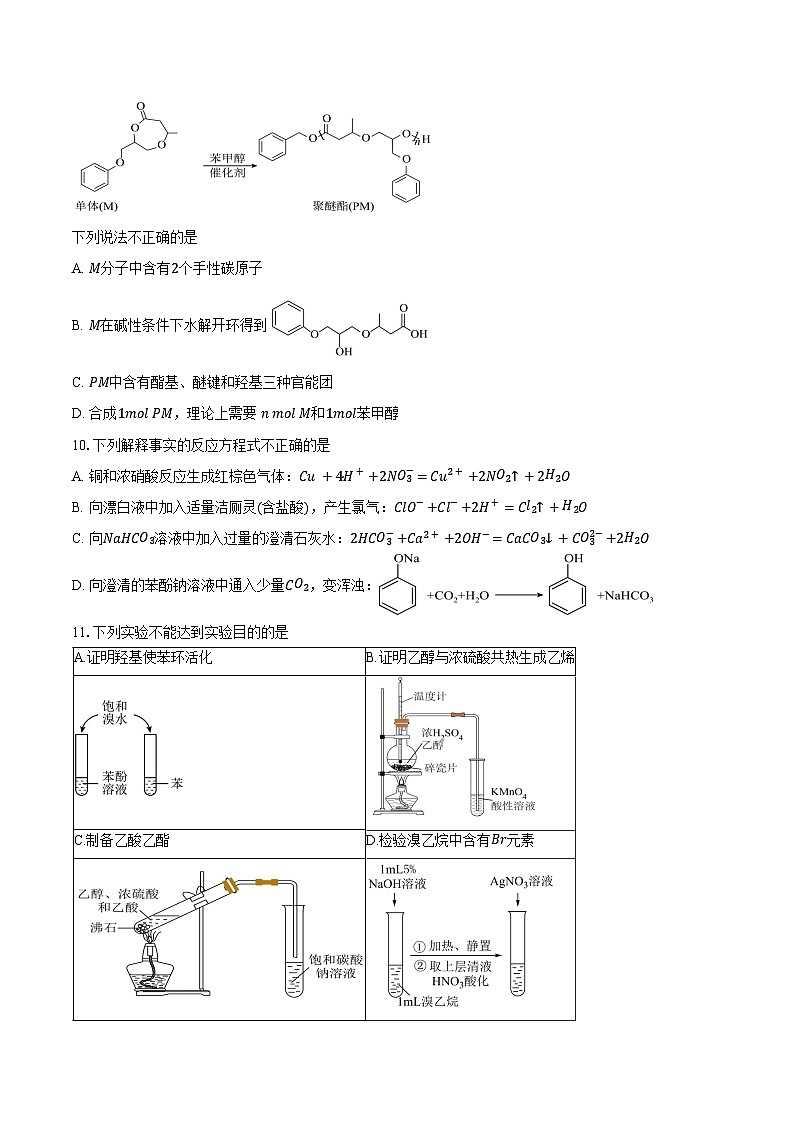
9.我国科学家最新合成出一种聚醚酯(PM)新型材料,可实现“单体−聚合物−单体”的闭合循环,推动塑料经济的可持续发展。合成方法如下:
下列说法不正确的是
A. M分子中含有2个手性碳原子
B. M在碱性条件下水解开环得到
C. PM中含有酯基、醚键和羟基三种官能团
D. 合成1ml PM,理论上需要 n ml M和1ml苯甲醇
10.下列解释事实的反应方程式不正确的是
A. 铜和浓硝酸反应生成红棕色气体:Cu+4H++2NO3−=Cu2++2NO2↑+2H2O
B. 向漂白液中加入适量洁厕灵(含盐酸),产生氯气:ClO−+Cl−+2H+=Cl2↑+H2O
C. 向NaHCO3溶液中加入过量的澄清石灰水:2HCO3−+Ca2++2OH−=CaCO3↓+CO32−+2H2O
D. 向澄清的苯酚钠溶液中通入少量CO2,变浑浊:
11.下列实验不能达到实验目的的是
A. AB. BC. CD. D
12.二氧化碳基聚碳酸酯是通过环氧化物和二氧化碳共聚得到的一种绿色高分子材料,一种聚碳酸酯M的合成方法如下:
下列说法不正确的是
A. K和M中均含有手性碳原子
B. 使用该材料时应避免接触强酸或强碱
C. 生成1mlM参加反应的CO2的物质的量为(m+n)ml
D. 依据M的合成原理,可推测合成M的过程中会产生含六元环的副产物
13.X为含Cu2+的配合物。实验室制备X的一种方法如图。
下列说法不正确的是
A. ①中发生反应:Cu2++2NH3·H2O=Cu(OH)2↓+2NH 4+
B. 在①和②中,氨水参与反应的微粒相同
C. X中所含阴离子是SO 42−
D. X的析出利用了其在乙醇中的溶解度小于在水中的溶解度
14.某实验小组探究KMnO4溶液与NH3以及铵盐溶液的反应。
已知:MnO4−的氧化性随溶液酸性增强而增强;MnO2为棕黑色,Mn2+接近无色。
下列说法不正确的是
A. 由Ⅱ可知,pH=13时,OH−不能还原MnO4−
B. 由Ⅰ、Ⅱ、Ⅲ可知,与NH4+相比,NH3更易还原MnO4−
C. 由Ⅲ、Ⅳ可探究溶液pH对NH4+与MnO4−反应的影响
D. 由Ⅳ、Ⅴ可知,NH4+浓度降低,其还原性增强
二、综合题:本大题共5小题,每小题8分,共40分。
15.锂电池的电解液是目前研究的热点。
(1)锂电池的电解液可采用溶有LiPF6的碳酸酯类有机溶液。
①基态Li+的电子云轮廓图的形状为______。
②基态P原子的价层电子轨道表示式为______,P原子核外电子有______种空间运动状态
(2)为提高锂电池的安全性,科研人员采用离子液体作电解液。某种离子液体的阳离子的结构简式如下,阴离子为PF6−。
①N、F、P三种元素的第一电离能由大到小的顺序为______。
②该阳离子中,带“∗”的C原子的杂化轨道类型为______杂化。根据VSEPR模型,PF6−的中心原子上的价层电子对数为______,空间结构为正八面体形。
(3)Li2S因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如图所示,晶胞的边长为apm1pm=10−10cm。
①晶胞中的“O”代表______(填“Li+”或“S2−”)。
②距离Li+最近的S2−有______个。
③已知Li2S的摩尔质量是Mg/ml,阿伏伽德罗常数为NA。该晶体的密度为______g/cm3。
16.FeF6 3−与许多金属离子或NH4+形成的化合物有广泛的用途。
(1)从价电子排布的角度解释Fe位于元素周期表d区的原因:______。
(2)钢铁表面成膜技术是钢铁防腐的重要方法。工业上利用某种转化液使钢铁表面形成致密的K3FeF6膜以进行防腐,该转化液是含KF、HNO3、NH42S2O8(或H2O2)等物质的溶液(pH≈2)。S2O82−的结构如下:
①比较O原子和S原子的第一电离能大小,从原子结构的角度说明理由:______。
②下列说法正确的是______(填字母)。
a.NH42S2O8能将Fe2+氧化为Fe3+的可能原因是含有“−O−O−”结构
b.依据结构分析,NH42S2O8中硫元素的化合价为+7价
c.S2O82−中“S−O−O”在一条直线上,
③转化液pH过小时,不易得到K3FeF6,原因是______。
(3)FeF63−与NH4+形成的化合物可以作为锂离子电池的电极材料。
①化合物NH43FeF6中的化学键类型有______(填字母)。
a.离子键 b.极性共价键 c.非极性共价键 d.金属键 e.配位键
②NH43FeF6的晶胞形状为立方体,边长为anm,结构如下图所示:
图中“●”代表的是______(填“NH4+”或“FeF63−”)。已知NH43FeF6的摩尔质量是Mg⋅ml−1,阿伏加德罗常数为NA,该晶体的密度为______g⋅cm−3。1nm=10−7cm
17.钒(V)被称为钢铁行业的“维生素”。从某钒矿石焙砂中提取钒的主要流程如下:
已知:
i.滤液A中的阳离子主要有H+、VO 2+、Fe3+、Al3+等;
ii.“萃取”过程可表示为VO2++2HA(有机相)⇀↽ VOA2(有机相)+2H+。
(1)“浸钒”时,为加快浸出速率可采取的措施有__________(写出1条即可)。
(2)“浸钒”过程中,焙砂中的V2O5与硫酸反应的离子方程式为__________。
(3)“还原”过程中,铁粉发生的反应有Fe+2H+=Fe2++H2↑、2Fe3++Fe=3Fe2+和如下反应,补全该反应的离子方程式_________。
VO 2++ Fe+ ___________= VO2++ Fe2++ ___________
(4)“萃取”前,若不用石灰乳先中和,萃取效果不好,原因是__________。
(5)写出“煅烧”过程发生反应的化学方程式__________。
(6)用以下方法测量“浸钒”过程中钒的浸出率。从滤液A中取出1mL,用蒸馏水稀释至
10mL,加入适量过硫酸铵,加热,将滤液A中可能存在的VO2+氧化为VO 2+,继续加热煮沸,除去过量的过硫酸铵。冷却后加入3滴指示剂,用cml·L−1的(NH4)2Fe(SO4)2标准溶液将VO 2+滴定为VO2+,共消耗v1mL(NH4)2Fe(SO4)2溶液。
已知:a.所取钒矿石焙砂中钒元素的质量为ag;所得滤液A的总体积为bmL;
b.3滴指示剂消耗v2mL(NH4)2Fe(SO4)2溶液。
①用上述方法测得“浸钒”过程中钒的浸出率为__________。
②若不除去过量的过硫酸铵,钒浸出率的测定结果将__________(填“偏高”“不变”或“偏低”)。
18.治疗抑郁症的药物帕罗西汀的合成路线如下。
已知:
(1)A分子含有的官能团是______。
(2)已知:B为反式结构。下列有关B的说法正确的是(填序号)______。
a.核磁共振氢谱有5组峰
b.能使酸性KMnO4溶液褪色
c.存在2个六元环的酯类同分异构体
d.存在含苯环和碳碳三键的羧酸类同分异构体
(3)E→G的化学方程式是______。
(4)J分子中有3个官能团,包括1个酯基。J的结构简式是______。
(5)L的分子式为C7H6O3。L的结构简式是______。
(6)从黄樟素经过其同分异构体N可制备L。
已知:
i.R1CH=CHR2→①O3②Zn,H2OR1CHO+R2CHO
ii.
写出制备L时中间产物N、P、Q的结构简式:______、______、______。
19.某小组研究Na2S溶液与KMnO4溶液反应,探究过程如下。
资料:ⅰ.MnO4−在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2。
ⅱ.单质硫可溶于硫化钠溶液,溶液呈淡黄色。
(1)根据实验可知,Na2S具有_______性。
(2)甲同学预测实验I中S2–被氧化成SO32−。
①根据实验现象,乙同学认为甲的预测不合理,理由是_______。
②乙同学取实验I中少量溶液进行实验,检测到有SO42−,得出S2–被氧化成SO42−的结论,丙同学否定了该结论,理由是_______。
③同学们经讨论后,设计了如下实验,证实该条件下MnO4−的确可以将S2–氧化成SO42−。
a.右侧烧杯中的溶液是_______。
b.连通后电流计指针偏转,一段时间后,_______(填操作和现象)。
(3)实验I的现象与资料i存在差异,其原因是新生成的产物(Mn2+)与过量的反应物(MnO4−)发生反应,该反应的离子方程式是_______。
(4)实验II的现象与资料也不完全相符,丁同学猜想其原因与(3)相似,经验证猜想成立,他的实验方案是_____。
(5)反思该实验,反应物相同,而现象不同,体现了物质变化不仅与其自身的性质有关,还与_______因素有关。
参考答案
1.D
2.C
3.D
4.C
5.A
6.B
7.B
8.C
9.B
10.C
11.B
12.D
13.B
14.D
15.(1)球形 9
(2) F、N、P sp2 6
(3) Li+ 4 4×MNAa×10−103
16.(1)基态Fe原子的价电子排布为3d64s2,最后填入电子的能级为3d
(2) 第一电离能O>S。O和S为同主族元素,电子层数O
(3) abe [FeF6]3− 4MNA×a3×10−21
17.(1)搅拌(合理给分)
(2)V2O5+2H+=2VO 2++H2O
(3)2VO 2++Fe+4H+=2VO2++Fe2++2H2O
(4)若不用石灰乳中和,溶液中c(H+)较大,不利于平衡VO2++2HA(有机相)⇀↽ VOA2(有机相)+2H+正向移动,对VO2+萃取效果不好
(5)(NH4)2V6O16煅烧 3V2O5+2NH3↑+H2O
;②偏高
18.(1)氟原子(或碳氟键)、醛基
(2)abc
(3)NC−CH2−COOH + HOCH2CH3⇌浓硫酸ΔNC−CH2−COOCH2CH3+ H2O
(4)
(5)
(6)
19.还原溶液呈紫色,说明酸性KMnO4溶液过量,SO32−能被其继续氧化 因KMnO4溶液是用H2SO4酸化的,故溶液中出SO42−不一定是氧化新生成的 0.01ml/L KMnO4溶液(H2SO4酸化至pH=0) 取左侧烧杯中的溶液,用盐酸酸化后,滴加BaCl2溶液,观察到有白色沉淀生成 2MnO4−+3Mn2+−+ 2H2O = 5MnO2↓+ 4H+ 将实验I中生成的MnO2分离洗涤后,加入0.1ml/L Na2S溶液,观察到有浅粉色沉淀,且溶液呈黄色,证明新生成的MnO2与过量的S2−反应,故没得到MnO2沉淀 浓度、用量、溶液中的酸碱性 A.证明羟基使苯环活化
B.证明乙醇与浓硫酸共热生成乙烯
C.制备乙酸乙酯
D.检验溴乙烷中含有Br元素
实验
序号
试剂a
实验现象
Ⅰ
8ml·L−1氨水(pH≈13)
紫色变浅,底部有棕黑色沉淀
Ⅱ
0.1ml·L−1NaOH溶液
无明显变化
Ⅲ
4ml·L−1(NH4)2SO4溶液(pH≈6)
紫色略变浅,底部有少量棕黑色沉淀
Ⅳ
硫酸酸化的4ml·L−1(NH4)2SO4溶液(pH≈1)
紫色变浅
Ⅴ
硫酸酸化的4ml·L−1NH4Cl溶液(pH≈1)
紫色褪去
2024-2025学年北京市铁路第二中学高三上学期开学测试化学试题(含答案): 这是一份2024-2025学年北京市铁路第二中学高三上学期开学测试化学试题(含答案),共11页。试卷主要包含了单选题,实验题,简答题等内容,欢迎下载使用。
[化学]2024~2025学年北京一六一中学高三上学期开学测试试题(有答案): 这是一份[化学]2024~2025学年北京一六一中学高三上学期开学测试试题(有答案),共12页。
北京一六一中学2024-2025学年高三上学期开学测试化学试题: 这是一份北京一六一中学2024-2025学年高三上学期开学测试化学试题,共12页。












