





第01讲 钠及其重要化合物(课件)-2025年高考化学一轮复习讲练测(新教材新高考)
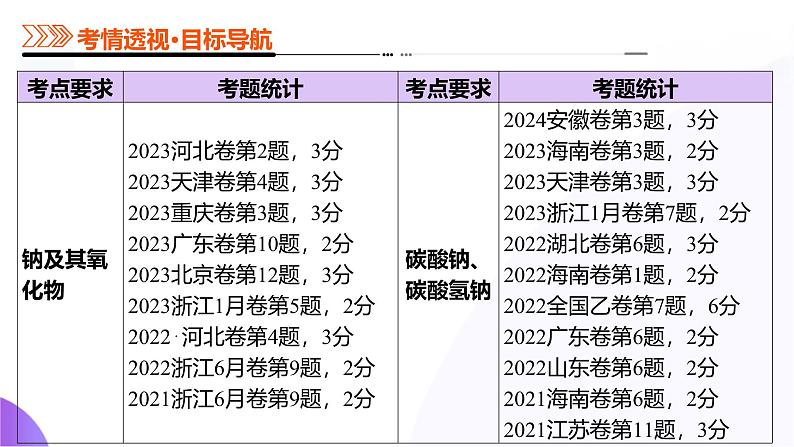
展开考向1 考查钠的性质及其应用
考向2 考查钠的氧化物及其应用
考向1 考查碳酸钠和碳酸氢钠性质与检验
考向2 考查侯氏制碱法
考向1 考查碱金属的相似性、递变性
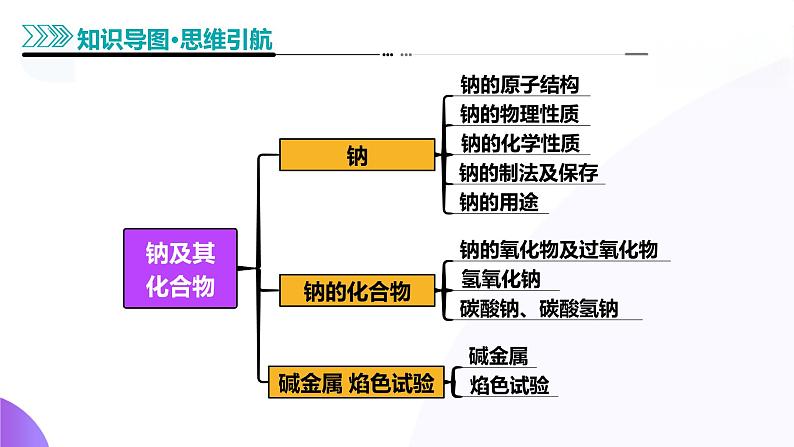
知识点1 钠的性质及应用
2.从钠原子的原子结构认识钠的化学性质——______性
(1)与非金属单质(如O2、Cl2)的反应
O2、Cl2 、 H2O 、 H+等
③实验结论:化学方程式:___________________________、离子方程式:________________________________。
(3)与盐酸、硫酸反应离子方程式:___________________________。
(4)与盐反应a.与熔融盐反应
总反应:______________________________________________________________
______________________________________________________________________
①投入NaCl溶液中,只有H2放出:_____________________________________
(4)与盐反应b.与盐溶液反应
②投入NH4Cl溶液中有H2和NH3逸出:___________________________________
2Na+2H2O=2NaOH+H2↑
2Na+2NH4Cl=2NaCl+H2↑+2NH3↑
③投入CuSO4溶液中有H2逸出和蓝色沉淀生成:
2Na+CuSO4+2H2O=Na2SO4+H2↑+Cu(OH)2↓
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
(5)与某些有机物(含羟基)反应
2Na+2CH3CH2OH→____________________________
2CH3CH2ONa+H2↑
2Na+2CH3COOH→____________________________
2CH3COONa+H2↑
(1)工业制取:__________________________。
(2)保存:密封保存,通常保存在______油或____油中,钠易与空气中的_________反应,且钠的密度比煤油的密度____,____与煤油反应,故通常将少量钠保存在______中,大量钠保存在______中。
(1)钠钾合金(液态)可用于原子反应堆的______剂。
(2)用作电光源,制作________灯。
(3)冶炼某些金属:钠能与钛、锆、铌、钽等氯化物(熔融)发生置换反应,金属钠具有强还原性,熔融状态下可以用于制取金属,如__________________________________________。
(4)制取_______等化合物。
1.钠燃烧时不能用____灭火,应用______盖灭。
2.取用金属钠时,用____夹取金属钠,用滤纸擦干表面的煤油,放在洁净干燥的玻璃片上用小刀切割,不能用手_________金属钠,并且将剩余的钠放回______瓶中保存。
4.钠性质的巧记口诀:银白轻低软,传导热和电;遇氧产物变,遇氯生白烟;遇水记五点,浮熔游响红;遇酸酸优先,遇盐水在前。
1.氧化钠与过氧化钠的比较
知识点2 钠的氧化物与氢氧化物
(1)强氧化性的六个表现
⑤无论是过氧化钠还是其他过氧化物,具有强氧化性、漂白性等特殊性质的根本原因是这些物质中都含有________。
①从结构角度Na2O2的结构中含有过氧键(___________),含有过氧键结构的物质有______的氧化性,以此类推,如:H2O2、H2SO5(过硫酸,相当于H2O2中的一个H被—SO3H取代)、Na2S2O8(过二硫酸钠)中都有过氧键结构,都是很强的氧化剂。
(2)理解??2?2强氧化性的两个角度
(1)Na2O2既有氧化性又有还原性,但主要表现为氧化性。当遇到KMnO4等强氧化剂时,可表现出还原性,氧化产物为O2;
(2)Na2O2遇到CO2、H2O、H+发生自身氧化还原反应。Na2O2既是氧化剂又是还原剂,且1 ml Na2O2转移的电子是1 ml而不是2 ml。
(4)Na2O2与H2O、CO2的反应规律
(1)物理性质:NaOH的俗名为____碱、___碱或_____钠;它是一种____固体,易溶于水并____大量的热,有吸___性;吸收空气中的水分而_____;有很强的______性。
①具有____的通性:能使酸碱指示剂变色;与强酸反应;与酸性氧化物、两性氧化物反应;与盐反应(强碱制弱碱)。
②其他反应与金属铝反应:_______________________________________与非金属单质反应:______________________________酯类水解:__________________________________________________________
①实验室(土法)制烧碱:_____________________________________
②现代工业制碱:____________________________________
(4)NaOH在有机反应中的应用提供______环境,如卤代烃的水解和消去反应、酯类的水解和油脂的皂化等。
A.保存NaOH溶液用带橡胶塞的试剂瓶
NaOH+SiO2→Na2SiO3(具有粘性)
2??+2?2?+CuSO4=??(OH)2↓+??2SO4+?2↑
?????+CO2→O2
知识点1 Na2CO3、NaHCO3的性质、用途及制法
1.Na2CO3、NaHCO3的物理性质
2.Na2CO3、NaHCO3的化学性质
CO32-+2H+ = CO2↑+H2O
HCO3-+H+ = CO2↑+H2O
(1)碳酸钠:用于造纸、制造______、制皂、洗涤等。
(2)碳酸氢钠:用于制________、医药、治疗______过多、灭火剂等。
①原料食盐、氨气、二氧化碳——合成氨厂用水煤气制取氢气时的废气其反应为_____________________,________________________。
4.??2CO3的制备—侯氏制碱法
④循环使用的物质:_____、饱和食盐水。
知识点2 ??2??3和NaHCO3的鉴别与除杂
知识点3 ??2??3 、NaHCO3与盐酸反应的基本图象
CO32-+H+ = HCO3-
Na2CO3和NaOH
知识点3 Na2CO3 、NaHCO3与盐酸反应的基本图象
Na2CO3和NaHCO3
知识点3 Na2CO3 、NaHCO3与盐酸反应的基本图象
知识点4 金属钠露置在空气中发生的一系列变化
Al3(OH)3CO3
B.①中沉淀可能是氢氧化铝和碱式碳酸铝中的一种或二者的混合物
下列说法不正确的是( )
知识点1 碱金属的一般性与特殊性
1.焰色试验的概念很多金属或它们的化合物在灼烧时都会使火焰呈现特殊颜色,可以判断试样所含的金属元素,化学上把这样的______________称为焰色试验,属于物理变化,是元素的性质。
钠元素:____色;钾元素:____色(透过____色钴玻璃观察);铜元素____色;钡元素:______色;钙元素:______色。
(2)用稀盐酸清洗的原因:生成金属氯化物,而金属氯化物在高温时可挥发,而硫酸盐难挥发。
(4)灼烧铂丝时应一直烧至火焰恢复到原来的颜色。
(3)焰色反应中所用的火焰应是无色或浅色的。
(5)可用洁净无锈的铁丝代替铂丝,不能用铜丝代替。
【变式训练1】(23-24高三上·北京朝阳·期中)金属钾可以与水(滴加酚酞溶液)剧烈反应,下列说法不正确的是( )
A.溶液变红,证明生成了碱性物质B.钾浮在液面上并燃烧,与其密度及反应的热效应有关C.钾与水反应比钠与水反应更剧烈,说明钾的金属性比钠强D.金属钾与水发生反应前后化学键类型不变
【例2】(23-24高三上·浙江·期中)绚丽的焰火其实就包含化学知识“焰色试验”的应用。下列说法中正确的是( )
下列叙述中不正确的是( )
A.每次实验中都要先将铂丝灼烧至与原来火焰颜色相同为止,再蘸取被检验的物质B.钾的焰色反应要透过蓝色钴玻璃观察C.实验时最好选择本身颜色较深的火焰D.没有铂丝可用光洁无锈铁丝代替
A.黄色 B.紫色 C.绿色 D.洋红色
【解析】钾的焰色为紫色火焰,所以B正确;故答案选B。
A.过氧化钠和硫黄:加水,振荡 B.水晶和玻璃:X射线衍射实验C.氯化钠和氯化钾:焰色试验 D.苯和甲苯:滴加溴水,振荡
A.浓硝酸保存在棕色试剂瓶中B.氢氧化钠溶液保存在带磨口玻璃塞的细口瓶中C.高锰酸钾和乙醇不能同时保存在同一药品柜中D.金属钠保存在煤油中
新教材(广西专版)高考化学一轮复习第3章金属及其化合物第1讲钠及其重要化合物课件: 这是一份新教材(广西专版)高考化学一轮复习第3章金属及其化合物第1讲钠及其重要化合物课件,共60页。PPT课件主要包含了内容索引,强基础增分策略,增素能精准突破,研专项前沿命题,明考向真题演练,本章体系构建,课程标准,2钠与水的反应,溶液变浑浊,红色褪去等内容,欢迎下载使用。
第08讲 钠及其重要化合物(课件)-2024年高考化学一轮复习(新教材新高考): 这是一份第08讲 钠及其重要化合物(课件)-2024年高考化学一轮复习(新教材新高考),共60页。PPT课件主要包含了内容索引,考情分析,网络构建,PARTONE,PARTON等内容,欢迎下载使用。
第10讲 铁及其重要化合物(课件)-2024年高考化学一轮复习讲练测(新教材新高考): 这是一份第10讲 铁及其重要化合物(课件)-2024年高考化学一轮复习讲练测(新教材新高考),共60页。PPT课件主要包含了复习目标,网络构建,知识梳理题型归纳,真题感悟,内容索引,考情分析,PARTONE等内容,欢迎下载使用。












