


福建省宁德市柘荣县第一中学2024-2025学年高三上学期8月第一次月考化学试题
展开(考试时间75分钟,试卷总分100分)
注意事项:
1.本科考试分试题卷和答题卷,考生须在答题卷指定位置上作答,答题前,请在答题卷的密封线内填写学校、班级、考号、姓名。
2.本试卷分为第I卷(选择题)和第II卷(非选择题)两部分。全卷满分100分,考试时间75分钟。
可能用到的相对原子质量:H-1 Li-7 C-12 N-14 O-16 Na-23 Cr-52 Zn-65
第I卷(选择题 共40分)
一、选择题:本题共10小题,每小题4分,共40分,在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 化学科学与社会活动密切相关,下列叙述错误的是
A. 为保证食物的口感与风味,应增加食品添加剂使用品种与数量
B. 我国自主研发的某飞机机身材料使用的碳纤维和环氧树脂属于复合材料
C. 纤维素与乙酸反应生成纤维素乙酸酯属于酯化反应
D. 的VSEPR模型:[]2-
【答案】A
【解析】
【详解】A.食品添加剂使用品种与数量都有严格的使用标准,不能随意增加,故A错误;
B.碳纤维和环氧树脂属于复合材料,碳纤维属于无机非金属材料,环氧树脂属于有机高分子材料,故B正确;
C.纤维素的每个葡萄糖单元中含3个羟基,纤维素与乙酸发生酯化反应生成纤维素乙酸酯,故C正确;
D.的中心原子价电子对数为,有一对孤电子对,故其VSEPR模型为四面体形,[]2-,故D正确;
故答案选A
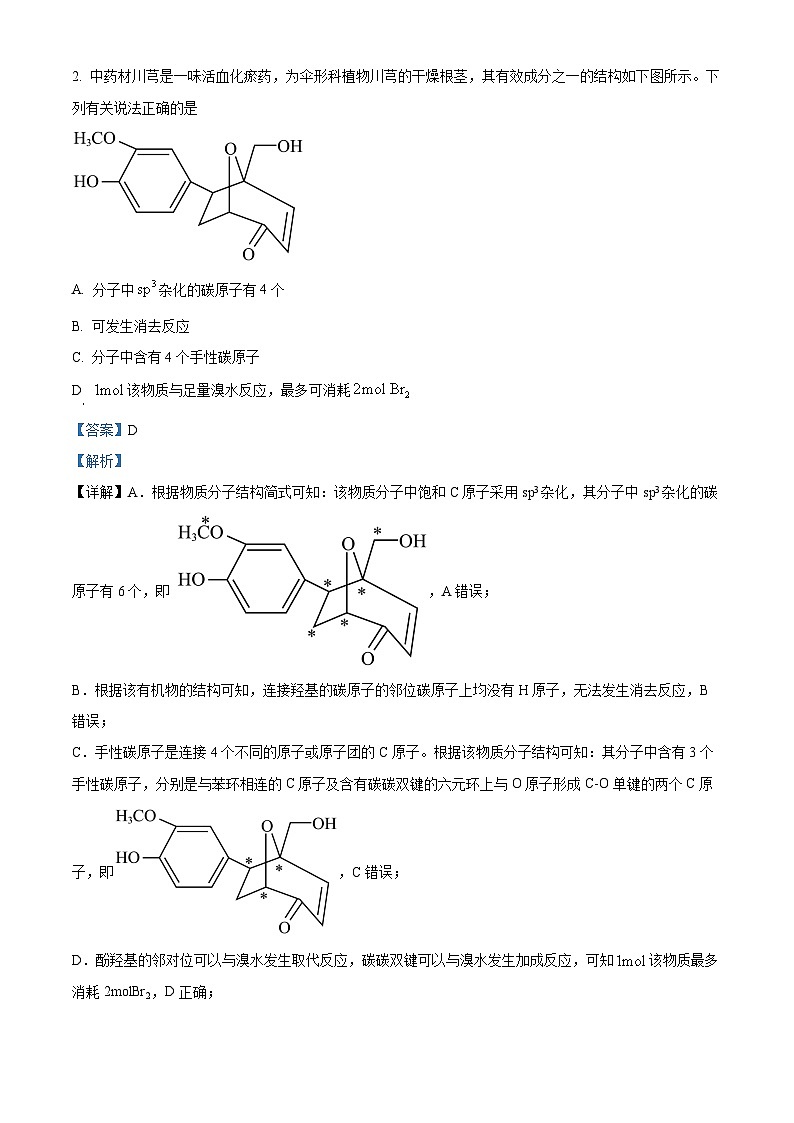
2. 中药材川芎是一味活血化瘀药,为伞形科植物川芎的干燥根茎,其有效成分之一的结构如下图所示。下列有关说法正确的是
A. 分子中杂化的碳原子有4个
B. 可发生消去反应
C. 分子中含有4个手性碳原子
D 该物质与足量溴水反应,最多可消耗
【答案】D
【解析】
【详解】A.根据物质分子结构简式可知:该物质分子中饱和C原子采用sp3杂化,其分子中sp3杂化的碳原子有6个,即 ,A错误;
B.根据该有机物的结构可知,连接羟基的碳原子的邻位碳原子上均没有H原子,无法发生消去反应,B错误;
C.手性碳原子是连接4个不同的原子或原子团的C原子。根据该物质分子结构可知:其分子中含有3个手性碳原子,分别是与苯环相连的C原子及含有碳碳双键的六元环上与O原子形成C-O单键的两个C原子,即,C错误;
D.酚羟基的邻对位可以与溴水发生取代反应,碳碳双键可以与溴水发生加成反应,可知该物质最多消耗2mlBr2,D正确;
故答案选D。
3. 设为阿伏加德罗常数的值。下列说法正确的是( )
A.1L0.1ml/L的溶液中含有的数目为
B.1ml完全溶于水,所得溶液中含氮微粒数为
C.1ml中σ键的数目为
D.标准状况下,22.4LHCl分子中含有的数目为
【答案】B
【解析】【解答】A、HClO是一种弱酸,在水中部分电离,因此溶液中ClO-的个数小于1 NA,B不符合题意。
B、1mlNH4NO3中含有2mlN原子,溶于水的过程中,氮元素守恒,因此溶液中含氮微粒数为2NA,A符合题意。
C、1ml[Cu(H2O)4]2+中含有4ml共价键,4mlH2O。一个H2O分子中含有2个σ键。因此1ml[Cu(H2O)4]2+中所含的σ键个数为12 NA,C不符合题意。
D、HCl分子中不含有Cl-,D不符合题意。
故答案为:B
【分析】A、根据氮原子守恒分析。
B、HClO是一种弱酸,在水中部分电离。
C、一个H2O分子中含有2个σ键,一个配位键为一个σ键。
D、HCl分子中不含有Cl-。
4. 下列解释事实的方程式不正确的是
A. 向中投入固体:
B. 用浓氨水检验泄漏的氯气
C. 向沉淀中加入过量氨水使溶解:
D. 苯酚和甲醛在一定条件下反应能生成酚醛树脂:
【答案】A
【解析】
【详解】A.Na2O2与水反应时,Na2O2既是氧化剂又是还原剂,水既不是氧化剂也不是还原剂,向H218O中投入Na2O2的离子方程式为:,A项错误;
B.用浓氨水检验泄漏的氯气,氨气与氯气生成氯化铵固体,产生白烟:8NH3+3Cl2=6NH4Cl+N2,B项正确;
C.向AgCl沉淀中加入过量氨水使AgCl溶解生成银氨络离子,反应的离子方程式为:,C项正确;
D.苯酚和甲醛在一定条件下反应生成酚醛树脂的化学方程式为n+nHCHO+(n-1)H2O,D项正确;
故答案选A。
5.X、Y、Z、M、Q为前20号主族元素,其原子序数依次增大。X的核外电子数等于其周期数,X2Y是最常用的溶剂,Z的最外层电子数是Y电子总数的一半,Q为前四周期金属性最强的元素。下列说法一定正确的是
A.气态氢化物的稳定性:B.M单质常温下为固体
C.ZY2与Q2Y的化学键类型相同D.简单离子半径:
【答案】D
【详解】
X、Y、Z、M、Q为前20号主族元素,其原子序数依次增大。X的核外电子数等于其周期数,则X为H,X2Y是最常用的溶剂水,则Y为O,Z的最外层电子数是Y电子总数的一半,则Z为Si,Q为前四周期金属性最强的元素,则Q为K,据此M为P、S、Cl, 则X=H,Y=O,Z=Si,M=P、S、Cl,Q=K。
A.Si的非金属性小于P、S、Cl,SiH4的稳定性小于PH3、H2S、HCl,A错误;
B.M的单质是P、S或Cl2,其中Cl2常温下为气体,B错误;
C.ZY2为SiO2含共价键,Q2Y为K2O含离子键,二者化学键类型不同,C错误;
D.P3-、S2-、Cl-与K+具有相同的电子层结构,随核电荷数增大,离子半径减小,D正确;
答案选D。
6. 下列实验方案能达到实验目的的是
A. 甲装置可制取B. 乙装置可验证金属性:
C. 丙装置可检验乙醇消去产物中的乙烯D. 丁装置可探究压强对平衡的影响
【答案】B
【解析】
【详解】A.NH3在水中的溶解度大而CO2在水中的溶解度小,实验过程中为保证CO2被充分吸收,应先通NH3一段时间后再通CO2,故A错误;
B.该装置构成原电池,若铁钉两端溶液变红,没有蓝色沉淀生成,说明铁钉没有被腐蚀,说明锌为负极,铁为正极,金属性:,故B正确;
C.乙醇易挥发,所以生成的乙烯中含有乙醇,乙烯中还含有SO2,乙醇、SO2能使酸性高锰酸钾溶液褪色,干扰乙烯和酸性高锰酸钾溶液的反应,所以不能实现实验目的,故C错误;
D.氢气与碘蒸气反应前后气体分子数不变,压强对平衡无影响,故不能探究压强对平衡移动的影响,故D错误;
故答案选B。
7. 下列各组离子在给定溶液中一定能大量共存的是( )
A.在氨水中:、、、
B.在氯化钠溶液中:、、、
C.在醋酸钠溶液中:、、、
D.25℃时,由水电离出的的溶液中:、、、
7【答案】C
【解析】【解答】A.氨水显碱性,会与、反应生成沉淀,不能大量共存,A不符合题意;
B.氯化钠溶液中,、会发生完全双水解生成氢氧化铁沉淀和二氧化碳气体,且会反应生成亚铁离子和碘单质,不能大量共存,B不符合题意;
C.在醋酸钠溶液中、、、不存在任何反应,可以大量共存,C符合题意;
D.25℃时,由水电离出的的酸性溶液,不能大量存在,D不符合题意;
故答案为:C。
【分析】思路分析:判断离子共存方法,1.看溶液中离子之间因发生复分解反应生成沉淀、气体和弱电解质而不能共存;2看离子之间因发生氧化还原反应而不能共存,3.注意题目隐含条件,颜色、pH.
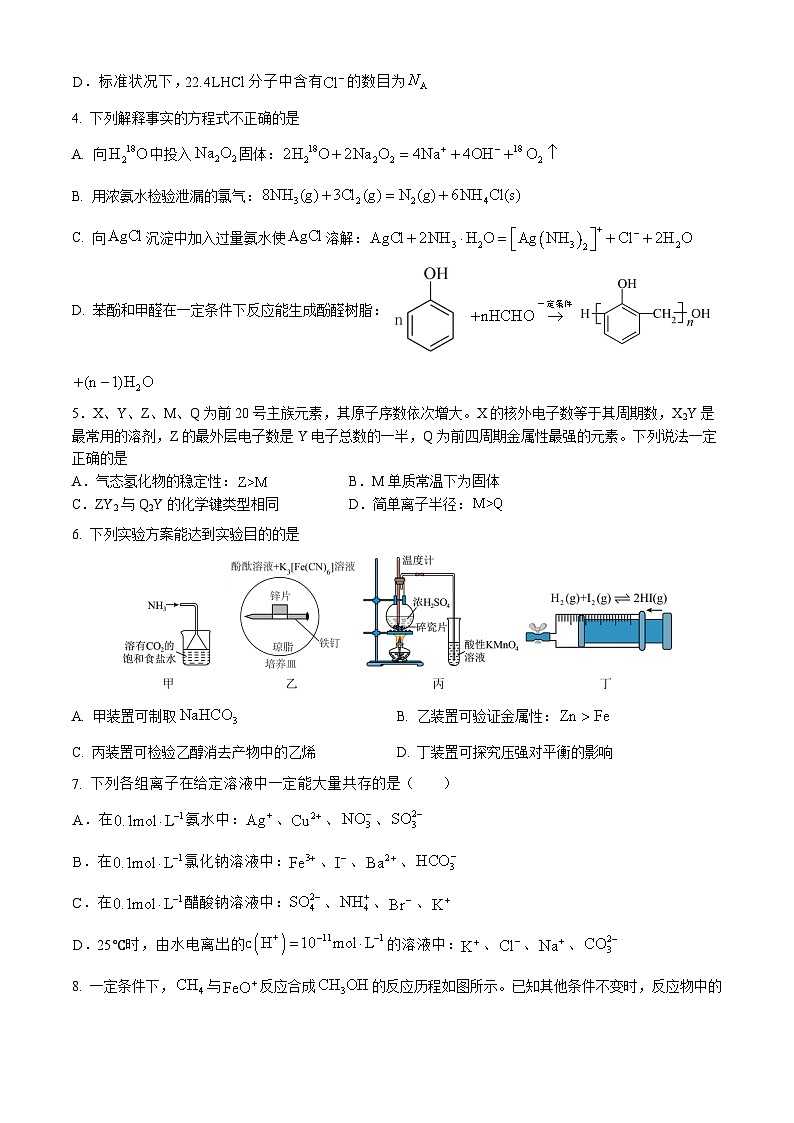
8. 一定条件下,与反应合成的反应历程如图所示。已知其他条件不变时,反应物中的元素被质量数更大的同位素替换时,反应速率会变慢。说明:过渡态中“- -”表示化学键未完全断裂或形成。下列说法正确的是
A. 反应历程中的两个反应均涉及氢原子的成键
B. 相同条件下,与发生上述反应,则其过渡态的能量比低
C. 该反应的
D. 与发生上述反应,只能获得1种相对分子质量的有机产物
【答案】C
【解析】
【详解】A.根据图知,反应历程中的第一个反应涉及氢原子的成键,第二个反应没涉及氢原子的成键,A错误;
B.已知其他条件不变时,反应物中的元素被质量数更大的同位素替换时,反应速率会变慢,所以相同条件下,与发生上述反应,反应速率会变慢,则其过渡态Ⅰ的能量比b高,B错误;
C.该反应的,即生成物的总能量减去反应物的总能量,C正确;
D.根据图可知,与发生上述反应,可以获得、2种相对分子质量相等的有机产物,D错误;
故选C
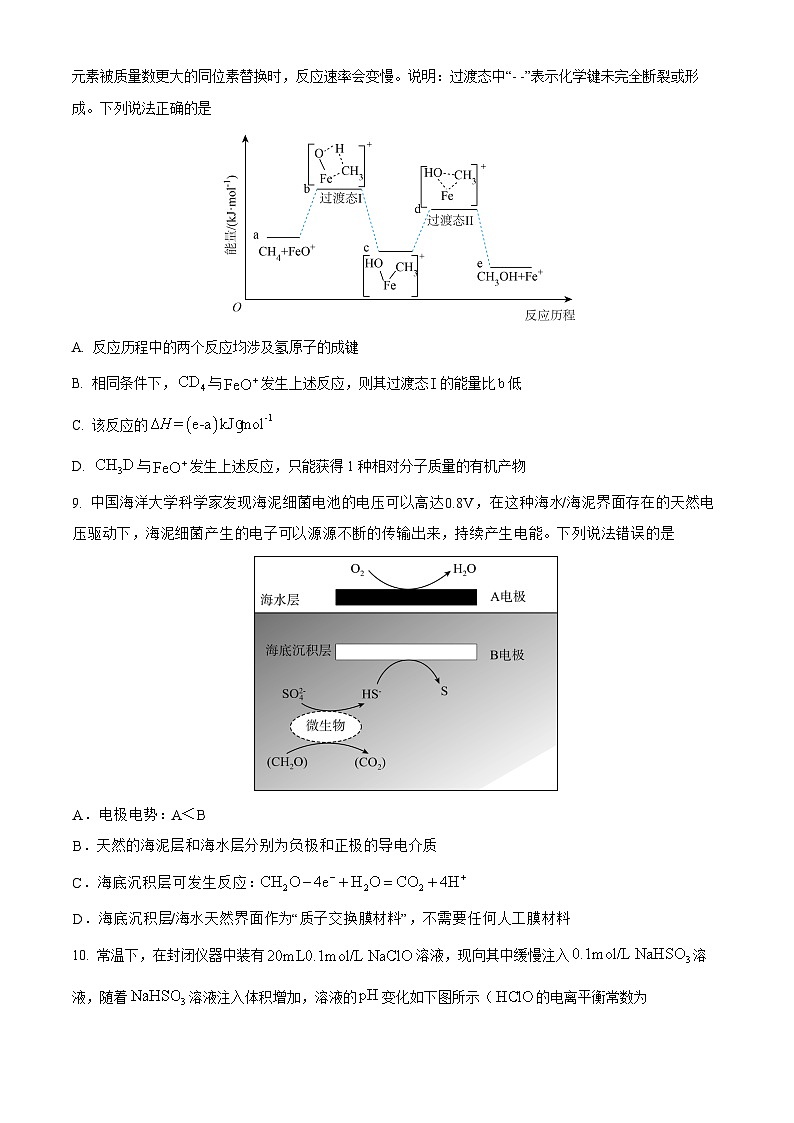
9. 中国海洋大学科学家发现海泥细菌电池的电压可以高达0.8V,在这种海水/海泥界面存在的天然电压驱动下,海泥细菌产生的电子可以源源不断的传输出来,持续产生电能。下列说法错误的是
A.电极电势:A<B
B.天然的海泥层和海水层分别为负极和正极的导电介质
C.海底沉积层可发生反应:
D.海底沉积层/海水天然界面作为“质子交换膜材料”,不需要任何人工膜材料
【答案】A
10. 常温下,在封闭仪器中装有溶液,现向其中缓慢注入溶液,随着溶液注入体积增加,溶液的变化如下图所示(的电离平衡常数为),关于上述实验,下列分析错误的是
A. AB段主要发生的反应为
B. BC段值降低主要是因为生成强酸
C. 水电离程度
D. 时,溶液中离子浓度大小顺序为
【答案】D
【解析】
【分析】由图可知,亚硫酸氢钠溶液体积为10mL时,溶液中发生的反应为2NaClO+NaHSO3= NaCl+HClO+Na2SO4,反应得到等浓度的氯化钠、次氯酸和硫酸钠混合溶液;亚硫酸氢钠溶液体积为20mL时,溶液中发生的反应为HClO+NaHSO3=NaCl+H2SO4,反应得到氯化钠、硫酸钠和硫酸的混合溶液;亚硫酸氢钠溶液体积为40mL时,溶液中发生的反应为H2SO4+2NaHSO3=Na2SO4+2H2SO3,反应得到氯化钠、硫酸钠和亚硫酸的混合溶液。
【详解】A.由分析可知,AB段主要发生的反应为2NaClO+NaHSO3= NaCl+HClO+Na2SO4,反应的离子方程式为,故A正确;
B.由分析可知,BC段主要发生的反应为HClO+NaHSO3=NaCl+H2SO4,则溶液pH值降低主要是因为生成了完全电离的硫酸,故B正确;
C.由分析可知,A点为次氯酸钠溶液,次氯酸根离子水解促进水的电离,B点为等浓度的氯化钠、次氯酸和硫酸钠混合溶液,次氯酸在溶液中电离出的氢离子抑制水的电离,C点为氯化钠、硫酸钠和硫酸的混合溶液,硫酸在溶液中电离出的氢离子抑制水的电离,D点为氯化钠、硫酸钠和亚硫酸的混合溶液,亚硫酸在溶液中电离出的氢离子抑制水的电离,酸溶液中氢离子浓度越大,抑制水的电离程度越大,则水电离程度大小顺序为A>B>D>C,故C正确;
D.由得失电子数目守恒可知,次氯酸钠溶液与亚硫酸氢钠溶液反应生成氯离子的物质的量与硫酸根离子的物质的量相等,则溶液pH为7时,溶液中氯离子浓度大于硫酸根离子浓度,故D错误;
故选D。
第II卷(非选择题 共60分)
二、填空题,本题共4小题,共60分。
11.某实验小组同学探究银氨溶液的配制及银氨溶液的性质。
(一)探究银氨溶液的制备(实验中所用氨水均为新制氨水)
已知:白色AgOH沉淀不稳定,极易分解生成棕褐色Ag2O;Ag2O溶于浓氨水生成[Ag(NH3)2]+。
(1)实验Ⅰ中沉淀消失的化学方程式为______________________________________________。
(2)实验测得Ⅱ中所用的氨水比Ⅰ中所用氨水的pH小,可能原因有_____________________
______________________________________________________________________________。
(3)推测Ⅱ得到的白色略暗沉淀除Ag2O外的主要成分是________。
(二)该实验小组同学设计如下实验:
实验1:向2 mL银氨溶液中滴加5滴10%NaOH溶液,立即产生棕黑色浑浊;置于沸水浴中加热,有气体产生;一段时间后溶液逐渐变黑,最终试管壁附着光亮银镜。
实验2:向2 mL银氨溶液中滴加5滴10%氨水,置于沸水浴中加热,有气体产生;一段时间后溶液无明显变化。
(4)检验实验1产生的气体含有NH3的方法是________________________;经检验黑色物质中有Ag2O,产生Ag2O的原因是____________________________________________(用离子方程式表示)。
(5)该实验小组同学设计上述实验的目的是_________________________________________。
(6)清洗银镜反应后试管壁上的Ag所用的试剂是________。
【答案】 (1)Ag2O+4NH3·H2O===2[Ag(NH3)2]OH+3H2O
(2)吸收CO2、NH3的挥发
(3)Ag2CO3
(4)用湿润的红色石蕊试纸检验,试纸变蓝(或用玻璃棒蘸浓盐酸或者浓硝酸靠近,产生白烟) 2[Ag(NH3)2]++2OH-eq \(=====,\s\up7(△))Ag2O↓+4NH3↑+H2O
(5)探究向银氨溶液中滴加强碱后,沸水浴加热有银镜出现;滴加弱碱则不能
(6)稀硝酸
【解析】 充分利用提供的信息解题。做对比实验时,必须进行单因子变量控制。
(1)据信息:实验Ⅰ中硝酸银和氨水反应生成的白色沉淀AgOH不稳定,极易分解生成棕褐色Ag2O;Ag2O溶于浓氨水生成[Ag(NH3)2]+。沉淀消失的化学方程式为Ag2O+4NH3·H2O===2[Ag(NH3)2]OH+3H2O。
(2)氨水易挥发、一水合氨是可溶性碱,实验测得Ⅱ中所用的氨水比Ⅰ中所用氨水的pH小,可能原因有吸收CO2、NH3的挥发。
(3)经敞口放置空气中48小时后,氨水吸收二氧化碳产生的碳酸根离子与银离子产生沉淀,则推测Ⅱ得到的白色略暗沉淀除Ag2O外的主要成分是Ag2CO3。
(4)氨气是碱性气体,检验实验1产生的气体含有NH3的方法是用湿润的红色石蕊试纸检验,试纸变蓝(或用玻璃棒蘸浓盐酸或者浓硝酸靠近,产生白烟);经检验黑色物质中有Ag2O,产生Ag2O的原因是加热条件下,[Ag(NH3)2]+与OH-反应生成Ag2O沉淀,离子方程式为2[Ag(NH3)2]++2OH-eq \(=====,\s\up7(△))Ag2O↓+4NH3↑+H2O。
(5)这一组对比实验中,唯一的变量是所加碱的碱性强弱不同,实验1加强碱,结果产生银镜,实验2加弱碱,结果没有银镜产生,则该实验小组同学设计上述实验的目的是探究向银氨溶液中滴加强碱后,沸水浴加热有银镜出现;滴加弱碱则不能。
(6)银可与稀硝酸反应而溶解,清洗银镜反应后试管壁上的Ag所用的试剂是稀硝酸。
12.(14分)利用水钴矿(主要成分为C2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
已知:①浸出液中含有的阳离子主要有H+、Na+、C2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀I中只含有两种沉淀。
③已知氧化性:C3+>MnO2>ClO>Fe3+
④流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)得到水钴矿的前一步是对粗矿的粉末“焙烧”,该步氧化数据如表所示:
(1)在对流空气中氧化效率高且氧化时间短的原因是_______。
(2)浸出过程中加入Na2SO3作用是_______。
(3)NaClO3在浸出液中发生反应的离子方程式为_______。
(4)加入Na2CO3调pH至5.2,目的是_______;萃取剂层含锰元素,则加入NaF溶液所得沉淀II的主要成分为_______。
(5)操作I包括:向水层加入_______调整pH至2~3,蒸发浓缩_______、过滤、洗涤、减压烘干等过程。
(6)根据表格中的数据计算Ksp[C(OH)2]=_____(假设离子浓度小于等于10-5ml/L视为完全沉淀,已知100.4=2.5)
(7)将草酸钴晶体(CC2O4·2H2O)置于空气中加热,受热过程中 290~320℃温度范围得到剩余的固体物质化学式为C3O4,同时产生CO2,写出该过程的化学方程式_____。
【答案】(1)对流空气能使氧气和反应物充分接触
(2)将C3+、Fe3+还原
(3)
(4) 将铁离子、铝离子完全转化为沉淀物分离除去 MgF2、CaF2
(5) 浓盐酸 冷却结晶
(6)2.5×10-15
(7)
【解析】水钴矿加入盐酸、亚硫酸钠,二氧化硅不反应,得到浸出液中含有阳离子主要有H+、Na+、C2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+;加入NaClO3将亚铁离子转化为铁离子,调节pH除去铁;滤液加入氟化钠除去Mg2+、Ca2+,滤液加入萃取剂萃取出C2+,加入草酸铵处理后得到草酸钴晶体和氯化钴晶体;
(1)在对流空气中氧化效率高且氧化时间短的原因是对流空气能使氧气和反应物充分接触,加快反应速率,提高反应效率;
(2)已知:浸出液中含有的阳离子主要有H+、Na+、C2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;说明矿石中三价钴、三价铁均被Na2SO3还原为二价C2+、Fe2+,故加入Na2SO3作用是将C3+、Fe3+还原;
(3)已知氧化性:C3+>MnO2>ClO>Fe3+;亚铁离子具有还原性,和NaClO3反应转化为铁离子而C2+、Mn2+不反应,以便于后续调节pH除去铁,反应为;
(4)由部分阳离子以氢氧化物形式沉淀时溶液的pH表格可知,加入Na2CO3调pH至5.2,目的是将铁离子、铝离子完全转化为沉淀物分离除去;萃取后萃取剂层含锰元素,且水层中含有C2+,而减少了Mg2+、Ca2+,故加入NaF溶液所得沉淀II的主要成分为MgF2、CaF2。
(5)操作I得到氯化钴晶体,则调节pH应该加入盐酸,然后进行结晶操作,故为:向水层加入浓盐酸调整pH至2~3,蒸发浓缩、冷却结晶、过滤、洗涤、减压烘干等过程。
(6)pH=9.2时C(OH)2完全沉淀,此时pOH=4.8,Ksp[C(OH)2]= =2.5×10-15。
(7)草酸钴晶体(CC2O4·2H2O)置于空气中加热,受热过程中首先失去结晶水生成CC2O4, 290~320℃温度范围得到剩余的固体物质化学式为C3O4同时产生CO2,钴元素、碳元素化合价升高,则空气氧气会参与反应起到氧化剂作用,反应为。
13. (15分)处理、回收利用CO是环境科学研究的热点课题。回答下列问题:
(1)CO用于处理大气污染物N2O的反应为CO(g) + N2O(g)CO2(g) +N2(g)。在Zn*作用下该反应的具体过程如图1所示,反应过程中能量变化情况如图2所示。
总反应: CO(g) + N2O(g) CO2(g) + N2(g) ∆H=______ kJ·ml-1; 该总反应的决速步是反应_____ (填 “①"或“②”),该判断的理由是__________.
(2)已知: CO(g) + N2O(g)CO2(g) + N2(g)的速率方程为v=k·c(N2O), k为速率常数,只与温度有关。为提高反应速率,可采取的措施是_____ (填字母序号)。
A.升温B.恒容时,再充入CO
C.恒压时,再充入N2OD.恒压时,再充入N2
(3)在总压为100kPa的恒容密闭容器中,充入一定量的CO(g)和N2O(g)发生上述反应,在不同条件下达到平衡时,在T1K时N2O的转化率与的变化曲线以及在时N2O的转化率与的变化曲线如图3所示:
①表示N2O的转化率随的变化曲线为____曲线(填“I”或“II”);
②T1_______T2 (填“>”或“<"),该判断的理由是______________
③已知:该反应的标准平衡常数,其中为标准压强 (100kPa),p(CO2)、p(N2)、 p(N2O)和p(CO)为各组分的平衡分压,则T4时,该反应的标准平衡常数=_______ ( 计算结果保留两位有效数字,p分=p总 ×物质的量分数)。
【答案】(1) ① 反应①的活化能是,反应②的活化能是,反应②的活化能更小,故反应①是总反应的决速步
(2)AC
(3) Ⅱ < 曲线I表示的转化率随的变化,由于,则越大,的转化率越大,故 3.4
【解析】(1)由图2可知,总反应为:CO(g) + N2O(g) CO2(g) + N2(g) ∆H = -361.22 kJ·ml-1,反应的决速步骤是由活化能大的步骤决定的,故该总反应的决速步是反应①,判断的理由是反应①的活化能是149.6 kJ·ml-1,反应②的活化能是108.22 kJ·ml-1 ,反应②的活化能更小,故反应①是总反应的决速步。
(2)由速率方程可知,此反应的速率与温度和c( N2O)有关,
A.升温,k增大,速率加快,故A正确;
B.恒容时,再充人CO,c( N2O)不变,速率不变,故B错误;
C.恒压时,再充人N2O ,c( N2O)增大,速率增大,故C正确;
D.恒压时,再充人N2 ,c( N2O)减小,速率减慢,故D错误;
故选AC;
(3)①越大,N2O的转化率越小,故曲线II表示N2O的转化率随的变化。
②曲线I表示的转化率随的变化,由于,则越大,的转化率越大,故。
③由图3曲线1可知,,总压为100kPa,容器恒容,温度为T4时,N2O的转化率为65%,可列出三段式:,利用“三段式”计算法可知,平衡时p(N2O) = 17.5 kPa,p(CO) = 17.5 kPa,p(CO2) =32. 5 kPa,p(N2) =32.5 kPa,。
14.(15分)化合物F是制备某种改善睡眠药物的中间体,其合成路线如下:
回答下列问题:
(1)A中碳原子的杂化方式为 。
(2)写出反应②的化学方程式 。
(3)X的化学名称为_______。(参照B转化为C过程)
(4)反应②、反应③中B、C断开的均为碳基邻位上的碳氢键,原因是_______。
(5)在反应④中,D中官能团_______(填名称,后同)被[(CH3)2CHCH2]2AlH还原,官能团_______被NaIO4氧化,然后发生_______(填反应类型)生成有机物E。
(6)F的同分异构体中符合下列条件的有_______种;
①苯环上有两个取代基,F原子直接与苯环相连
②可以水解,产物之一为CH≡C-COOH
其中含有甲基,且核磁共振氢谱谱图中吸收峰最少的是:_______。
【答案】(1)sp2、sp3
(2)+CH3I+HI
(3)3-碘-1-丙烯(3-碘丙烯)
(4)B、C中碳基邻位碳上的氢受羰基吸电子作用的影响,C-H极性增强,具有一定的活泼性
(5) 酯基 碳碳双键 取代(酯化)反应
(6) 6种
【分析】A与CH3OH在浓硫酸存在条件下加热,发生酯化反应产生B:,B与CH3I在有机强碱作用下发生取代反应产生C: ,根据有机物D结构简式与C的区别,结合②反应的特点,可知X是CH2=CH-CH2I,C与CH2=CH-CH2I发生取代反应产生D,D与[(CH3)2CHCH2]2AlH及NaIO4/Ru催化剂条件下反应产生E,E与Pd配合物及碱反应产生F。
【详解】(1)根据A分子结构简式可知该物质分子中含有饱和C原子,采用sp3杂化,苯环及-COOH的C原子采用sp2杂化;(2)反应②是与CH3I在有机强碱作用下发生取代反应产生C:和HI,该反应的化学方程式为:+CH3I+HI;(3)根据C、D结构简式的不同,结合②的化学反应可知X化学式是CH2=CH-CH2I,其名称是3-碘-1-丙烯(3-碘丙烯);(4)反应②、反应③中B、C断开的均为碳基邻位上的碳氢键,这是由于B、C中碳基邻位碳上的氢受羰基吸电子作用的影响,C-H极性增强,具有一定的活泼性;(5)对比D、E的结构可知,D→E的过程中,酯基—COOCH3被还原转化为- CH2OH;—CH2CH=CH2被氧化转化为—CH2COOH,再发生酯化反应形成环,故D→E的过程中,被还原的官能团是酯基,被氧化的官能团是碳碳双键,发生的反应类型是酯化反应;(6)F分子式是C11H9O2F,其同分异构体满足条件:①苯环上有两个取代基,F原子直接与苯环相连;②可以水解,产物之一为CH≡C-COOH,则F为酯,含有酯基,该取代基可能是CH≡C-COOCH2-CH2-、共2种不同结构,该取代基与-F在苯环上的位置有邻、间、对3种,因此符合要求的同分异构体种类数目是2×3=6种;其中含有甲基,且核磁共振氢谱谱图中吸收峰最少的是。
15.(10分)某家公司研发出一种比锂电池成本更低、寿命更长、充电速度更快的钠离子电池,该电池的负极材料为Na2C2TeO6(制备原料为Na2CO3、C3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。回答下列问题:
(1)C、O、Cl三种元素电负性由大到小的顺序为______________________________。
(2)基态Na原子中,核外电子占据的原子轨道总数为________,Te属于元素周期表中________区,其基态原子的价层电子排布式为_______________________________________。
(3)COeq \\al(2-,3)的空间结构为________________,碳酸丙烯酯的结构如图所示,其中碳原子的杂化轨道类型为______,1 ml碳酸丙烯酯中σ键的数目为________。
(4)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为________,该晶胞的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为________ cm(用含有ρ、NA的代数式表示)。
【答案】 (1)O>Cl>C(或O、Cl、C) (2)6 p 5s25p4 (3)平面三角形 sp2、sp3 13NA(或13×6.02×1023) (4)8 eq \f(\r(3),4)eq \r(3,\f(248,ρNA))
【解析】 (4)晶胞中灰色球数目为8×eq \f(1,8)+6×eq \f(1,2)=4,黑色球共8个,可知,该离子化合物为Na2O,由晶胞对称性可知O的配位数为8;根据晶胞结构可知Na与O之间的最短距离为体对角线的eq \f(1,4),晶胞体积V=eq \f(62×4,ρNA) cm3,晶胞边长=eq \r(3,V)=eq \r(3,\f(62×4,ρNA)) cm,则Na与O之间的最短距离为eq \f(\r(3),4)eq \r(3,\f(248,ρNA)) cm。
实验装置
实验序号
实验操作
实验现象
1 mL 2%AgNO3溶液
Ⅰ
向试管中滴加2%氨水并不断振荡
产生棕褐色沉淀,继续滴加沉淀消失
Ⅱ
向试管中滴加2%氨水(经敞口放置空气中48小时)1 mL
产生白色略暗沉淀
沉淀物
Fe(OH)3
Fe(OH)2
C(OH)2
Al(OH)3
Mn(OH)2
开始沉淀
2.7
7.6
7.6
4.0
7.7
完全沉淀
3.7
9.6
9.2
5.2
9.8
空气氧化法
氧化温度/℃
氧化率/%
氧化时间/h
暴露空气中
450~500
88
14
对流空气氧化炉中
450~500
98
6
海南省农垦中学2024-2025学年高三上学期第一次月考化学试题: 这是一份海南省农垦中学2024-2025学年高三上学期第一次月考化学试题,共8页。
福建省宁德市福鼎第四中学2024-2025学年高三上学期开学考试化学试题(原卷版): 这是一份福建省宁德市福鼎第四中学2024-2025学年高三上学期开学考试化学试题(原卷版),共6页。试卷主要包含了单选题等内容,欢迎下载使用。
福建省宁德市福鼎第四中学2024-2025学年高三上学期开学考试化学试题(原卷版+解析版): 这是一份福建省宁德市福鼎第四中学2024-2025学年高三上学期开学考试化学试题(原卷版+解析版),文件包含福建省宁德市福鼎第四中学2024-2025学年高三上学期开学考试化学试题原卷版docx、福建省宁德市福鼎第四中学2024-2025学年高三上学期开学考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共20页, 欢迎下载使用。












