


新高考化学二轮复习考点提升讲与练专题03 离子反应方程式与离子共存(专讲)(解析版)
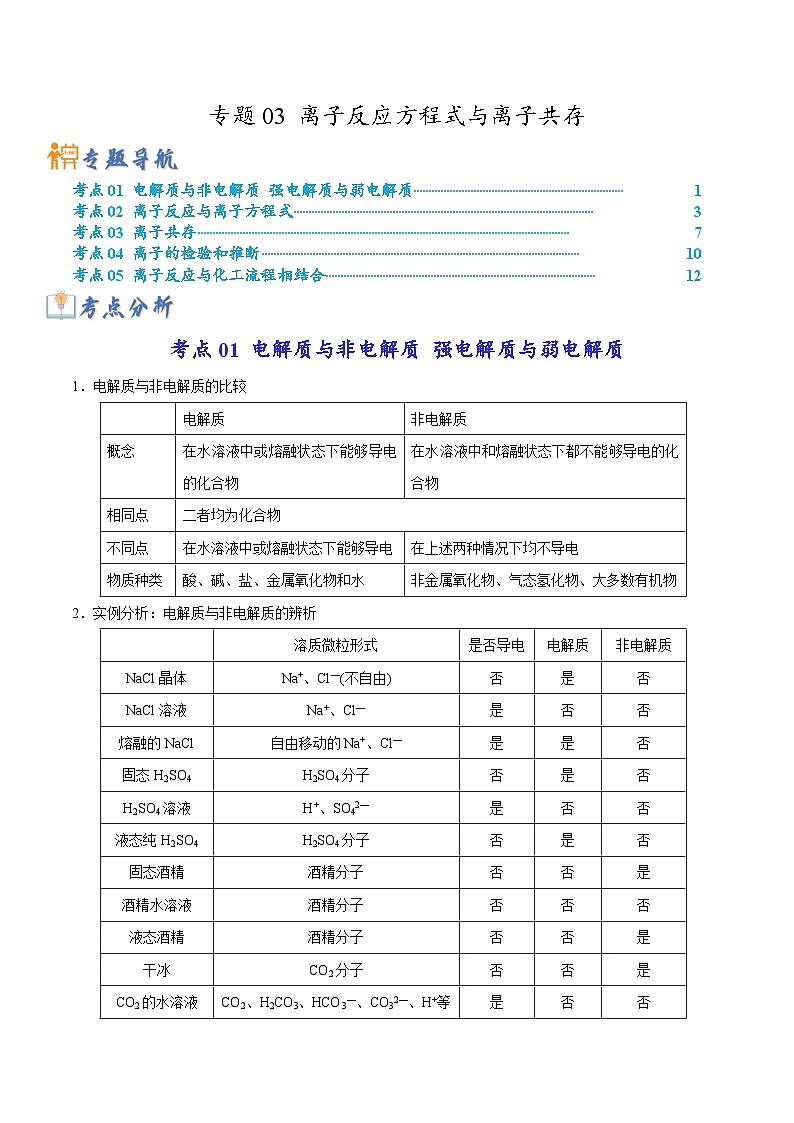
展开考点01 电解质与非电解质 强电解质与弱电解质1
考点02 离子反应与离子方程式3
考点03 离子共存7
考点04 离子的检验和推断10
考点05 离子反应与化工流程相结合12
考点01 电解质与非电解质 强电解质与弱电解质
1.电解质与非电解质的比较
2.实例分析:电解质与非电解质的辨析
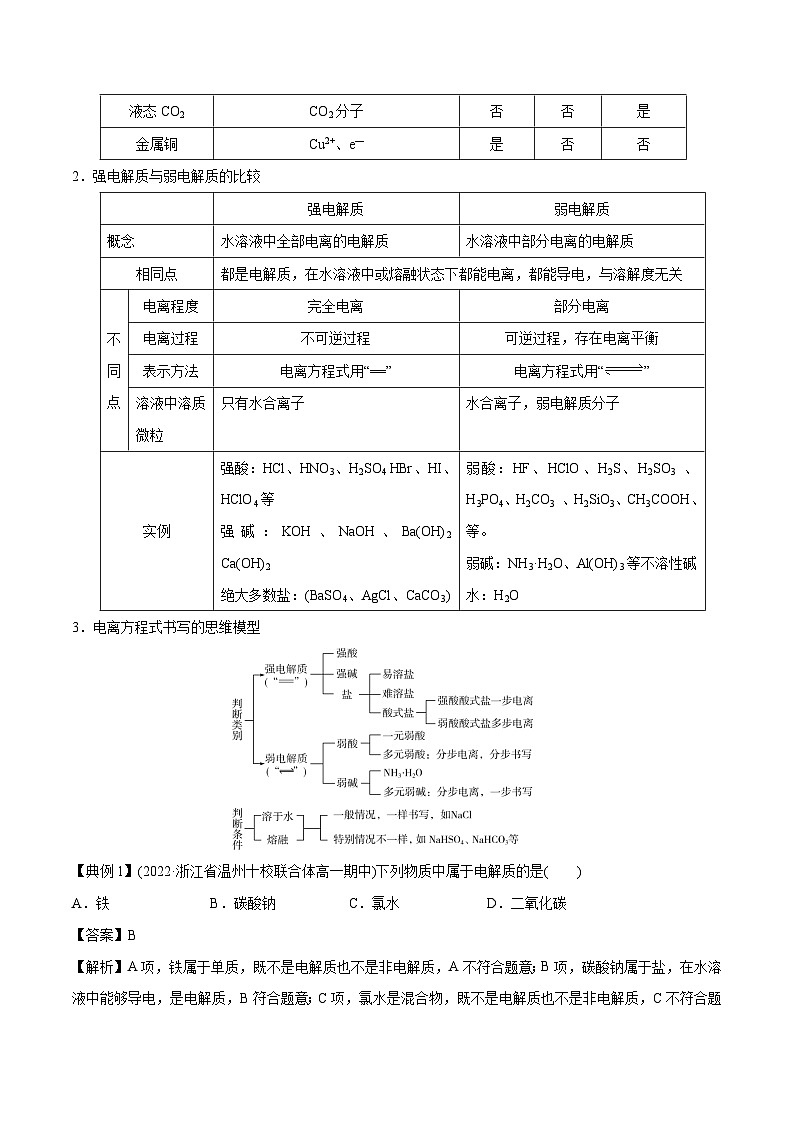
2.强电解质与弱电解质的比较
3.电离方程式书写的思维模型
【典例1】(2022·浙江省温州十校联合体高一期中)下列物质中属于电解质的是( )
A.铁B.碳酸钠C.氯水D.二氧化碳
【答案】B
【解析】A项,铁属于单质,既不是电解质也不是非电解质,A不符合题意;B项,碳酸钠属于盐,在水溶液中能够导电,是电解质,B符合题意;C项,氯水是混合物,既不是电解质也不是非电解质,C不符合题意;D项,CO2在水溶液和熔融状态下均不能导电,属于非电解质,D不符合题意;故选B。
【变式1-1】(2022·浙江省新力量联盟高一期中联考)下列物质的水溶液能导电,但属于非电解质的是( )
A.KClO3B.H2SO4C.CO2D.氯气
【变式1-2】(2022·陕西高一月考)NH4HSO4在水溶液中能电离出NH4+、H+、SO42-。下列对NH4HSO4的分类错误的是( )
A.NH4HSO4是盐B.NH4HSO4是酸
C.NH4HSO4是电解质D.NH4HSO4是化合物
【变式1-3】下列电离方程式中,正确的是( )
A.CaOH2==Ca2++2OH B.FeCl2==Fe3++2Cl
C. H2SO4==H2++SO42- D. Al2SO43==2Al3++3 SO42-
考点02 离子反应与离子方程式
1.离子反应
(1)概念:有离子参加或有离子生成的反应统称为离子反应。
(2)离子反应的条件
①生成难溶的物质;②生成难电离的物质;③生成易挥发的物质;④发生氧化还原反应。
(3)离子反应的本质
离子反应的本质是溶液中某些物质的物质的量的减少。
2.离子方程式
(1)离子方程式:用实际参加反应的离子符号来表示反应的式子。
(2)离子方程式的意义
离子方程式不仅可以表示某一个具体的化学反应,还可以表示同一类型的离子反应。
3.离子方程式书写的基本规律要求
(1)合事实:离子反应要符合客观事实,不可臆造产物及反应。
(2)式正确:化学式与离子符号使用正确合理。
(3)号实际:“===”、“”、“→”、“↑”、“↓”等符号符合实际。
(4)三守恒:两边原子数、电荷数必须守恒、氧化还原反应离子方程式中氧化剂得电子总数与还原剂失电子总数要相等。
(5)明类型:依据离子反应原理,分清类型,总结方法技巧。
(6)检查细:结合书写离子方程式过程中易出现的错误,细心检查。
4.离子方程式的正误判断
一个离子方程式是否正确,关键要看它能否反映溶液中离子反应的真实情况。我们可以从以下几个方面进行判断:
(1)是否以客观事实为依据:如铁与稀盐酸反应就不能写成:2Fe+6H+ = 2Fe3++3H2↑,而应写成:Fe + 2H+ = Fe2+ + H2↑ 。
(2)是否符合质量守恒定律,即式中等号两边各种原子的种类和个数是否相等。如铝与稀盐酸的反应不能写成:Al+3H+ = Al3++H2↑,而应写成:2Al + 6H+ = 2Al3+ + 3H2↑ 。
(3)电荷是否守恒
如硝酸银溶液中加入铜粉的反应不能写成:Ag++Cu==Cu2++Ag,应写成:2Ag++Cu==Cu2++2Ag。
(4)电解质拆分要正确:
如碳酸钡和稀硝酸反应不能写成:CO32-+2H+ = H2O+CO2↑,因为碳酸钡难溶于水要保留它的化学式,这个反应的离子方程式应写成:BaCO3+2H+ = Ba2++H2O+CO2↑ 。
(5)要注意阴阳离子配比:
如稀硫酸与Ba(OH)2溶液反应:H++SO42―+Ba2++OH―==BaSO4↓+H2O,错在SO42―和H+、Ba2+和OH―未遵循1∶2这一组成。应为:2H++SO42―+Ba2++2OH―==BaSO4↓+2H2O。
(6)注意反应中的“量”
有些反应,反应物的相对量不同,生成物也不同,离子方程式也就不同。
如Ca(HCO3)2溶液与NaOH溶液:
若NaOH溶液过量,离子方程式为:Ca2++2HCO3―+2OH―==CaCO3↓+CO32―+2H2O
若Ca(HCO3)2溶液过量,离子方程式为:Ca2++HCO3―+OH―==CaCO3↓+H2O
【典例2】(2022·新课标Ⅲ)对于下列实验,能正确描述其反应的离子方程式是( )
A. 用Na2SO3溶液吸收少量Cl2:
B. 向CaCl2溶液中通入CO2:
C. 向H2O2溶液中滴加少量FeCl3:
D. 同浓度同体积NH4HSO4溶液与NaOH溶液混合:
【答案】A
【解析】用Na2SO3溶液吸收少量的Cl2,Cl2具有强氧化性,可将部分氧化为,同时产生的氢离子与剩余部分结合生成,Cl2被还原为Cl-,反应的离子反应方程式为:3+Cl2+H2O=2+2Cl-+,A正确;向CaCl2溶液中通入CO2,H2CO3是弱酸,HCl是强酸,弱酸不能制强酸,故不发生反应,B错误;向H2O2中滴加少量的FeCl3,Fe3+的氧化性弱于H2O2,不能氧化H2O2,但Fe3+能催化H2O2的分解,正确的离子方程式应为2H2O22H2O+O2↑,C错误;NH4HSO4电离出的H+优先和NaOH溶液反应,同浓度同体积的NH4HSO4溶液与NaOH溶液混合,氢离子和氢氧根恰好完全反应,正确的离子反应方程式应为:H++OHˉ=H2O,D错误。
【变式2-1】(2022·江苏卷)下列指定反应的离子方程式正确的是( )
A. Cl2通入水中制氯水:
B. NO2通入水中制硝酸:
C. NaAlO2溶液中通入过量CO2:
D. AgNO3溶液中加入过量浓氨水:
【变式2-2】(2022·天津卷)下列离子方程式书写正确的是( )
A. CaCO3与稀硝酸反应:
B. FeSO4溶液与溴水反应:
C. NaOH溶液与过量H2C2O4溶液反应:
D. C6H5ONa溶液中通入少量CO2:
【变式2-3】(2022·天津卷)下列离子方程式能用来解释相应实验现象的是( )
【变式2-4】(2022·江苏卷)下列指定反应的离子方程式正确的是( )
A.室温下用稀NaOH溶液吸收Cl2:Cl2+2OH−=ClO−+Cl−+H2O
B.用铝粉和NaOH溶液反应制取少量H2:Al+2OH−=AlO2-+H2↑
C.室温下用稀HNO3溶解铜:Cu+2 NO3-+2H+=Cu2++2NO2↑+H2O
D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
【变式2-5】(2022·浙江选考)不能正确表示下列变化的离子方程式是( )
A.二氧化硫与酸性高锰酸钾溶液反应:5SO2+2H2O+2MnO4-=2Mn2++5SO+4H+
B.酸性碘化钾溶液中滴加适量双氧水:2I−+2H++H2O2=I2+2H2O
C.硅酸钠溶液和盐酸反应:SiO32-+2H+=H2SiO3↓
D.硫酸铜溶液中加少量的铁粉:3Cu2++2Fe=2Fe3++3Cu
考点03 离子共存
1.复分解反应型
(1)生成难溶物或微溶物的离子不能大量共存
(2)生成气体及挥发性物质的离子不能大量共存
(3)生成难电离物质(水、弱酸、一水合氨等)
H+与CH3COO-、COeq \\al(2-,3)、S2-、SOeq \\al(2-,3)、ClO-等生成弱酸不能大量共存;OH-与NHeq \\al(+,4)(稀溶液)生成弱碱不能大量共存;H+与OH-生成水不能大量共存。
2.氧化还原型
具有较强氧化性的离子与具有较强还原性的离子会发生氧化还原反应而不能大量共存。
3.水解相互促进型
当弱酸的酸根与弱碱的阳离子同时存在于水溶液中时,弱酸的酸根水解生成的OH-与弱碱的阳离子水解生成的H+反应生成水,从而使两种离子的水解平衡互相促进而向水解方向移动,甚至完全反应。常见的因发生相互促进的水解反应而不能大量共存的离子如下:
(1)Al3+与COeq \\al(2-,3)、HCOeq \\al(-,3)、S2-、HS-、AlOeq \\al(-,2)、SiOeq \\al(2-,3);
(2)Fe3+与COeq \\al(2-,3)、HCOeq \\al(-,3)、AlOeq \\al(-,2)、SiOeq \\al(2-,3)。
4.络合反应型
离子间因发生络合反应而不能大量共存,常见的反应有如下两种:
(1)Fe3+与SCN-因生成Fe(SCN)3而不能大量共存。
(2)Ag+与NH3·H2O因生成[Ag(NH3)2]+而不能大量共存。
【典例3】(2022·江苏卷)常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 氨水溶液:Na+、K+、OH-、NO
B. 盐酸溶液:Na+、K+、SO、SiO
C. KMnO4溶液:NH、Na+、NO、I-
D. AgNO3溶液:NH、Mg2+、Cl-、SO
【答案】A
【解析】在0.1ml/L氨水中,四种离子可以大量共存,A选;在0.1ml/L盐酸中含有大量氢离子,四种离子中硅酸根可以与氢离子反应生成硅酸沉淀,故不能共存,B不选;MnO4-具有强氧化性,可以将碘离子氧化成碘单质,故不能共存,C不选;在0.1ml/L硝酸银溶液中,银离子可以与氯离子、硫酸根离子反应生成氯化银、硫酸银沉淀,不能共存,D不选;故选A。
【变式3-1】(2022·江苏卷)室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 ml·L-1 NaOH溶液:Na+、K+、COeq \\al(2-,3)、AlOeq \\al(-,2)
B.0.1 ml·L-1 FeCl2溶液:K+、Mg2+、SOeq \\al(2-,4)、MnOeq \\al(-,4)
C.0.1 ml·L-1 K2CO3溶液:Na+、Ba2+、Cl-、OH-
D.0.1 ml·L-1 H2SO4溶液:K+、NHeq \\al(+,4)、NOeq \\al(-,3)、HSOeq \\al(-,3)
【变式3-2】(2022·江苏卷)室温下,下列各组离子在指定溶液中能大量共存的是 ( )
A.0.1 ml·L-1 KI溶液:Na+、K+、ClO-、OH-
B.0.1 ml·L-1 Fe2(SO4)3溶液:Cu2+、NHeq \\al(+,4)、NOeq \\al(-,3)、SOeq \\al(2-,4)
C.0.1 ml·L-1 HCl溶液:Ba2+、K+、CH3COO-、NOeq \\al(-,3)
D.0.1 ml·L-1 NaOH溶液:Mg2+、Na+、SOeq \\al(2-,4)、HCOeq \\al(-,3)
【变式3-3】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:Fe3+、Mg2+、SCN-、Cl-
B.eq \f(c(H+),c(OH-))=1×10-12的溶液中:K+、Na+、COeq \\al(2-,3)、NOeq \\al(-,3)
C.c(Fe2+)=1 ml·L-1的溶液中:K+、NHeq \\al(+,4)、MnOeq \\al(-,4)、SOeq \\al(2-,4)
D.能使甲基橙变红的溶液中:Na+、NHeq \\al(+,4)、SOeq \\al(2-,4)、HCOeq \\al(-,3)
【变式3-4】(2022·江西省七校高三联考)室温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.0.1 ml·L-1 KI溶液:Na+、K+、ClO-、OH-
B.使甲基橙呈黄色的溶液:NH4+、Ba2+、Cl-、NO3-
C.0.1 ml·L-1 Fe2(SO4)3溶液:Cu2+、NH4+、NO3-、SO42-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、SO42-
【变式3-5】下列离子或分子在指定的分散系中一定能够大量共存的是( )
A.c(H+)=10-13 ml/L的溶液中:NOeq \\al(-,3)、SOeq \\al(2-,4)、K+、Na+
B.含Fe3+的溶液中:Na+、K+、CH3COO-、HCOeq \\al(-,3)
C.铁与过量稀硫酸反应后的溶液中:AlOeq \\al(-,2)、NHeq \\al(+,4)、Cl-、NOeq \\al(-,3)
D.空气中:SO2、NO、N2、NH3
考点04 离子的检验和推断
1.常见阳离子的检验
2.常见阴离子的检验
【典例4】某绿色溶液A含有H+、Na+、Mg2+、Fe2+、Cu2+、SOeq \\al(2-,4)、Cl-、COeq \\al(2-,3)和HCOeq \\al(-,3)离子中的若干种,取该溶液进行如下实验(已知Ag2SO4微溶于水,可溶于酸):
①向溶液中滴加Ba(OH)2溶液,过滤,得到不溶于酸的白色沉淀和绿色滤液B;
②取滤液B,先用HNO3酸化,再滴加0.001 ml·L-1 AgNO3溶液,有白色沉淀生成。
下列说法不正确的是( )
A.溶液A中一定存在H+、SOeq \\al(2-,4)和Cl-
B.溶液A中不存在Mg2+、COeq \\al(2-,3)和HCOeq \\al(-,3),不能确定Na+的存在
C.第②步生成的白色沉淀中只有AgCl,没有Ag2CO3
D.溶液A中存在Fe2+与Cu2+中的一种或两种,且可以用NaOH溶液判断
【答案】B
【解析】根据①得到不溶于酸的白色沉淀,可知原溶液中必然含有SOeq \\al(2-,4),根据绿色滤液仍然存在,可知原溶液必然含有H+,必然不能存在COeq \\al(2-,3)以及HCOeq \\al(-,3);根据②有不溶于硝酸的白色沉淀生成,可知原溶液中必然含有Cl-,沉淀必然为AgCl;但是根据以上信息不能确定溶液绿色是Fe2+还是Cu2+引起的,所以两者都有可能存在;根据以上信息不能确定Na+与Mg2+是否存在,所以B不正确。
【变式4-1】(2022·山东青岛模拟)向四支试管中分别加入少量不同的无色溶液进行如下操作,现象和结论正确的是( )
【变式4-2】(2022·江西赣州模拟)已知某透明澄清的溶液中可能含有NOeq \\al(-,3)、Cl-、SOeq \\al(2-,4)、COeq \\al(2-,3)、NHeq \\al(+,4)、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液的成分,某学习小组做了如下实验:①取该溶液100 mL,加入过量NaOH溶液,加热得到0.02 ml气体,同时产生红褐色沉淀;②将沉淀过滤、洗涤、灼烧,得到1.6 g固体;③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。下列说法正确的是( )
A.不能确定原溶液中是否含有Al3+和K+
B.原溶液中含有的离子只有Cl-、SOeq \\al(2-,4)、NHeq \\al(+,4)、Fe3+
C.原溶液中c(NOeq \\al(-,3))=0.2 ml·L-1,c(Fe3+)=0.2 ml·L-1
D.在原溶液中加入足量的铁粉,所得溶液中阳离子所带正电荷数减少
考点05 离子反应与化工流程相结合
【典例5】立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为________(填标号)。
A.黄色 B.红色 C.紫色 D.绿色
(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:
①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为____________
_________________________________________。
回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为_________________________________________________。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差,其原因是“还原料”表面生成了难溶于水的____________________(填化学式)。
③沉淀器中反应的离子方程式为________________________________________________。
【答案】(1)D (2)①BaSO4+4Ceq \(=======,\s\up10(900~1 200 ℃))BaS+4CO↑ CO+H2O===CO2+H2 ②BaCO3 ③S2-+Ba2++Zn2++SOeq \\al(2-,4)===ZnS·BaSO4↓
【解析】(1)根据常见元素的焰色反应,可知钡元素的焰色为绿色。(2)①由流程图中的原料重晶石和焦炭粉经回转炉、浸出槽后得到净化的BaS溶液,可判断重晶石(BaSO4)与焦炭粉反应生成BaS和有毒气体CO,根据电子守恒法可配平氧化还原反应方程式BaSO4+4Ceq \(=======,\s\up10(900~1 200 ℃))BaS+4CO↑;CO与水蒸气反应得到的清洁能源气体为H2,另一种产物为CO2,则CO与水蒸气反应的化学方程式为CO+H2O===CO2+H2。
②潮湿空气中的CO2和水蒸气跟“还原料”中的硫化钡反应生成的臭鸡蛋气味的气体为H2S,水溶性变差是因为发生了反应BaS+CO2+H2O===H2S+BaCO3↓,由此可知难溶于水的物质为BaCO3。
③硫化钡溶液与硫酸锌反应生成难溶于水的立德粉(ZnS·BaSO4),因此离子反应方程式为S2-+Ba2++Zn2++SOeq \\al(2-,4)===ZnS·BaSO4↓。
【变式5-1】(2022·湖北武汉二中模拟)利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
已知:
①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
(1)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2Oeq \\al(2-,7),写出此反应的离子方程式:_______________________。
(2)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2Oeq \\al(2-,7)转化为________(填微粒的化学式)
(3)写出上述流程中用SO2进行还原时发生反应的离子方程式:______________________________。
【变式5-2】(2022·浙江省诸暨市教育研究中心高三选考模拟)固体化合物X由3种元素组成,某学习小组开展如图探究实验。
请问答:
(1)黄色沉淀H的化学式是___,溶液B中含有的溶质是___。(用化学式表示)
(2)化合物X的化学式是___,化合物X中的某元素在含F-的溶液中可形成正八面体的阴离子,画出该阴离子的球棍模型______________。
(3)溶液A用稀硫酸酸化后加入0.275mlH2O2,用离子反应方程式表示发生的反应_________________________,请设计实验验证反应后溶液中所含的金属阳离子_________________________。
1.(2022·全国甲卷)能正确表示下列反应的离子方程式为
A.硫化钠溶液和硝酸混合:S2-+2H+=H2S↑
B.明矾溶液与过量氨水混合:Al3++4NH3+2H2O=AlO+4NH
C.硅酸钠溶液中通入二氧化碳:SiO+CO2+H2O=HSiO+HCO
D.将等物质的量浓度的Ba(OH)2和NH4HSO4溶液以体积比1∶2混合:Ba2++2OH-+2H++SO=BaSO4↓+2H2O
2.(2022·广东卷)下列关于的化合物之间转化反应的离子方程式书写正确的是
A.碱转化为酸式盐:
B.碱转化为两种盐:
C.过氧化物转化为碱:
D.盐转化为另一种盐:
3.(2022·浙江卷)下列反应的离子方程式不正确的是
A.盐酸中滴加溶液:
B.溶液中通入过量:
C.乙醇与酸性溶液反应:
D.溴与冷的溶液反应:
4.(2022·湖南卷)下列离子方程式正确的是
A.通入冷的溶液:
B.用醋酸和淀粉溶液检验加碘盐中的:
C.溶液中加入产生沉淀:
D.溶液与少量的溶液混合:
5.(2022·广东卷)实验室进行粗盐提纯时,需除去和,所用试剂包括以及
A.B.
C.D.
6.(2022·全国乙卷)某白色粉末样品,可能含有、、和。取少量样品进行如下实验:
①溶于水,得到无色透明溶液
②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出。离心分离。
③取②的上层清液,向其中滴加溶液有沉淀生成。
该样品中确定存在的是
A.B.
C.D.
电解质
非电解质
概念
在水溶液中或熔融状态下能够导电的化合物
在水溶液中和熔融状态下都不能够导电的化合物
相同点
二者均为化合物
不同点
在水溶液中或熔融状态下能够导电
在上述两种情况下均不导电
物质种类
酸、碱、盐、金属氧化物和水
非金属氧化物、气态氢化物、大多数有机物
溶质微粒形式
是否导电
电解质
非电解质
NaCl晶体
Na+、Cl—(不自由)
否
是
否
NaCl溶液
Na+、Cl—
是
否
否
熔融的NaCl
自由移动的Na+、Cl—
是
是
否
固态H2SO4
H2SO4分子
否
是
否
H2SO4溶液
H+、SO42—
是
否
否
液态纯H2SO4
H2SO4分子
否
是
否
固态酒精
酒精分子
否
否
是
酒精水溶液
酒精分子
否
否
否
液态酒精
酒精分子
否
否
是
干冰
CO2分子
否
否
是
CO2的水溶液
CO2、H2CO3、HCO3—、CO32—、H+等
是
否
否
液态CO2
CO2分子
否
否
是
金属铜
Cu2+、e—
是
否
否
强电解质
弱电解质
概念
水溶液中全部电离的电解质
水溶液中部分电离的电解质
相同点
都是电解质,在水溶液中或熔融状态下都能电离,都能导电,与溶解度无关
不
同
点
电离程度
完全电离
部分电离
电离过程
不可逆过程
可逆过程,存在电离平衡
表示方法
电离方程式用“==”
电离方程式用“”
溶液中溶质微粒
只有水合离子
水合离子,弱电解质分子
实例
强酸:HCl、HNO3、H2SO4 HBr、HI、HClO4等
强碱:KOH、NaOH、Ba(OH)2 Ca(OH)2
绝大多数盐:(BaSO4、AgCl、CaCO3)
弱酸:HF、HClO、H2S、H2SO3 、H3PO4、H2CO3 、H2SiO3、CH3COOH、等。
弱碱:NH3·H2O、Al(OH)3等不溶性碱
水:H2O
实验现象
离子方程式
A
向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解
Mg(OH)2+2NHeq \\al(+,4)=Mg2++2NH3·H2O
B
向沸水中滴加饱和氯化铁溶液得到红褐色液体
Fe3++3H2O= Fe(OH)3↓+3H+
C
二氧化硫使酸性高锰酸钾溶液褪色
3SO2+2MnOeq \\al(-,4)+4H+=3SOeq \\al(2-,4)+2Mn2++2H2O
D
氧化亚铁溶于稀硝酸
FeO+2H+=Fe2++H2O
阳离子
不能大量共存的阴离子
Ba2+、Ca2+、Pb2+
COeq \\al(2-,3)、SOeq \\al(2-,3)、SOeq \\al(2-,4)、SiOeq \\al(2-,3)、POeq \\al(3-,4)
Fe3+、Cu2+、Fe2+
OH-、S2-、COeq \\al(2-,3)、HCOeq \\al(-,3)、SiOeq \\al(2-,3)、AlOeq \\al(-,2)
Al3+、Zn2+
OH-、COeq \\al(2-,3)、HCOeq \\al(-,3)、SiOeq \\al(2-,3)、AlOeq \\al(-,2)
H+
SiOeq \\al(2-,3)、AlOeq \\al(-,2)
离子
不能大量共存的离子
H+
S2Oeq \\al(2-,3)、COeq \\al(2-,3)、SOeq \\al(2-,3)、HCOeq \\al(-,3)、HSOeq \\al(-,3)、S2-、HS-
OH-
NHeq \\al(+,4)(浓溶液并加热)
氧化性离子
还原性离子
ClO-、MnOeq \\al(-,4)(H+)、NOeq \\al(-,3)(H+)、Fe3+、Cr2Oeq \\al(2-,7)、FeOeq \\al(2-,4)
Fe2+(可与Fe3+共存)、S2-、I-、SOeq \\al(2-,3)、HS-、HSOeq \\al(-,3)
选项
操作
现象
结论
A
滴加BaCl2溶液
生成白色沉淀
原溶液中有SOeq \\al(2-,4)
B
滴加氯水和CCl4,振荡、静置
下层溶液显紫色
原溶液中有I-
C
用洁净铂丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液中有Na+,无K+
D
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无NHeq \\al(+,4)
阳离子
Fe3+
Mg2+
Al3+
Cr3+
沉淀完全时的pH
3.7
11.1
5.4(>8溶解)
9(>9溶解)
新高考化学二轮复习考点提升讲与练专题03 离子反应方程式与离子共存(专练)(解析版): 这是一份新高考化学二轮复习考点提升讲与练专题03 离子反应方程式与离子共存(专练)(解析版),文件包含新高考化学二轮复习考点提升讲与练专题03离子反应方程式与离子共存专练原卷版docx、新高考化学二轮复习考点提升讲与练专题03离子反应方程式与离子共存专练解析版docx等2份试卷配套教学资源,其中试卷共20页, 欢迎下载使用。
高考化学二轮复习讲练测(新高考专用)专题03离子反应方程式和离子共存(讲)原卷版+解析: 这是一份高考化学二轮复习讲练测(新高考专用)专题03离子反应方程式和离子共存(讲)原卷版+解析,共22页。
高考化学二轮复习讲练测(新高考专用)专题03离子反应方程式和离子共存(练)原卷版+解析: 这是一份高考化学二轮复习讲练测(新高考专用)专题03离子反应方程式和离子共存(练)原卷版+解析,共23页。试卷主要包含了下列离子方程式正确的是等内容,欢迎下载使用。












