





新高考化学一轮复习讲义课件第4章 第17讲 无机非金属材料(含解析)
展开1.了解硅酸盐材料及新型无机非金属材料的性质和用途。2.掌握硅和二氧化硅的性质及应用,了解高纯硅的制备。
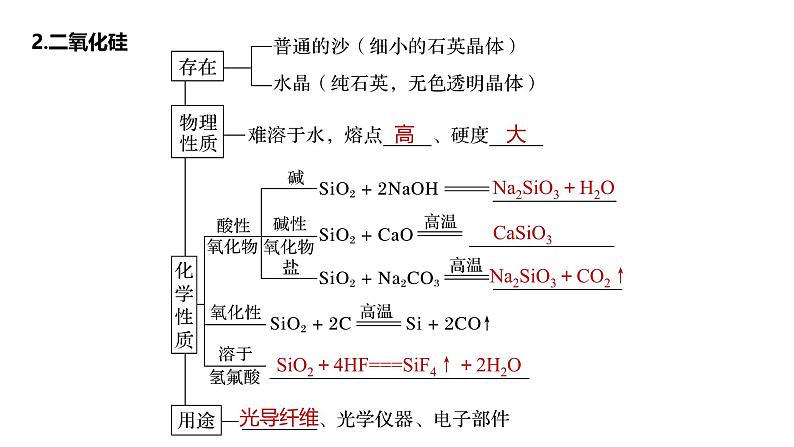
Na2SiO3+H2O
Na2SiO3+CO2↑
SiO2+4HF===SiF4↑+2H2O
1.工业上用焦炭和二氧化硅制取粗硅时生成粗硅和CO2气体( )2.Si是半导体材料,可用作太阳能电池( )3.SiO2与NaOH溶液反应生成盐和水,也可以和氢氟酸反应,所以SiO2是两性氧化物( )4.因为热稳定性:CH4>SiH4,所以非金属性:C>Si( )5.SiO2能与HF反应,因此可用HF刻蚀玻璃( )6.NaOH溶液不能用玻璃瓶盛放( )7.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”( )
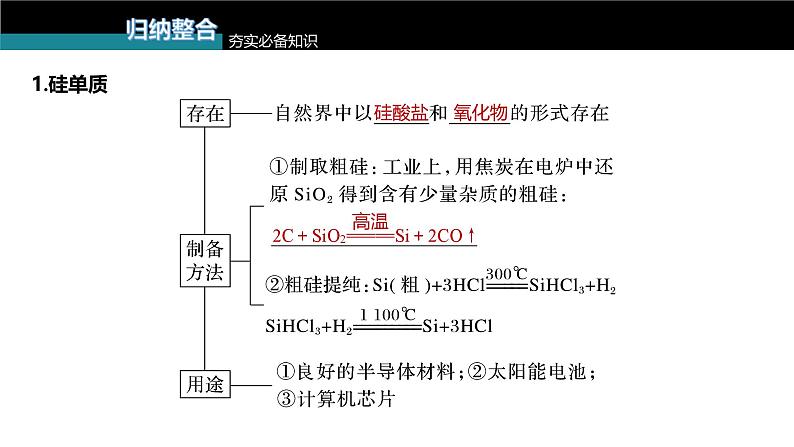
1.科学家最新研制的利用氯化氢和氢气生产高纯硅的工艺流程如图所示:
A.该工艺流程的优点是部分反应物可循环使用B.①和②互为可逆反应C.该流程中需要隔绝空气
2.晶体硅是一种重要的非金属原料,由粗硅制备纯硅的主要步骤如下:①粗硅与干燥的HCl气体反应制得SiHCl3:Si(粗)+3HCl SiHCl3+H2;②经过纯化的SiHCl3与过量H2在1 000~1 100 ℃下反应制得纯硅。回答相关问题:(1)粗硅与HCl气体反应完全后,经冷凝得到SiHCl3(沸点为36.5 ℃),只含有少量SiCl4(沸点为57.6 ℃)和HCl(沸点为-84.7 ℃),提纯SiHCl3的方法为______。
(2)用SiHCl3与过量H2反应制备纯硅的装置如图所示(热源及夹持装置已略去):
①在加热D装置前应先打开A装置中分液漏斗的活塞,目的是_____________________________。②C装置中烧瓶需要加热,采用的方法是__________。
1.陶瓷陶瓷以 (主要成分为含水的 )为主要原料,经 烧结而成的。2.玻璃普通玻璃的主要成分为 ,它是以 为主要原料,经混合、粉碎,在 中熔融,发生复杂的 而制得的,玻璃可用于生产建筑材料、光学仪器和各种器皿,还可制造 ,用于高强度 等。
Na2SiO3、CaSiO3和SiO2
3.水泥普通硅酸盐水泥的主要原料是 ,二者与其他辅料经混合、研磨后在 中煅烧,发生复杂的物理变化和化学变化,加入适量石膏调节水泥____ ,再研成细粉得到普通水泥。混凝土是水泥、沙子和碎石等与水混合得到的。
(二)新型无机非金属材料
1.新型陶瓷新型陶瓷在组成上不再限于传统的硅酸盐体系,在光学、热学、电学、磁学等方面具有很多新的特性和功能。
2.新型陶瓷的种类与用途
3.碳纳米材料碳纳米材料是一类新型的无机非金属材料(1)类型:富勒烯、碳纳米管、石墨烯等。(2)用途:在能源、信息、医药等领域有广阔的应用前景。
1.玻璃是人类最早使用的硅酸盐制品( )2.沙子和黏土的主要成分均为硅酸盐( )3.二氧化硅可用于生产玻璃( )4.碳化硅俗称金刚砂,它可用于高温结构陶瓷的制作( )5.压电陶瓷能实现机械能与电能的相互转化( )6.石墨烯的电阻率低,热导率也低( )7.传统的无机非金属材料均为硅酸盐材料( )
下列说法正确的是A.原材料稻壳灰价格低廉,且副产品活性炭有较高的经济价值B.操作A与操作B完全相同C.该流程中硅元素的化合价发生改变D.反应器中发生的反应为氧化还原反应
1.水玻璃(Na2SiO3溶液)广泛应用于耐火材料、洗涤剂生产等领域,是一种重要的工业原料。如图是用稻壳灰(SiO2:65%~70%、C:30%~35%)制取水玻璃的工艺流程:
一、传统无机非金属材料
2.世博会中国馆——“东方之冠”由钢筋、混凝土、7 000多块铝板和1 200多块玻璃等建成。(1)铝板易被烧碱腐蚀,玻璃易被氢氟酸腐蚀,原因分别为:______________________________________、__________________________(用化学方程式表示)。
2Al+2NaOH+2H2O
===2NaAlO2+3H2↑
(2)生产硅酸盐水泥和普通玻璃都需要用到的主要原料是________。制备普通玻璃的主要反应方程式为__________________________________________________________________________(任写一个)。
(3)石英玻璃化学稳定性强、膨胀系数小,是一种特殊玻璃,石英玻璃的主要成分是______(填化学式)。(4)要将NaOH高温熔化,下列坩埚中可选用的是_____(填字母)。A.普通玻璃坩埚 B.石英玻璃坩埚C.氧化铝坩埚 D.铁坩埚
二、新型无机非金属材料
3.新材料的新秀——石墨烯和氧化石墨烯已成为物理、化学、材料科学研究的国际热点课题。其结构模型如图所示:
下列有关说法正确的是A.石墨烯是一种新型化合物B.氧化石墨烯即石墨烯的氧化物C.二者和石墨都是碳的同素异形体D.氧化石墨烯具有一定的亲水性
4.氮化硅可用作高温结构陶瓷复合材料,在航空航天、汽车发动机、机械等领域有着广泛的应用。由石英砂合成氮化硅粉末的路线如图所示:
其中—NH2中各元素的化合价与NH3相同。请回答下列问题:(1)石英砂不能与碱性物质共同存放,以NaOH为例,用化学方程式表示其原因:_______________________________。
SiO2+2NaOH===Na2SiO3+H2O
(2)图示①~⑤的变化中,属于氧化还原反应的是________(填序号)。
(3)在反应⑤中,3 ml Si(NH2)4在高温下加热可得1 ml氮化硅粉末和8 ml A气体,则氮化硅的化学式为_______。
(4)在高温下将SiCl4在B和C两种气体的气氛中,也能反应生成氮化硅,B和C两种气体在一定条件下化合生成A。写出SiCl4与B和C两种气体反应的化学方程式:_____________________________________。
1.正误判断,正确的打“√”,错误的打“×”(1)河姆渡出土陶灶,属于陶器,兽首玛瑙杯主要成分为二氧化硅(2021·广东,1BC)( )(2)利用氢氟酸刻蚀石英制作艺术品,是利用了氢氟酸可与SiO2反应(2021·广东,4C)( )(3)硅酸钠是一种难溶于水的硅酸盐(2021·浙江6月选考,9A)( )(4)SiO2可用来制造光导纤维(2020·浙江7月选考,9B)( )(5)向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+===H2SiO3↓+2Na+(2019·江苏,7D)( )(6)高纯硅可用于制作光感电池(2019·全国卷Ⅲ,7A)( )
2.(2020·浙江7月选考,24)Ca3SiO5是硅酸盐水泥的重要成分之一,其相关性质的说法不正确的是A.可发生反应:Ca3SiO5+4NH4Cl CaSiO3+2CaCl2+4NH3↑+2H2OB.具有吸水性,需要密封保存C.能与SO2反应生成新盐D.与足量盐酸作用,所得固体产物主要为SiO2
3.(2019·全国卷Ⅰ,7)陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点
4.(2017·全国卷Ⅱ,26)水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
回答下列问题:(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是________________________________,还可以使用_____代替硝酸。
将样品中可能存在的Fe2+氧化为Fe3+
(2)沉淀A的主要成分是_______________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为_________________________________________________________。
SiO2(或H2SiO3)
SiO2+4HF===SiF4↑+2H2O(或H2SiO3+4HF===SiF4↑+3H2O)
(3)加氨水过程中加热的目的是______________________________。沉淀B的主要成分为____________、_________(填化学式)。
防止胶体生成,易于沉淀分离
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为: +H++H2C2O4―→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.050 0 ml·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙的质量分数为_______。
1.硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤。在无机非金属材料中,硅一直扮演着主角。下列几种物质中含有硅单质的是
2.下列关于无机非金属材料的说法不正确的是A.传统无机非金属材料是指玻璃、水泥、陶瓷等硅酸盐材料B.新型无机非金属材料虽然克服了传统无机非金属材料的缺点,但强度比较差C.高温结构材料具有耐高温、耐酸碱腐蚀、硬度大、耐磨损、密度小等优点D.传统无机非金属材料和新型无机非金属材料的主要成分不同
3.下列关于硅单质及其化合物的说法正确的是①硅是构成一些岩石和矿物的基本元素 ②水泥、玻璃、水晶饰物都是硅酸盐制品 ③高纯度的硅单质广泛用于制作光导纤维 ④陶瓷是人类应用很早的硅酸盐材料A.①② B.②③ C.①④ D.③④
4.信息、材料、能源被称为新科技革命的“三大支柱”。下列有关资讯错误的是A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源B.中、美、日等国已掌握的陶瓷发动机技术,能较大程度地降低能耗,节约能源C.光导纤维在信息产业中应用广泛,制造光导纤维的主要材料是单质硅D.结构陶瓷碳化硼(B4C3)常用于制造切削工具,它是一种新型无机非金属材料
5.“九秋风露越窑开,夺得千峰翠色来”是赞誉越窑秘色青瓷的诗句,描绘我国古代精美的青瓷工艺品。玻璃、水泥和陶瓷均为硅酸盐制品,下列有关说法正确的是A.玻璃是人类最早使用的硅酸盐制品B.制水泥的原料为纯碱、石灰石和石英C.硅酸盐制品的性质稳定、熔点较高D.沙子和黏土的主要成分均为硅酸盐
6.下列关于二氧化硅的说法正确的是A.二氧化硅是酸性氧化物,因此能与水反应生成硅酸B.二氧化硅制成的光导纤维,由于导电能力强而被用于制造光缆C.二氧化硅能与碳酸钠固体在高温时发生反应D.用二氧化硅制取单质硅时,当生成2.24 L气体(标准状况)时,得到2.8 g硅
7.宋代五大名窑分别为钧窑、汝窑、官窑、定窑、哥窑。其中钧窑以“入窑一色,出窑万彩”的神奇窑变著称。下列关于陶瓷的说法不正确的是A.窑变是高温下釉料中的金属化合物发生氧化还原反应导致的颜色变化B.氧化铝陶瓷属于新型无机非金属材料C.高品质的瓷器晶莹剔透,属于纯净物D.陶瓷属于硅酸盐材料,耐酸碱腐蚀,但是不能用来盛装氢氟酸
8.实验室用H2还原SiHCl3(沸点:31.85 ℃)制备高纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是
A.装置Ⅱ、Ⅲ中依次盛装的是浓硫酸、冰水B.实验时,应先加热管式炉,再打开活塞KC.为鉴定制得的硅中是否含有微量铁单质,需要用到的试剂为盐酸、双氧水、KSCN 溶液D.该实验中制备氢气的装置也可用于饱和食盐水与电石反应制备乙炔
9.金刚砂(SiC)可由SiO2和碳在一定条件下反应制得,反应的化学方程式为SiO2+3C SiC+2CO↑,下列有关制造金刚砂的说法正确的是A.该反应中的氧化剂是SiO2,还原剂为CB.该反应中的氧化产物和还原产物的物质的量之比为1∶2C.该反应中转移12e-D.该反应中的还原产物是SiC、氧化产物是CO
10.科学家最近用金属钠还原CCl4和SiCl4制得一种一维SiC纳米棒,相关反应的化学方程式为8Na+CCl4+SiCl4 SiC+8NaCl。下列说法不正确的是A.SiC和SiO2中Si元素的化合价相同B.上述反应中SiC既是氧化产物又是还原产物C.SiO2制备单质Si、单质Si制备SiCl4均涉及氧化还原反应D.一维SiC纳米棒比表面积大,对微小粒子有较强的吸附能力
11.科学家发现了纯碳新材料“碳纳米泡沫”,每个泡沫含有约4 000个碳原子,直径约6~9 nm,在低于-183 ℃时,泡沫具有永久磁性。下列叙述错误的是A.“碳纳米泡沫”与石墨互为同素异形体B.把“碳纳米泡沫”分散到适当的溶剂中能产生丁达尔效应C.“碳纳米泡沫”是一种新型的碳单质D.“碳纳米泡沫”和金刚石的性质相同
12.硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。(1)下列物质不属于硅酸盐材料的是_____(填字母)。A.陶瓷 B.玻璃C.水泥 D.生石灰(2)SiO2是玻璃的主要成分之一,SiO2与氢氧化钠溶液反应的化学方程式为_________________________________,工艺师常用__________(填物质名称)来雕刻玻璃。
2NaOH===Na2SiO3+H2O
(3)工业上常用反应:2C+SiO2 Si+2CO↑制备粗硅,该反应物中所含元素化合价升高的物质是_____(填化学式,下同),氧化剂是_______。
13.高纯硅是制作光伏电池的关键材料,如图是一种生产高纯硅的工艺流程示意图:
③SiHCl3极易水解:SiHCl3+3H2O===H2SiO3+H2↑+3HCl↑。
回答下列问题:(1)石英砂的主要成分为SiO2,SiO2是一种酸性氧化物,能与烧碱反应生成盐和水,下列物质中也能与烧碱反应生成盐和水的是_____(填字母)。A.Al B.Al2O3 C.CuO D.NaHCO3SiO2能在一种常见的酸中溶解,生成一种气态含硅物质,这种酸的电子式为________。
(2)电弧炉中生成粗硅,反应的化学方程式为___________________________。若电弧炉中焦炭过量,还会有SiC生成,石英砂和焦炭生成SiC的反应中,氧化剂和还原剂的物质的量之比为_____。
(人教版)高考化学一轮复习讲义课件第14章第64讲 醛、酮(含解析): 这是一份(人教版)高考化学一轮复习讲义课件第14章第64讲 醛、酮(含解析),共60页。PPT课件主要包含了酮概述,酮的化学性质,练真题明考向,课时精练等内容,欢迎下载使用。
(人教版)高考化学一轮复习讲义课件第10章第43讲 电解原理应用新拓展(含解析): 这是一份(人教版)高考化学一轮复习讲义课件第10章第43讲 电解原理应用新拓展(含解析),共49页。PPT课件主要包含了课时精练等内容,欢迎下载使用。
(人教版)高考化学一轮复习讲义课件第8章第33讲 化学键(含解析): 这是一份(人教版)高考化学一轮复习讲义课件第8章第33讲 化学键(含解析),共60页。PPT课件主要包含了共价键及其参数,练真题明考向,课时精练等内容,欢迎下载使用。












