




新高考化学一轮复习讲义课件第3章 第16讲 金属及其化合物知识落实与拓展(含解析)
展开1.进一步巩固Na、Fe及其化合物的转化关系。2.了解热点金属元素及其化合物的转化。3.能用热重分析法计算、判断金属化合物的组成。
金属及其化合物知识再落实
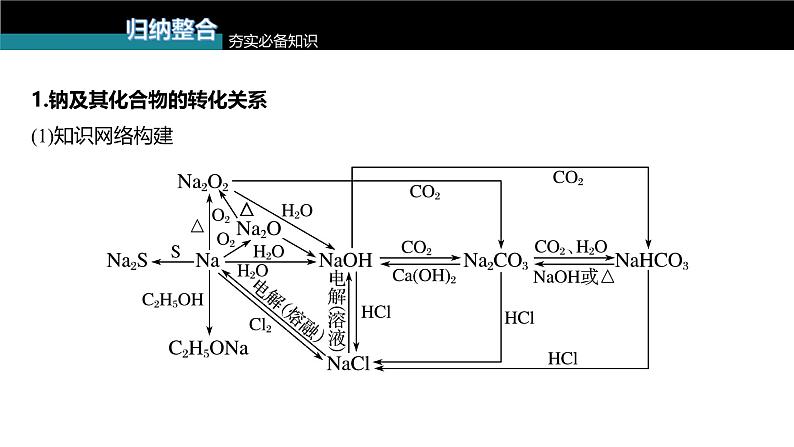
1.钠及其化合物的转化关系(1)知识网络构建
(2)重要反应方程式的书写写出下列反应的化学方程式,是离子反应的写出离子方程式。①Na和H2O的反应 ;②Na在空气中燃烧 ;③Na2O2和H2O的反应 ;④Na2O2和CO2的反应 ;
2Na+2H2O===2Na++2OH-+H2↑
2Na2O2+2H2O===4Na++4OH-+O2↑
2Na2O2+2CO2===2Na2CO3+O2
⑤向NaOH溶液中通入过量CO2 ;⑥将Na2CO3溶液与石灰乳混合 ;⑦向Na2CO3稀溶液中通入过量CO2 ;⑧将NaHCO3溶液和NaOH溶液等物质的量混合 ;⑨将NaHCO3溶液与澄清石灰水等物质的量混合 ;⑩将NaHCO3溶液与少量澄清石灰水混合 。
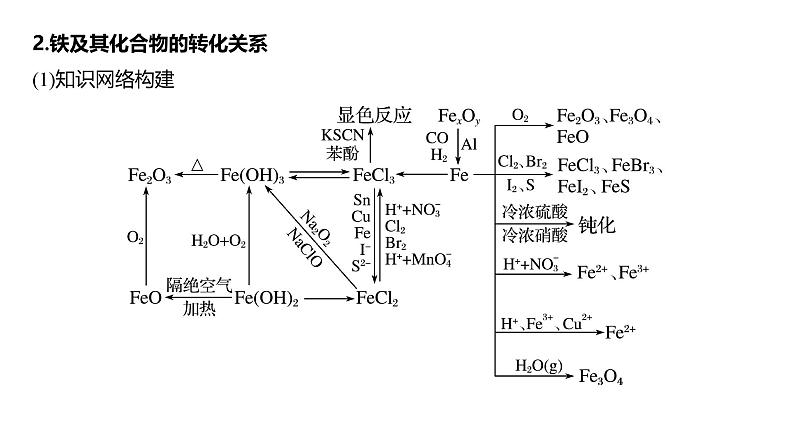
2.铁及其化合物的转化关系(1)知识网络构建
(2)重要反应方程式的书写写出下列反应的化学方程式,是离子反应的写出离子方程式。①Fe和过量稀HNO3的反应 ;②Fe高温下和水蒸气的反应 ;③铝与氧化铁的铝热反应 ;④用赤铁矿冶炼铁的原理 ;
⑤Fe(OH)2长时间露置于空气中 ;⑥FeO和稀HNO3的反应 ;⑦Fe(OH)3和HI的反应 ;⑧FeBr2溶液和少量Cl2的反应 ;⑨FeBr2溶液和等物质的量的Cl2反应 ;⑩FeBr2溶液和过量Cl2的反应 。
4Fe(OH)2+O2+2H2O===4Fe(OH)3
2Fe(OH)3+6H++2I-===2Fe2++I2+6H2O
2Fe2++Cl2===2Fe3++2Cl-
2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-
2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
1.Fe在一定条件下可与浓盐酸、稀硫酸、浓硝酸等剧烈反应( )2.Al、Cl2均能和NaOH溶液发生氧化还原反应,且两单质的作用不相同( )3.在稀硫酸中加入铜粉,铜粉不溶解,若再继续加入KNO3固体,铜粉会溶解( )4.金属单质Na、Mg、Fe在一定条件下与水反应都生成H2和相应的碱( )5.铝和氢氧化钠溶液反应生成Al(OH)3和Na( )6.钠在空气中燃烧生成淡黄色的Na2O( )7.铁在高温下与水蒸气反应生成Fe3O4和H2( )8.用碳酸钠和氢氧化钙反应制NaHCO3( )
一、沉淀法除去铁元素的流程
1.已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
某同学设计的除杂流程图如下:
(1)不能通过直接调pH除去Fe2+的原因是_______________________________________________________。(2)加入的氧化剂可以是_______________。(3)使Fe3+完全沉淀应调pH的范围是_____________,为不引入新杂质加入调pH的最佳试剂可以是_____________________________________。
pH≥9.6时Fe2+才能沉淀完全,而pH≥9.6时
CuO[或Cu(OH)2或CuCO3或Cu2(OH)2CO3]
二、价态多变、形式多样的铁盐
2.硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]在空气中比一般亚铁盐稳定,是定量分析化学中常用的还原剂,其实验室制备流程如图所示:
下列说法不正确的是A.“除油污”过程中使用热的Na2CO3溶液效果更好B.制备硫酸亚铁时铁屑与硫酸反应完全时的现象是不再有气泡产生C.“趁热过滤”后的滤液略显黄色的原因是4Fe2++O2+4H+===4Fe3++2H2OD.理论上加入(NH4)2SO4固体的质量为6.0 g
3.[2019·江苏,18(1)]聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。将一定量的FeSO4·7H2O溶于稀硫酸,在约70 ℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。H2O2氧化Fe2+的离子方程式为__________________________________;水解聚合反应会导致溶液的pH______。
2Fe2++H2O2+2H+===2Fe3++2H2O
4.高铁酸钾(K2FeO4)是一种比KMnO4、O3和Cl2的氧化能力强的强氧化剂。(1)有科学家曾提出在氧气流下,温度控制在350~370 ℃,煅烧氧化铁和过氧化钾(K2O2)固体混合物可直接制备高铁酸钾,该反应只有两种产物,另一种产物为氧化钾,则该反应的化学方程式:_____________________________________。
(2)“熔融法”是最早发现+6价高铁酸盐的方法,以该法制备高铁酸盐的原理:①FeSO4+Na2O2 Na2FeO4+Na2O+Na2SO4+O2↑②Na2FeO4+2KOH===K2FeO4↓+2NaOH反应①中被氧化的Na2O2与被FeSO4还原的Na2O2的物质的量比为1∶4,请写出反应①配平后的化学方程式:___________________________________________________;若反应①产生16.8 L(标准状况)O2,则转移电子的物质的量为____ ml;反应②能发生的原因是_______________________________________________。
碱性条件下,K2FeO4的溶解度小于Na2FeO4的溶解度
(3)水是万物之源,为探究高铁酸钾在水质处理中发挥的作用,查阅资料可知:干燥的高铁酸钾在常温下可以长期稳定存在,但溶于水中极易分解得到氧气和氢氧化铁胶体,写出该反应的化学方程式:______________________________________________。
4K2FeO4+10H2O===8KOH+4Fe(OH)3(胶体)+3O2↑
(1)K2FeO4中Fe呈+6价,K2FeO4具有强氧化性,可用于水体的杀菌消毒。(2)K2FeO4与水反应生成Fe(OH)3胶体,吸附水体中的悬浮物,起到净水的作用。
化工流程题中的过渡金属
过渡金属元素常具有多种可变化合价,形成化合物种类较多,近年高考题常以Cr、Mn、V、Zn等元素化合物的制备流程为载体,考查不同价态物质转化规律,条件控制、物质的分离提纯等关键能力。
例1 利用钒钛磁铁矿冶炼后产生的钒渣(主要含FeO·V2O3、Al2O3、SiO2及少量可溶性磷酸盐)生产V2O5的工艺流程如下,回答下列问题:
已知:①V2O5、Al2O3、SiO2可与Na2CO3、NaCl组成的混合钠盐在高温下反应,并转化为NaVO3、NaAlO2、Na2SiO3等可溶性钠盐。
(1)焙烧Ⅰ包括氧化和钠化成盐两个过程,氧化的目的是获得V2O5,写出氧化过程中FeO·V2O3发生反应的化学方程式:______________________________________;废渣Ⅰ的主要成分是_______;精制Ⅰ中加盐酸调pH的主要作用是____________________________,加入NH3·H2O后发生反应的离子方程式为____________________________________________________________________。
Al3+ +3NH3·H2O===
(2)精制Ⅱ中加入CaCl2溶液除去磷酸盐,pH过小时影响除磷效果的原因是______________________________________________________________;pH过大时,沉淀量增大的原因是___________________。
较大的酸式盐(或形成溶解度较大的磷酸氢钙或磷酸二氢钙)
产生了Ca(OH)2沉淀
(3)沉钒所得NH4VO3沉淀需进行洗涤,洗涤时除去的阴离子主要是_______。NH4VO3在500 ℃时焙烧脱氨制得产品V2O5,反应的化学方程式为2NH4VO3 V2O5+H2O↑+2NH3↑。但脱氨过程中,部分V2O5会转化成V2O4,反应中氧化剂与还原剂物质的量之比为3∶2,该反应的化学方程式为__________________________________。
例2 铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1 857 ℃。(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:
①Fe(CrO2)2中各元素化合价均为整数,则铬为_____价。②高温氧化时反应的化学方程式为_______________________________________________________________。③操作a由两种均发生了化学反应的过程构成,其内容分别是____________________、铝热反应。
+8Na2CrO4+8CO2
灼烧使Cr(OH)3分解
(2)Cr(OH)3是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应时生成的两种盐的化学式:_________、__________。
(3)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。①写出 在酸性条件下被Fe2+还原为Cr3+的离子方程式:___________________________________________。②若处理含1 ml (不考虑其他含铬微粒)的污水时恰好消耗10 ml FeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为___________。
===3Fe3++Cr3++4H2O
热重分析判断金属及其化合物的组成
热重分析的一般方法和规律
(1)设晶体为1 ml,其质量为m。(2)失重一般是先失水,再失非金属氧化物。(3)计算每步固体剩余的质量(m余)
(4)晶体中金属质量不再减少,仍在m余中。(5)失重最后一般为金属氧化物,由质量守恒得m氧,由n金属∶n氧,即可求出失重后物质的化学式。
g FeSO4·7H2O(M=278 g·ml-1)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,下列说法正确的是
A.温度为78 ℃时,固体M的化学式为FeSO4·5H2OB.温度为159 ℃时,固体N的化学式为FeSO4·2H2OC.在隔绝空气条件下,由N得到P的化学方程式为FeSO4·H2O FeSO4+H2OD.取适量380 ℃时所得的样品P,隔绝空气加热至650 ℃,得到一种固体Q,同时有 两种无色气体生成,Q的化学式为Fe3O4
2.将草酸锌晶体(ZnC2O4·2H2O)加热分解可得到一种纳米材料。加热过程中固体残留率随温度的变化如图所示,300~460 ℃范围内,发生反应的化学方程式为________________________________。
3.将Ce(SO4)2·4H2O(摩尔质量为404 g·ml-1)在空气中加热,样品的固体残留率( ×100%)随温度的变化如图所示。
当固体残留率为70.3%时,所得固体可能为____(填字母)。A.Ce(SO4)2 B.Ce2(SO4)3 C.CeOSO4
1.[2021·全国甲卷,27(4)]胆矾(CuSO4·5H2O)易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的CuO(杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:结晶水测定:称量干燥坩埚的质量为m1,加入胆矾后总质量为m2,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为m3。根据实验数据,胆矾分子中结晶水的个数为____________(写表达式)。
2.[2019·全国卷Ⅰ,27(5)]采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为____________________。
NH4Fe(SO4)2·12H2O
3.[2021·辽宁,16(1)(2)(5)(6)]从钒铬锰矿渣(主要成分为V2O5、Cr2O3、MnO)中提铬的一种工艺流程如图所示:
已知:pH较大时,二价锰[Mn(Ⅱ)]在空气中易被氧化。回答下列问题:(1)Cr元素位于元素周期表第____周期第_____族。(2)用FeCl3溶液制备Fe(OH)3胶体的化学方程式为_______________________________________。
(5)“转化”过程中生成MnO2的离子方程式为___________________________________。(6)“提纯”过程中Na2S2O3的作用为______________________________________________________________________________________________。
Mn2++H2O2+2OH-===MnO2↓+2H2O
防止pH较大时,二价锰[Mn(Ⅱ)]被空气中的氧气氧化,转化为MnO2吸附在Cr(OH)3的表面,使产物不纯
1.在给定条件下,下列选项中所示的物质间转化均能一步实现的是
2.如图中U→Z六种物质在适当条件下能实现图示箭头方向一步转化,且反应①②均为置换反应,满足条件的物质组是
A.②④ B.②③C.①②④D.①②③④
3.对某溶液中部分离子的定性检测流程如下。相关分析正确的是
A.步骤①所加试剂可以是浓NaOH溶液B.可以用湿润的蓝色石蕊试纸检验生成 的无色气体C.红褐色沉淀与HI反应的离子方程式为 Fe(OH)3+3H+===Fe3++3H2O
4.某废催化剂含SiO2、ZnS、CuS及少量的Fe3O4。某实验小组以废催化剂为原料,进行回收利用。设计实验流程如图:
已知:CuS既不溶于稀硫酸,也不与稀硫酸反应。下列说法正确的是A.步骤①操作中,生成的气体可用碱液吸收B.滤液1中是否含有Fe2+,可以选用KSCN和新制的氯水检验C.滤渣1成分是SiO2和CuS,滤渣2成分一定是SiO2D.步骤④要滴加稀硫酸防止CuSO4水解
5.碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]常用作塑料阻燃剂。为确定碱式碳酸铝镁的组成,进行如下实验:①准确称取3.390 g样品与足量稀盐酸充分反应,生成0.560 L CO2(已换算成标准状况下)。
②另取一定量样品在空气中加热,样品的固体残留率( ×100%)随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。
6.PbO2在加热过程中发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重4.0%(即 ×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x和m∶n的值:_________________________________________________________________________________________________________________________。
g CaO2·8H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线,140 ℃时完全脱水,杂质受热不分解)如图所示。
(1)试确定60 ℃时CaO2·xH2O中x=____。(2)该样品中CaO2的质量分数为________。
8.(2022·河北省模拟)硫化镍矿的主要成分是NiS,还含有MgS、FeS、一些不溶性物质等,工业上用硫化镍矿制备金属镍的工艺流程如图所示:
(1)硫化镍矿粉磨的目的是_________________________________________________,“酸浸”时,硫化镍与稀盐酸反应的化学方程式为_____________________________。
增大反应物的接触面积,提高反应速率,使反应更加充分
(2)“氧化、除铁”过程中加入H2O2溶液时,发生反应的离子方程式为___________________________________;加入氧化镍的目的是除去铁元素,用化学平衡移动原理解释除去铁元素的原因是____________________________________________________________________________________________________。
+2H+===2Fe3++2H2O
Fe3+在溶液中水解使溶液呈酸性,加入的氧化镍与氢离子
反应,水解平衡右移使Fe3+转化为Fe(OH)3沉淀而除去
(3)已知Ksp[Ni(OH)2]=2.0×10-15,Ksp[Mg(OH)2]=2.0×10-11,若“除镁”后的滤液中Ni2+的浓度不大于10-5 ml·L-1,则滤液中c(Mg2+)≤_____________。
(4)电解硫酸镍溶液时,在_____极得到镍单质,电解产物________(填化学式)可以循环使用。
9.(2022·永州市高三模拟)以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料合成新型的环保催化剂(OMS-2)的工艺流程如图:
(1)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示。为减少MnS2O6的生成,“浸锰”的适宜温度是______;调pH后再过滤主要除去____元素。
(2)Mn12O19中氧元素化合价均为-2价,锰元素的化合价有两种,则Mn(Ⅲ)、Mn(Ⅳ)物质的量之比为______。生产过程中KMnO4、MnSO4·H2O按物质的量之比1∶5与K2S2O8反应,产物中硫元素全部以 的形式存在,该反应的离子方程式为____________________________________________________________。
(3)滤液X可进一步分离出多种化合物,其一为盐类,该盐在农业生产中可用作______。(4)甲醛(HCHO)在OMS-2催化氧化作用下生成CO2和H2O,现利用OMS-2对某密闭空间的甲醛进行催化氧化实验。实验开始时,该空间内甲醛含量为1.22 mg·L-1,CO2含量为0.59 mg·L-1,一段时间后测得CO2含量升高至1.47 mg·L-1,该实验中甲醛的转化率为________(保留三位有效数字)。
10.(2022·河北模拟)钴酸锂电池的正极材料含有钴酸锂(LiCO2)、导电剂乙炔黑、铝箔及少量铁,通过如图工艺流程可回收铝、钴、锂。
回答下列问题:(1)钴酸锂电池放电时负极反应式为LixC6-xe-===C6+xLi+,拆解废旧电池前进行放电处理,既可保证安全又有利于回收锂。有利于回收锂的原因是__________________________________________________________。
负极生成的锂离子向正极移动,在正极上生成钴酸锂,便于回收
(2)“酸浸”时C、Li元素的浸出率随温度的变化如图所示:
“酸浸”的适宜温度是________,该过程有多个反应,钴酸锂发生的主要反应的离子方程式为____________________________________________________。
(3)沉锂过程要对所得滤渣进行洗涤,检验沉淀是否洗净的操作为_________________________________________________________________________________________________________________。
取少量最后一次洗涤液于试管中,加盐酸酸化,再滴加氯化钡溶液,若不产生白色沉淀,说明已洗涤干净,反之则未洗净
(4)沉钴的化学方程式为______________________________________________________。将100 mL 0.50 ml·L-1 CSO4溶液沉钴所得晶体配成溶液,经过一系列处理后通过滴定实验测得消耗0.50 ml·L-1碘标准溶液48.50 mL,则沉钴过程中CC2O4·2H2O的产率为________(已知:在“一系列处理”过程中二价钴被碘氧化成三价钴)。
CSO4+(NH4)2C2O4+2H2O===CC2O4·2H2O↓+(NH4)2SO4
新高考化学一轮复习讲义课件第4章 第25讲 非金属及其化合物知识落实与拓展(含解析): 这是一份新高考化学一轮复习讲义课件第4章 第25讲 非金属及其化合物知识落实与拓展(含解析),共60页。PPT课件主要包含了复习目标,砷及其化合物,AsH3,真题演练明确考向,课时精练,增大接触面积加,快反应速率,H2SO4+Se↓,Na2TeO3,HCl等内容,欢迎下载使用。
(人教版)高考化学一轮复习讲义课件第10章第43讲 电解原理应用新拓展(含解析): 这是一份(人教版)高考化学一轮复习讲义课件第10章第43讲 电解原理应用新拓展(含解析),共49页。PPT课件主要包含了课时精练等内容,欢迎下载使用。
2023年高考化学一轮复习金属及其化合物知识落实与拓展课件: 这是一份2023年高考化学一轮复习金属及其化合物知识落实与拓展课件,共23页。PPT课件主要包含了考点内容等内容,欢迎下载使用。












