2025年高考化学精品教案第三章金属及其化合物第2讲铁及其重要化合物
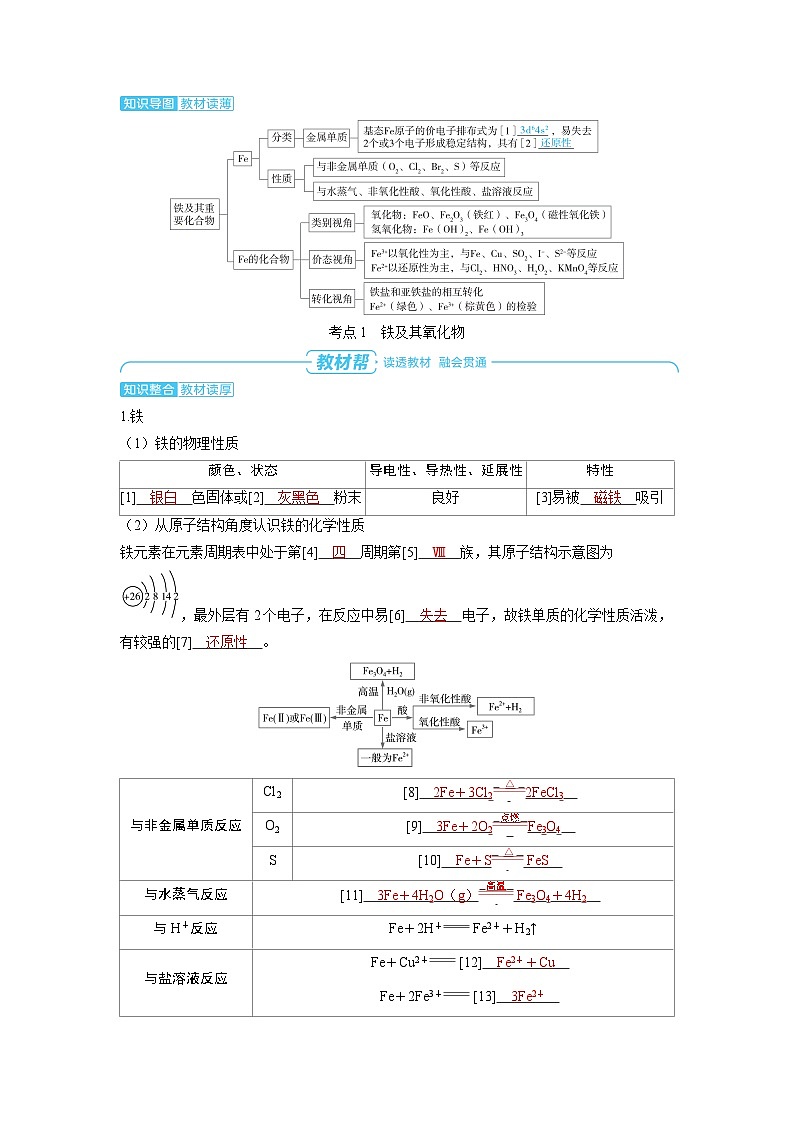
展开考点1 铁及其氧化物
1.铁
(1)铁的物理性质
(2)从原子结构角度认识铁的化学性质
铁元素在元素周期表中处于第[4] 四 周期第[5] Ⅷ 族,其原子结构示意图为,最外层有2个电子,在反应中易[6] 失去 电子,故铁单质的化学性质活泼,有较强的[7] 还原性 。
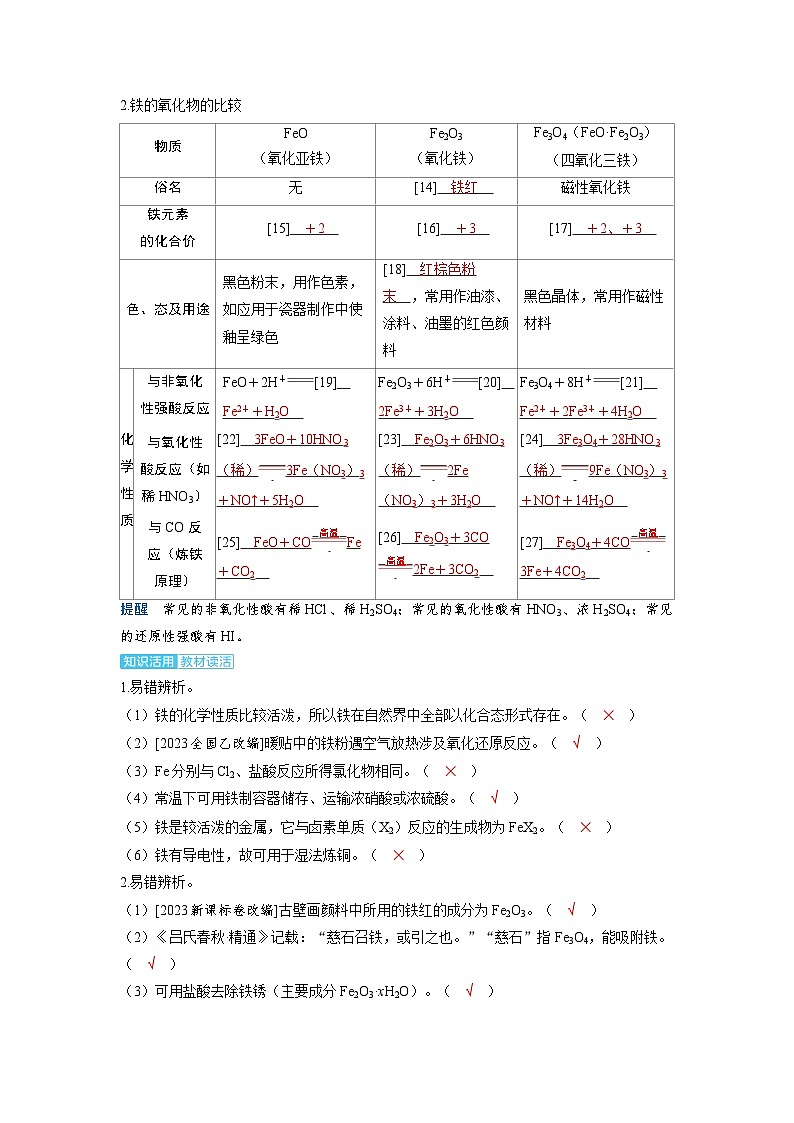
2.铁的氧化物的比较
提醒 常见的非氧化性酸有稀HCl、稀H2SO4;常见的氧化性酸有HNO3、浓H2SO4;常见的还原性强酸有HI。
1.易错辨析。
(1)铁的化学性质比较活泼,所以铁在自然界中全部以化合态形式存在。( ✕ )
(2)[2023全国乙改编]暖贴中的铁粉遇空气放热涉及氧化还原反应。( √ )
(3)Fe分别与Cl2、盐酸反应所得氯化物相同。( ✕ )
(4)常温下可用铁制容器储存、运输浓硝酸或浓硫酸。( √ )
(5)铁是较活泼的金属,它与卤素单质(X2)反应的生成物为FeX2。( ✕ )
(6)铁有导电性,故可用于湿法炼铜。( ✕ )
2.易错辨析。
(1)[2023新课标卷改编]古壁画颜料中所用的铁红的成分为Fe2O3。( √ )
(2)《吕氏春秋·精通》记载:“慈石召铁,或引之也。”“慈石”指Fe3O4,能吸附铁。( √ )
(3)可用盐酸去除铁锈(主要成分Fe2O3·xH2O)。( √ )
(4)[天津高考]将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2。( √ )
(5)Fe3O4可表示成FeO·Fe2O3,故Fe3O4是由FeO和Fe2O3组成的混合物。( ✕ )
(6)铁的氧化物是金属氧化物,也是碱性氧化物。( ✕ )
(7)[2021湖南]FeO粉末在空气中受热,迅速被氧化成Fe3O4。( √ )
(8)Fe(OH)3胶体具有吸附性,可用作自来水厂的净水剂。( √ )
(9)Fe3O4具有磁性,可用作激光打印机墨粉的添加剂。( √ )
3.(1)常温下,铁在冷的浓硝酸中会发生 钝化 ;加热时,铁可溶于浓硝酸中,写出离子方程式: Fe+6H++3NO3- △ Fe3++3NO2↑+3H2O 。
(2)写出铁与稀硝酸反应的离子方程式。
①少量铁: Fe+4H++NO3- Fe3++NO↑+2H2O ;
②过量铁: 3Fe+8H++2NO3- 3Fe2++2NO↑+4H2O 。
4.写出下列反应的化学方程式。
(1)氧化亚铁与氢碘酸反应: FeO+2HI FeI2+H2O ;
(2)氧化铁与氢碘酸反应: Fe2O3+6HI 2FeI2+I2+3H2O ;
(3)四氧化三铁与氢碘酸反应: Fe3O4+8HI 3FeI2+I2+4H2O 。
5.[铁及其氧化物的计算]将Fe、FeO、Fe2O3的混合物粉末3.44 g 加入含0.1 ml HCl的盐酸中,恰好完全溶解,并收集到气体22.4 mL(标准状况)。向反应后的溶液中滴加KSCN溶液,无明显变化。若将1.72 g该混合物粉末在高温下与足量的CO充分反应,残留固体的质量为 1.4 g。
命题点1 铁及其氧化物的性质和用途
1.[2021江苏]下列有关物质的性质与用途不具有对应关系的是( B )
A.铁粉能与O2反应,可用作食品保存的吸氧剂
B.纳米Fe3O4能与酸反应,可用作铁磁性材料
C.FeCl3具有氧化性,可用于腐蚀印刷电路板上的Cu
D.聚合硫酸铁能水解并形成胶体,可用于净水
解析 B项,Fe3O4也称为磁性氧化铁,可以作铁磁性材料,与其能与酸反应无关,符合题意。
命题点2 铁与水蒸气反应的实验
2.[2023吉林一调]资料显示,在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570 ℃时生成FeO,高于570 ℃时生成Fe3O4。甲、乙两名同学分别用图1和图2所示装置进行纳米级Fe粉与水蒸气反应并验证产物的实验。下列说法错误的是( C )
A.图1装置中湿棉花提供水蒸气,肥皂液用于反应产生气体的收集和后续检验
B.图2装置中实验时应该先点燃C处酒精灯
C.可以使用稀硫酸和酸性高锰酸钾溶液检验图2装置中反应后得到的黑色粉末中含有的
Fe2+
D.实验选用纳米级铁粉,与普通铁粉相比可以提高反应速率
解析 题图1装置中湿棉花提供水蒸气,将高温下水蒸气与Fe反应生成的气体通入肥皂液中会产生气泡,点燃气泡有爆鸣声,证明产生的气体是氢气,故肥皂液用于反应产生气体的收集和后续检验,A项正确;题图2装置中实验时C用于提供水蒸气,为防止加热时Fe与空气中氧气反应,实验时应先点燃C处酒精灯,B项正确;题图2装置中如果铁过量,则过量的铁与稀硫酸反应会生成Fe2+,故使用稀硫酸和酸性高锰酸钾溶液检验出Fe2+,不能说明是题图2装置反应后得到的黑色粉末中含有Fe2+,C项错误;实验中选用纳米级铁粉,增大了固体与水蒸气的接触面积,可提高化学反应速率,D项正确。
考点2 铁的氢氧化物
1.铁的氢氧化物的比较
2.Fe(OH)2的制法
1.易错辨析。
(1)在空气中,白色的Fe(OH)2迅速转变成灰绿色,最终变成红褐色。( √ )
(2)FeCl3溶液滴入热的浓NaOH溶液中可得到Fe(OH)3胶体。( ✕ )
2.请写出下列反应的化学方程式。
(1)Fe(OH)2与稀硝酸的反应:
3Fe(OH)2+10HNO3(稀) 3Fe(NO3)3+NO↑+8H2O ;
(2)Fe(OH)3与稀硝酸的反应:
Fe(OH)3+3HNO3 Fe(NO3)3+3H2O ;
(3)Fe(OH)2与氢碘酸的反应:
Fe(OH)2+2HI FeI2+2H2O ;
(4)Fe(OH)3与氢碘酸的反应:
2Fe(OH)3+6HI 2FeI2+ I2+6H2O 。
3.Fe作阳极、石墨作阴极,电解NaCl溶液可制备Fe(OH)2,装置如左侧图3所示,回答下列问题。
(1)阳极电极反应式为 Fe-2e- Fe2+ 。
(2)苯的作用是 隔绝空气,防止生成的Fe(OH)2被氧化 。
(3)在加入苯之前对电解液应作何简单处理? 加热煮沸,排出溶解的O2 。
命题点 氢氧化亚铁的制备和性质
[浙江高考]某同学设计如图装置(气密性已检查)制备Fe(OH)2白色沉淀。
请回答:
(1)仪器1的名称 分液漏斗 。装置5的作用 液封,防止空气进入装置4 。
(2)实验开始时,关闭K2,打开K1,反应一段时间后,再打开K2,关闭K1,发现3中溶液不能进入4中。请为装置作一处改进,使溶液能进入4中 在装置2、3之间添加控制开关 。
(3)装置改进后,将3中反应后溶液压入4中,在4中析出了灰绿色沉淀。从实验操作过程分析没有产生白色沉淀的原因 装置4中的空气没有排尽 。
解析 (1)仪器1的名称为分液漏斗。由于Fe(OH)2易被氧气氧化,故装置5的作用是通过液封,防止空气进入装置4。(2)3中溶液不能进入4中的原因是生成的氢气沿着导管通过2逸出,三颈烧瓶中无法形成高压,故只需在2、3之间加一个控制开关即可。(3)生成灰绿色沉淀说明氢氧化亚铁被氧化,可能原因是装置4中的空气未排尽。
命题拓展
[设问拓展](1)装置3中发生反应的离子方程式为 Fe+2H+ Fe2++H2↑ 。
(2)写出装置4中涉及的化学方程式: FeSO4+2NaOH Fe(OH)2↓+Na2SO4 、 H2SO4+2NaOH Na2SO4+2H2O 、 4Fe(OH)2+O2+2H2O 4Fe(OH)3 。
技巧点拨
氢氧化亚铁的制备方法
1.[2020上海]常温下,将铁片放到浓硫酸中,下列叙述正确的是( D )
A.溶液呈黄色
B.铁片变轻
C.铁片表面产生大量气泡
D.铁片表面产生致密的氧化膜
解析 常温下,将铁片放到浓硫酸中,铁片钝化,即在铁片的表面生成一层致密的氧化膜,阻止其与浓硫酸继续反应,故溶液不呈黄色,A项错误,D项正确;铁片表面生成氧化物,铁片变重,B项错误;铁片表面不产生大量气泡,C项错误。
2.[性质预测][2022浙江]关于化合物FeO(OCH3)的性质,下列推测不合理的是( B )
A.与稀盐酸反应生成FeCl3、CH3OH、H2O
B.隔绝空气加热分解生成FeO、CO2、H2O
C.溶于氢碘酸(HI),再加CCl4萃取,有机层呈紫红色
D.在空气中,与SiO2高温反应能生成Fe2(SiO3)3
解析 FeO(OCH3)中Fe为+3价,CH3OH中的—OH比H2O中的—OH更难电离,因此FeO(OCH3)水解生成CH3OH,FeO+溶于盐酸生成FeCl3和H2O,A项正确;由物质的化学式可知其C、O原子个数比为1∶2,但题给产物C、O原子个数比不是1∶2,B项错误;FeO(OCH3)将HI氧化为I2,I2溶于CCl4呈紫红色,C项正确;在空气中,FeO(OCH3)与SiO2高温反应能生成硅酸铁,D项正确。
1.下列说法正确的是( A )
A.[2023广东改编]火星全球影像彩图显示了火星表土颜色,表土中赤铁矿主要成分为Fe2O3
B.[2023浙江]常温下铁与浓硝酸反应可制备NO2
C.[2022北京]过量铁粉与稀硝酸反应,产生无色气体:Fe+NO3-+4H+ Fe3++NO↑+2H2O
D.[2022浙江]还原铁粉可用作食品干燥剂
解析 赤铁矿主要成分为Fe2O3,A正确;常温下铁遇浓硝酸钝化,不能制备NO2,B错误;过量铁粉与稀硝酸反应,生成硝酸亚铁、NO和水,离子方程式为3Fe+8H++2NO3- 3Fe2++2NO↑+4H2O,C错误;还原铁粉不能吸收水分,在食品中用作抗氧化剂,D错误。
2.下列有关铁的化合物的说法不正确的是( A )
A.Fe(OH)2不稳定,具有较强的氧化性
B.FeO、Fe2O3均为碱性氧化物,均可与盐酸反应
C.Fe(OH)3可通过化合反应得到,而Fe(OH)2不能
D.Fe3O4具有磁性,可用作激光打印机墨粉的添加剂
解析 Fe(OH)2中的Fe2+具有还原性,易被空气中的O2氧化为Fe(OH)3,A项错误;FeO、Fe2O3均为碱性氧化物,故均具有碱性氧化物的通性,都能与盐酸反应,B项正确;Fe(OH)2只能通过复分解反应得到,Fe(OH)3可由Fe(OH)2与O2、H2O发生化合反应得到,C项正确;Fe3O4是磁性氧化铁,可用作激光打印机墨粉的添加剂,D项正确。
3.[2023上海]已知月球土壤中富含铁元素,其主要以铁单质和亚铁离子的形式存在。但嫦娥五号取回的微陨石撞击处的月壤样品中存在大量的三价铁,这有可能是以下哪个原因造成的( A )
A.4FeO Fe+Fe3O4
B.Fe3O4 Fe2O3+FeO
C.4FeO+O2 2Fe2O3
D.Fe2O3+FeO Fe3O4
解析 由题目信息可知,月球土壤中铁主要以铁单质和亚铁离子形式存在,且月球上没有氧气,故A符合题意。
4.[2024天津耀华中学开学考]下列有关铁及其化合物的说法正确的是( A )
A.铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4
B.在给定条件下,FeCl2点燃FeCl2NaOH(aq)Fe(OH)2所表示的物质间转化能实现
C.氢氧化铁与HI溶液仅能发生中和反应
D.Fe3+极易水解,少量FeCl3与足量Na2S溶液混合会因水解剧烈生成Fe(OH)3沉淀
解析 铁在纯氧中燃烧生成四氧化三铁,铁在高温下和水蒸气反应生成四氧化三铁和氢气,故A正确;铁和氯气反应生成氯化铁,故B错误;氢氧化铁与HI溶液反应的离子方程式为2Fe(OH)3+6H++2I- 2Fe2++I2+6H2O,发生了氧化还原反应,故C错误;Fe3+具有较强的氧化性,少量FeCl3与足量Na2S溶液反应生成硫化亚铁、硫单质,不会因水解反应生成Fe(OH)3沉淀,故D错误。
5.用如图所示装置进行Fe与水蒸气反应的实验(部分夹持装置已略去),下列有关说法不正确的是( B )
A.装置A的作用是为实验提供持续不断的水蒸气
B.装置B中反应的化学方程式是2Fe+3H2O(g) 高温 Fe2O3+3H2
C.装置C中加入的固体干燥剂可能是碱石灰
D.点燃装置D处的气体前必须检验气体的纯度
解析 装置A将液态H2O转化为气态,与装置B中的铁粉在高温下发生反应,A项正确;铁与H2O(g)在高温下发生反应生成 Fe3O4和H2,反应的化学方程式为3Fe+4H2O(g) 高温 Fe3O4+4H2,B项错误;因生成的H2中含有较多的水蒸气,故需要用碱石灰等不与H2反应的干燥剂进行干燥,C项正确;不纯的H2在点燃时可能会发生爆炸,故在点燃H2前必须检验其纯度,D项正确。
6.[山东高考]等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是( A )
A.FeOB.Fe2O3
C.FeSO4D.Fe3O4
解析 FeO、FeSO4及Fe3O4(可写成Fe2O3·FeO)与稀硝酸反应时均为铁元素被氧化,且氧化产物均为Fe3+,还原产物均为NO。等质量的还原剂与稀硝酸反应时转移电子的物质的量越多,放出NO的物质的量越多,由FeO、FeSO4及Fe3O4的化学式及铁元素的化合价可以看出等质量的三种物质参与反应时,FeO转移电子的物质的量最多。Fe2O3与稀硝酸反应时无NO气体放出。
7.用下面两种方法可以制得白色Fe(OH)2沉淀。
方法一:用FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备Fe(OH)2。
(1)除去蒸馏水中溶解的O2常采用 煮沸 的方法。
(2)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面以下,再挤出NaOH溶液。这样操作的理由是 避免生成的Fe(OH)2沉淀接触O2而被氧化 。
方法二:在如图所示装置中,用不含O2的NaOH溶液、铁屑和稀硫酸制备Fe(OH)2。
(3)在试管Ⅰ中加入的试剂是 稀硫酸、铁屑 。
(4)在试管Ⅱ中加入的试剂是 不含O2的NaOH溶液 。
(5)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 检验试管Ⅱ出口处H2的纯度,当排出的H2纯净时,再夹紧止水夹 。
(6)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不易进入装置中 。
解析 方法1:(1)常采用煮沸的方法除去蒸馏水中的O2。(2)题述操作是为了防止滴加NaOH溶液时带入空气,避免生成的Fe(OH)2接触O2。
方法2:试管Ⅱ是开口式的,无法利用产生的气体将溶液压入试管Ⅰ中,所以制取FeSO4应在试管Ⅰ中进行,而在试管Ⅱ中应加入不含O2的NaOH溶液。当把Fe与稀硫酸加入试管Ⅰ中后,打开止水夹,产生的H2可排尽装置内的空气。最后关闭止水夹,试管Ⅰ内产生的H2无法逸出,压强增大,将试管Ⅰ内的FeSO4溶液通过长导管压入试管Ⅱ内,在此过程中,液体处于H2氛围中,Fe(OH)2不易被氧化,能较长时间保持白色。
8.[Fe(OH)2的制备]如图所示装置可用来制取Fe(OH)2 和观察Fe(OH)2在空气中被氧化时的颜色变化。提供的试剂为铁屑、6 ml/L H2SO4溶液、NaOH溶液。下列说法错误的是( B )
A.装置B中盛有一定量的NaOH溶液,装置A中烧瓶内应预先加入的试剂是铁屑
B.实验开始时应先将活塞a关闭
C.生成Fe(OH)2的操作为关闭活塞a,将装置A中的溶液压入装置B中
D.取下装置B中的橡皮塞,使空气进入,沉淀颜色由白色变成灰绿色,最终变成红褐色
解析 制取FeSO4需要铁屑和稀硫酸,所以装置A中烧瓶内应预先加入铁屑,装置B中应盛放NaOH溶液,A项正确;实验开始时要先排尽装置内的空气,应先打开活塞a, B项错误;装置内的空气排尽后,关闭活塞a,装置A中压强逐渐增大,将FeSO4溶液压入装置B中,与NaOH溶液反应生成Fe(OH)2,C项正确;白色的Fe(OH)2不稳定,容易被溶解在溶液中的O2氧化,变为灰绿色,最终变成红褐色的Fe(OH)3,D项正确。
9.[2024黑龙江大庆中学开学考]某兴趣小组的同学们利用如图所示的装置对CO还原Fe2O3粉末的实验进行探究(夹持装置等略)。
【查阅资料】CO能溶于铜液。
(1)按如图连接装置A-E,在装入试剂前,先 检查装置的气密性 。
(2)写出装置B中反应的化学方程式: CO2+2NaOH Na2CO3+H2O 。
(3)通入CO2一段时间后,先点燃装置 A (填“A”或“D”)处酒精喷灯。
(4)反应一段时间后,能证明CO与Fe2O3反应的实验现象是 装置D中玻璃管内红色固体变成黑色,装置E中澄清的石灰水变浑浊 ;写出装置D中反应的化学方程式: 3CO+Fe2O3 高温 2Fe+3CO2 。
(5)某同学认为该装置有缺陷,需在装置E后再连接装置F,其目的是 吸收一氧化碳 。装置E、F的接口连接顺序:a连接c(填“b”或“c”)。
解析 装置A中二氧化碳和炭粉在高温下反应生成CO,装置B可除去CO2,装置C可除去H2O,装置D中CO与Fe2O3反应,装置E用来检验反应产物中是否有CO2。(1)反应开始前要检查装置的气密性。(2)装置B中氢氧化钠溶液与CO2反应,除去CO2,其化学方程式为CO2+2NaOH Na2CO3+H2O。(3)该装置是先让二氧化碳和炭粉反应生成一氧化碳,一氧化碳再与氧化铁反应,因此先点燃装置A处酒精喷灯。(4)CO和Fe2O3反应生成Fe和CO2,化学方程式为3CO+Fe2O3 高温 2Fe+3CO2,实验现象是装置D中玻璃管内红色固体变为黑色,装置E中澄清石灰水变浑浊。(5)CO有毒,该实验缺少尾气处理装置,因此需要加上装置F吸收一氧化碳,一氧化碳从c口进入,确保一氧化碳和铜液充分接触。
10.[氢氧化亚铁制备原理的迁移应用][全国Ⅰ高考]醋酸亚铬[(CH3COO)2Cr·2H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示。回答下列问题:
(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是 去除水中溶解氧 。仪器a的名称是 分液(或滴液)漏斗 。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置。打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为 Zn+2Cr3+ Zn2++2Cr2+ 。
②同时c中有气体产生,该气体的作用是 排除c中空气 。
(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是 c中产生H2使压强大于大气压 ;d中析出砖红色沉淀。为使沉淀充分析出并分离,需采用的操作是 (冰浴)冷却 、 过滤 、洗涤、干燥。
(4)指出装置d可能存在的缺点 敞开体系,可能使醋酸亚铬与空气接触 。
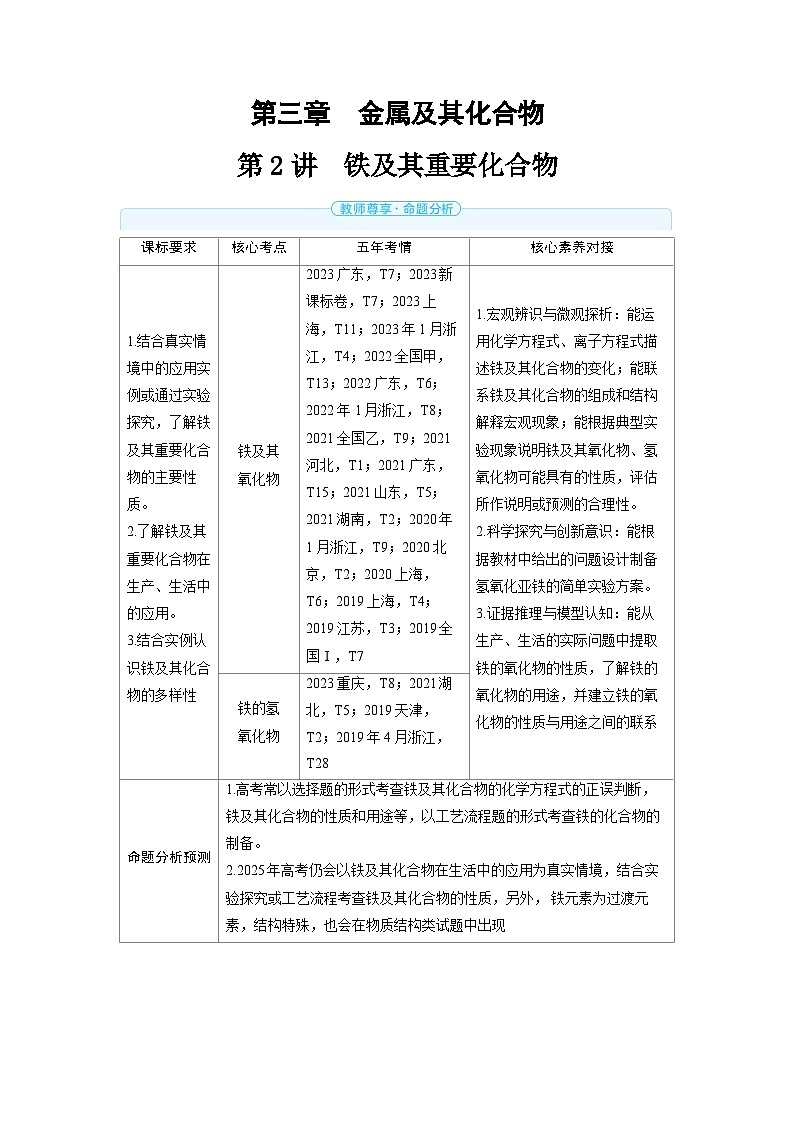
解析 (1)审题时抓住醋酸亚铬“在气体分析中用作氧气吸收剂”,这暗示醋酸亚铬具有强还原性,易被氧气氧化,故该实验中使用的蒸馏水必须去除溶解氧。(2)①依题意可知,c中溶液由绿色逐渐变为亮蓝色,主要是由于锌与铬离子反应生成亚铬离子和锌离子,即Zn+2Cr3+ Zn2++2Cr2+。②c中产生的气体为氢气,该气体主要用于排尽装置内的空气,避免O2氧化Cr2+。(3)c中有氢气产生,打开K3,关闭K1和K2后,c中压强大于外界压强,从而将c中溶液压入醋酸钠溶液中。析出并分离产品的操作是冷却、过滤、洗涤、干燥。(4)观察d装置,可发现其与空气相通,这会导致生成的醋酸亚铬被O2氧化。课标要求
核心考点
五年考情
核心素养对接
1.结合真实情境中的应用实例或通过实验探究,了解铁及其重要化合物的主要性质。
2.了解铁及其重要化合物在生产、生活中的应用。
3.结合实例认识铁及其化合物的多样性
铁及其
氧化物
2023广东,T7;2023新课标卷,T7;2023上海,T11;2023年1月浙江,T4;2022全国甲,T13;2022广东,T6;2022年1月浙江,T8;2021全国乙,T9;2021河北,T1;2021广东,T15;2021山东,T5;2021湖南,T2;2020年1月浙江,T9;2020 北京,T2;2020上海,T6;2019上海,T4;2019江苏,T3;2019全国Ⅰ,T7
1.宏观辨识与微观探析:能运用化学方程式、离子方程式描述铁及其化合物的变化;能联系铁及其化合物的组成和结构解释宏观现象;能根据典型实验现象说明铁及其氧化物、氢氧化物可能具有的性质,评估所作说明或预测的合理性。
2.科学探究与创新意识:能根据教材中给出的问题设计制备氢氧化亚铁的简单实验方案。
3.证据推理与模型认知:能从生产、生活的实际问题中提取铁的氧化物的性质,了解铁的氧化物的用途,并建立铁的氧化物的性质与用途之间的联系
铁的氢
氧化物
2023重庆,T8;2021湖北,T5;2019天津,T2;2019年4月浙江,T28
命题分析预测
1.高考常以选择题的形式考查铁及其化合物的化学方程式的正误判断,铁及其化合物的性质和用途等,以工艺流程题的形式考查铁的化合物的制备。
2.2025年高考仍会以铁及其化合物在生活中的应用为真实情境,结合实验探究或工艺流程考查铁及其化合物的性质,另外, 铁元素为过渡元素,结构特殊,也会在物质结构类试题中出现
颜色、状态
导电性、导热性、延展性
特性
[1] 银白 色固体或[2] 灰黑色 粉末
良好
[3]易被 磁铁 吸引
与非金属单质反应
Cl2
[8] 2Fe+3Cl2 △ 2FeCl3
O2
[9] 3Fe+2O2 点燃 Fe3O4
S
[10] Fe+S △ FeS
与水蒸气反应
[11] 3Fe+4H2O(g) 高温 Fe3O4+4H2
与H+反应
Fe+2H+ Fe2++H2↑
与盐溶液反应
Fe+Cu2+ [12] Fe2++Cu
Fe+2Fe3+ [13] 3Fe2+
物质
FeO
(氧化亚铁)
Fe2O3
(氧化铁)
Fe3O4(FeO·Fe2O3)
(四氧化三铁)
俗名
无
[14] 铁红
磁性氧化铁
铁元素
的化合价
[15] +2
[16] +3
[17] +2、+3
色、态及用途
黑色粉末,用作色素,如应用于瓷器制作中使釉呈绿色
[18] 红棕色粉末 ,常用作油漆、涂料、油墨的红色颜料
黑色晶体,常用作磁性材料
化学性质
与非氧化
性强酸反应
FeO+2H+ [19] Fe2++H2O
Fe2O3+6H+ [20] 2Fe3++3H2O
Fe3O4+8H+ [21] Fe2++2Fe3++4H2O
与氧化性
酸反应(如稀HNO3)
[22] 3FeO+10HNO3(稀) 3Fe(NO3)3+NO↑+5H2O
[23] Fe2O3+6HNO3(稀) 2Fe(NO3)3+3H2O
[24] 3Fe3O4+28HNO3(稀) 9Fe(NO3)3+NO↑+14H2O
与CO反
应(炼铁
原理)
[25] FeO+CO 高温 Fe+CO2
[26] Fe2O3+3CO 高温 2Fe+3CO2
[27] Fe3O4+4CO 高温 3Fe+4CO2
物质
Fe(OH)2
Fe(OH)3
色、态
[1] 白色 固体
[2] 红褐色 固体
与稀盐
酸反应
[3] Fe(OH)2+2HCl FeCl2+2H2O
[4] Fe(OH)3+3HCl FeCl3+3H2O
热稳定性
不稳定:Fe(OH)2 △ FeO+H2O(隔绝空气)
不稳定:2Fe(OH)3 △ Fe2O3+3H2O
制法
可溶性碱与亚铁盐溶液反应
可溶性碱与铁盐溶液反应
转化
化学方程式为[5] 4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3 ;
颜色变化:[6] 白色 →[7] 灰绿色 →[8] 红褐色
图1 有机层覆盖法
先在新制FeSO4溶液液面上覆盖一层苯或煤油(不能CCl4),
然后将吸有NaOH溶液的胶头滴管插到FeSO4溶液液面以下并挤出NaOH溶液,该方法可以防止空气与[9] Fe(OH)2 接触发生反应
图2 还原性气体保护法
先在左侧试管中生成FeSO4溶液,并利用生成的H2将装置内的[10] 空气 排尽后,再将[11] FeSO4 溶液压入右侧试管中与NaOH溶液混合,这样可长时间观察到白色沉淀
图3 电解法
用铁作阳极,电解NaCl溶液或NaOH稀溶液,并在液面上覆盖一层苯或煤油
2024届高考化学一轮复习教案 12 第三章 第11讲 铁及其重要化合物: 这是一份2024届高考化学一轮复习教案 12 第三章 第11讲 铁及其重要化合物,共16页。
高考化学一轮复习第4章非金属及其化合物第2讲氯及其重要化合物教案: 这是一份高考化学一轮复习第4章非金属及其化合物第2讲氯及其重要化合物教案,共16页。
高考化学一轮复习第3章金属及其化合物第3讲铁及其重要化合物教案: 这是一份高考化学一轮复习第3章金属及其化合物第3讲铁及其重要化合物教案,共21页。












