
湖北省武汉市2025届高三上学期9月第一次调研考试+化学试题
展开化 学 试 卷
2024.9.6
本试题卷共8页,19题。全卷满分100分。考试用时75 分钟。
祝考试顺利
注意事项:
1. 答题前,先将自己的姓名、准考证号填写在试卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2. 选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。写在试卷、草稿纸和答题卡上的非答题区域均无效。
3. 非选择题的作答:用黑色签字笔直接答在答题卡上对应的答题区域内。写在试卷、草稿纸和答题卡上的非答题区域均无效。
4. 考试结束后,请将本试卷和答题卡一并上交。
可能用到的相对原子质量. H 1 C 12 N 14 O 16 Na23
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学物质在“医”“食”“住”“行”方面用途广泛。下列说法错误的是
A. BaSO₄可作医疗“钡餐” B.谷氨酸钠可作食品防腐剂
C.熟石灰可用于粉刷墙壁 D.乙二醇可用于汽车防冻液
2.“中国制造”走进了充满科技与浪漫的巴黎奥运会。下列属于新型无机非金属材料的是
A.足球内胆中植入的芯片 B.乒乓球的比赛用球所采用的ABS树脂
C.“PARIS 2024”手环所采用的硅橡胶 D.我国运动员领奖服所利用的再生纤维
3.下列各组物质的鉴别方法中,不可行的是
A.真丝和涤纶:灼烧,闻气味 B. CO₂和SO₂:通入澄清石灰水中
C.水晶和玻璃:X射线衍射实验 D.苯和甲苯:加入酸性 KMnO₄ 溶液
4.实验室中利用右图装置可准确测量气体体积。下列说法错误的是
A.使用前需检查装置气密性
B.可用于测量 NO气体体积
C.量气管直径越小测量越精准
D.水准管液面高于量气管液面时读数
5.下列有关含氯物质的化学用语表达正确的是
A.次氯酸的结构式:H— Cl—O B.水合氯离子的示意图:
C. ClO₃的VSEPR 模型: D. H— Cl的共价键类型:s-sσ键
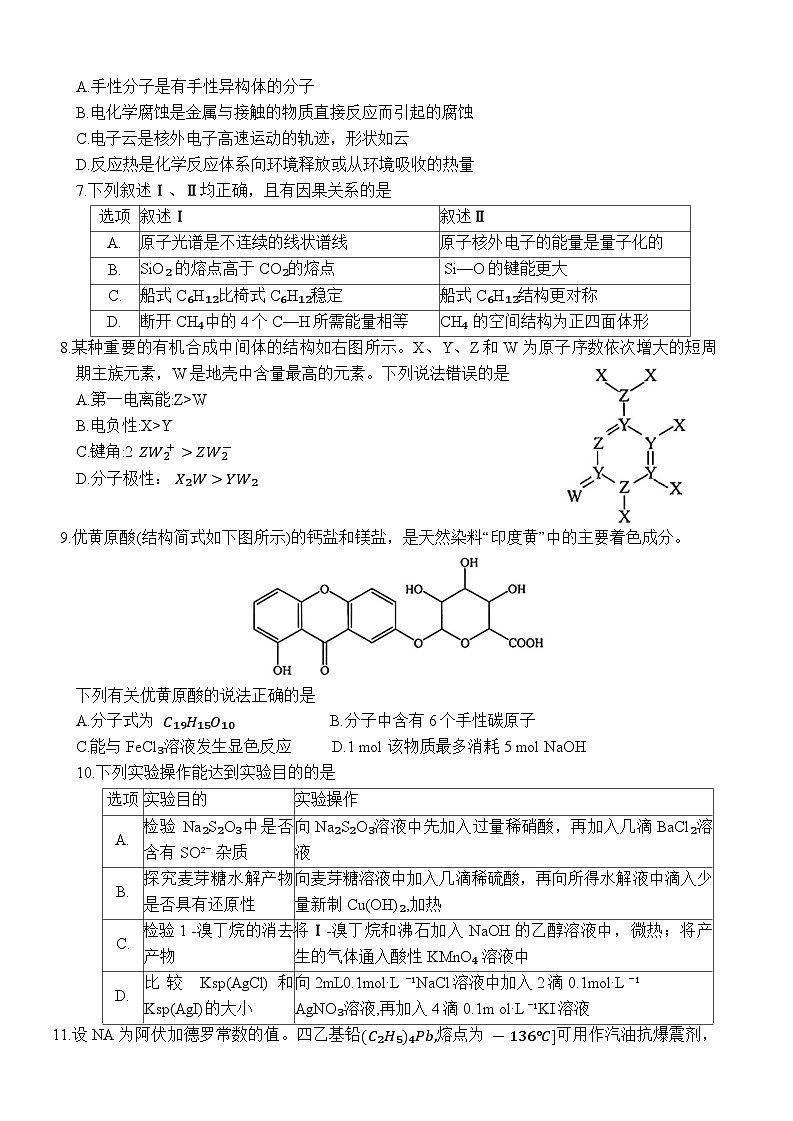
6.理清基本概念是化学学习的基础。下列说法正确的是
A.手性分子是有手性异构体的分子
B.电化学腐蚀是金属与接触的物质直接反应而引起的腐蚀
C.电子云是核外电子高速运动的轨迹,形状如云
D.反应热是化学反应体系向环境释放或从环境吸收的热量
7.下列叙述Ⅰ、Ⅱ均正确,且有因果关系的是
8.某种重要的有机合成中间体的结构如右图所示。X、Y、Z和 W 为原子序数依次增大的短周期主族元素,W是地壳中含量最高的元素。下列说法错误的是
A.第一电离能:Z>W
B.电负性:X>Y
C.键角:2 ZW2+>ZW2-
D.分子极性: X₂W>YW₂
9.优黄原酸(结构简式如下图所示)的钙盐和镁盐,是天然染料“印度黄”中的主要着色成分。
下列有关优黄原酸的说法正确的是
A.分子式为 C₁₉H₁₅O₁₀ B.分子中含有6个手性碳原子
C.能与FeCl₃溶液发生显色反应 D.1 ml该物质最多消耗5 ml NaOH
10.下列实验操作能达到实验目的的是
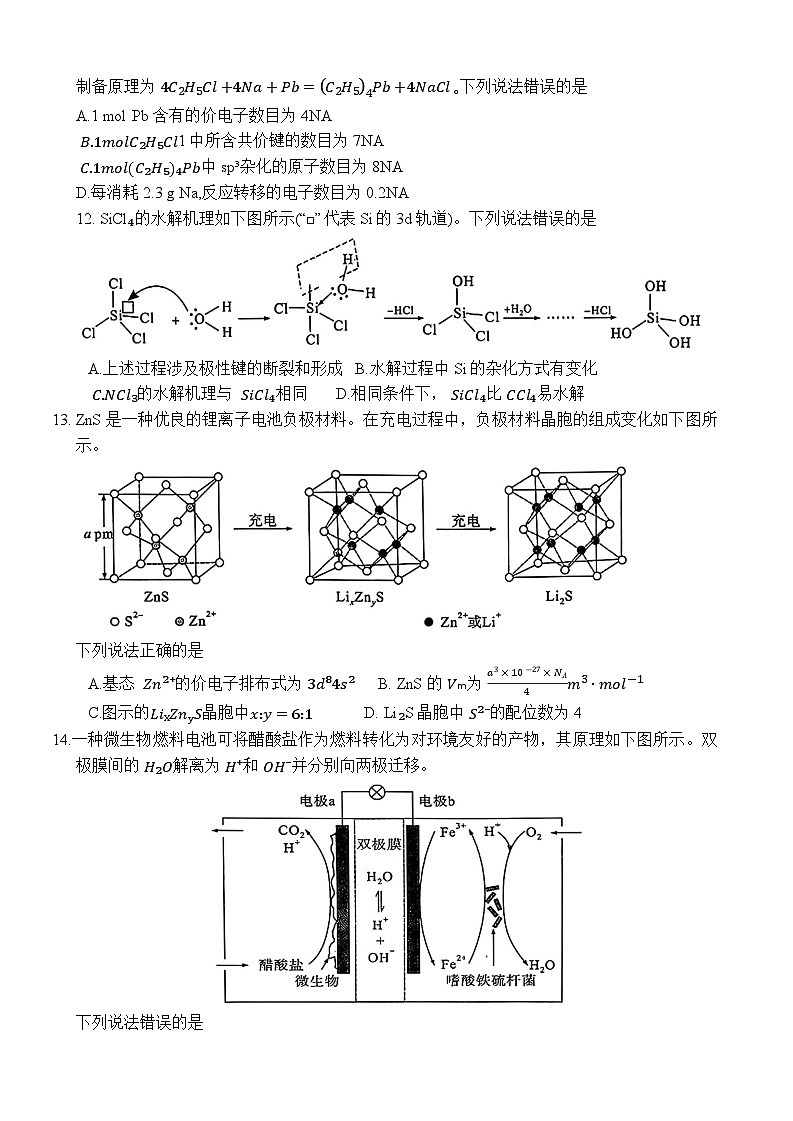
11.设NA 为阿伏加德罗常数的值。四乙基铅C₂H₅₄Pb,熔点为 -136°C]可用作汽油抗爆震剂,制备原理为 4C2H5Cl+4Na+Pb=C2H54Pb+4NaCl∘下列说法错误的是
A.1 ml Pb 含有的价电子数目为4NA
B.1mlC₂H₅Cl1中所含共价键的数目为7NA
C.1mlC₂H₅₄Pb中sp³杂化的原子数目为8NA
D.每消耗2.3 g Na,反应转移的电子数目为0.2NA
12. SiCl₄的水解机理如下图所示(“□”代表 Si的3d轨道)。下列说法错误的是
A.上述过程涉及极性键的断裂和形成 B.水解过程中 Si的杂化方式有变化
C.NCl₃的水解机理与 SiCl₄相同 D.相同条件下, SiCl₄比 CCl₄易水解
13. ZnS是一种优良的锂离子电池负极材料。在充电过程中,负极材料晶胞的组成变化如下图所示。
下列说法正确的是
A.基态 Zn²⁺的价电子排布式为 3d⁸4s² B. ZnS的 Vₘ为 a3×10-27×NΛ4m3⋅ml-1
C.图示的LixZnyS晶胞中x:y=6:1 D. Li₂S晶胞中 S²⁻的配位数为4
14.一种微生物燃料电池可将醋酸盐作为燃料转化为对环境友好的产物,其原理如下图所示。双极膜间的 H₂O解离为 H⁺和 OH⁻并分别向两极迁移。
下列说法错误的是
A.电极b的电势高于电极a的电势
B.电池工作时,双极膜中 H⁺向电极a迁移
C.电极a的反应为: CH₃COO⁻-8e⁻+2H₂O=2CO₂↑+7H⁺
D.理论上,消耗的醋酸根与氧气的物质的量之比为1:2
15.在水溶液中,CN⁻可与C²⁺和 C³⁺分别形成配离子 M和N。配离子的通式为 CCNₓʸ⁻,其中N的稳定性更强。达到平衡时, lgcC2+eM、lgcC3+cN与 -lgcCN-的关系如下图所示。
下列说法错误的是
A.曲线①代表 lgcC2+cM与 -lgcCN-的关系
B.配离子 M和配离子 N中的配位数相同
C.向配离子M的溶液中加入适量 C³⁺,M能完全转化为N
%的 C²⁺、C³⁺分别转化为配离子时,后者溶液中 CN⁻的平衡浓度更大
二、非选择题:本题共4小题,共55分。
16.(14分)
氧化铍是一种重要的化工原料,可用于制造陶瓷、玻璃和有机反应催化剂。工业上利用绿柱石(主要含有3BeO·Al₂O₃·6SiO₂,还含有FeO和 Fe₂O₃3等杂质)制备氧化铍的工艺流程如下图所示。
已知“熔炼”时发生反应:
3eO⋅Al₂O₃⋅6Si0₂+2CaO=CaO⋅Al₂O₃⋅3Si0₂+CaO⋅3Be0⋅Si0₂+2Si02。
回答下列问题:
(1)绿柱石无法直接酸浸溶解是由于其晶体结构具有特殊性。则“熔炼”时加入生石灰的目的是 。
(2)“滤渣1”的主要成分是 (填化学式)。
(3)“滤渣2”的主要成分是 NH₄AlSO₄₂⋅12H₂O。检验其中是否含有 Fe³⁺的操作:先将“滤渣2”加水溶解,再滴加 ,若溶液不变红,则说明“滤渣2”中无 Fe³⁺。
(4)“氧化除杂”中发生反应的离子方程式分别为 , 。
(5)在常温下,Be²⁺完全沉淀时,溶液的pH为5.9,则 KₛₚBeOH₂= 。
(6)“沉铍”时不宜使用NaOH 溶液的理由是 (用离子方程式表示)。
(7)氯化铍在气态时存在二聚体分子 BeCl₂₂,,其中 Be 的杂化方式为: sp²杂化,则二聚体分子的结构为 。
17.(14分)
苦杏仁酸 是一种医药中间体,可用于合成阿洛托品类解痉剂。实验室制备苦杏仁酸的原理、步骤和装置(加热装置已略去)如下。
步骤Ⅰ:向图1的三颈烧瓶中加入10.6g 苯甲醛、1.3g TEBA和24.0 g CHCl₃(过量),搅拌并加热,同时滴加足量的NaOH溶液,反应一段时间。
步骤Ⅱ:将步骤Ⅰ所得混合物冷却,倒入200 mL 水中,用乙醚萃取,弃去有机层;向水层中加入稀硫酸酸化;继续利用乙醚萃取4次,合并萃取液;加入无水硫酸钠。
步骤Ⅲ:在常压下,利用图2装置蒸去乙醚,得到粗产品。
回答下列问题:
(1)X的名称为 ;图1和图2中的冷凝管 互换(填“能”或“不能”)。
(2)步骤Ⅱ中第一次用乙醚萃取的目的是 ;加入无水硫酸钠的作用是 。
(3)将步骤Ⅲ补齐:安装蒸馏装置,加入待蒸馏的物质和沸石, , ,弃去前馏分,收集产品。
(4)为了提高粗产品的纯度,后续还可采用的方法是 ;若最终获得11.2g苦杏仁酸样品,则实验室制备苦杏仁酸的产率最接近 (填标号)。
A.85% B.75% C.65% D.55%
(5)TEBA是一种离子液体,其结构简式是不直接参与化学反应,但能增大反应速率,其可能原因是 (从溶解度的角度解释)。
18.(14分)
有机盐H是一种药物合成的中间体,其合成路线如下图所示。
回答下列问题:
(1)A的化学名称为 ,A→B反应所需的试剂和条件为 。
(2)D→E反应过程中NaOH的作用是 。
(3)F→G 的反应类型为 。
(4)M中含氧官能团的名称为 。
(5)根据G→H的原理,分析D与苯甲酸无法直接反应制得E的原因 。
(6)C的同分异构体中,同时满足下列条件的共有 种。
a.含有苯环;
b.含有sp杂化的碳原子。
19.(13分)
CH₄-CO₂催化重整是实现“碳中和”的一种理想的CO₂利用技术,具有广阔的市场前景和经济、社会价值。该过程中涉及的反应如下。
反应I: CH₄g+CO₂g⇌2COg+2H₂g △H₁
反应Ⅱ: CO₂g+H₂g⇌COg+H₂Og △H₂=+41kJ⋅ml⁻1
反应Ⅲ: CH₄g⇌Cs+2H₂g △H₃=+75kJ⋅ml⁻¹
反应Ⅳ: CO₂g+Cs⇌2COg △H₄=+172kJ⋅ml⁻¹
回答下列问题:
1ΔH₁= kJ⋅ml⁻¹。
(2)有利于提高平衡时CH₄转化率的条件是 (填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(3)该过程中,催化剂的活性会因积碳而降低。在使用不同催化剂时,反应Ⅲ和Ⅳ活化能的相关数据如下表所示。
催化剂M N(填“优于”或“劣于”),其理由是 。
(4)100 kPa,以CH₄ 和CO₂的起始总物质的量为2.0 ml, nCO2nCH4分别为0.5、1.0、2.0和3.0投料,反应温度对积碳量的影响如下图所示。
①在 573K∼853K、nCO2nCH4=0.5时,积碳量随着温度的升高而增大的理由是 。
= 2 \* GB3 ②nCO2nCH4=3.0的曲线是 (填“a”“b”或“c”)。
(5)在1273 K和100 kPa下,向密闭容器中,充入CO₂和CH₄各1.0 ml进行反应(仅发生反应Ⅰ和Ⅱ)。达到平衡时,CH₄的转化率为80%,CO₂的转化率为90%,则反应Ⅰ的压强平衡常数 Kₚ= kPa²(列出计算式。已知:分压=总压×该组分物质的量分数)。
选项
叙述Ⅰ
叙述Ⅱ
A.
原子光谱是不连续的线状谱线
原子核外电子的能量是量子化的
B.
SiO₂ 的熔点高于CO₂的熔点
Si—O的键能更大
C.
船式C₆H₁₂比椅式C₆H₁₂稳定
船式C₆H₁₂结构更对称
D.
断开CH₄中的4个C—H所需能量相等
CH₄ 的空间结构为正四面体形
选项
实验目的
实验操作
A.
检验 Na₂S₂O₃中是否含有SO²⁻ 杂质
向 Na₂S₂O₃溶液中先加入过量稀硝酸,再加入几滴BaCl₂溶液
B.
探究麦芽糖水解产物是否具有还原性
向麦芽糖溶液中加入几滴稀硫酸,再向所得水解液中滴入少量新制 Cu(OH)₂,加热
C.
检验1 -溴丁烷的消去产物
将Ⅰ-溴丁烷和沸石加入 NaOH的乙醇溶液中,微热;将产生的气体通入酸性 KMnO₄ 溶液中
D.
比较 Ksp(AgCl)和 Ksp(AgI)的大小
向2mL0.1ml·L⁻¹NaCl溶液中加入2滴0.1ml·L⁻¹
AgNO₃溶液,再加入4滴0.1m l·L⁻¹KI溶液
催化剂
活化能(kJ·ml⁻¹)
反应Ⅲ
反应Ⅳ
M
43
72
N
33
91
湖北省武汉市2025届高三上学期9月调研考试+化学试卷: 这是一份湖北省武汉市2025届高三上学期9月调研考试+化学试卷,共4页。
湖北省武汉市2025届高三上学期9月调研考试+化学试卷(无答案): 这是一份湖北省武汉市2025届高三上学期9月调研考试+化学试卷(无答案),共8页。试卷主要包含了选择题的作答,非选择题的作答,理清基本概念是化学学习的基础,下列实验操作能达到实验目的的是等内容,欢迎下载使用。
湖北省武汉市2025届高三上学期9月调研考试+化学试卷: 这是一份湖北省武汉市2025届高三上学期9月调研考试+化学试卷,共4页。












