




高考化学一轮复习基础知识讲义专题三考点五 离子检验与推断(2份打包,原卷版+解析版)
展开【必备知识】
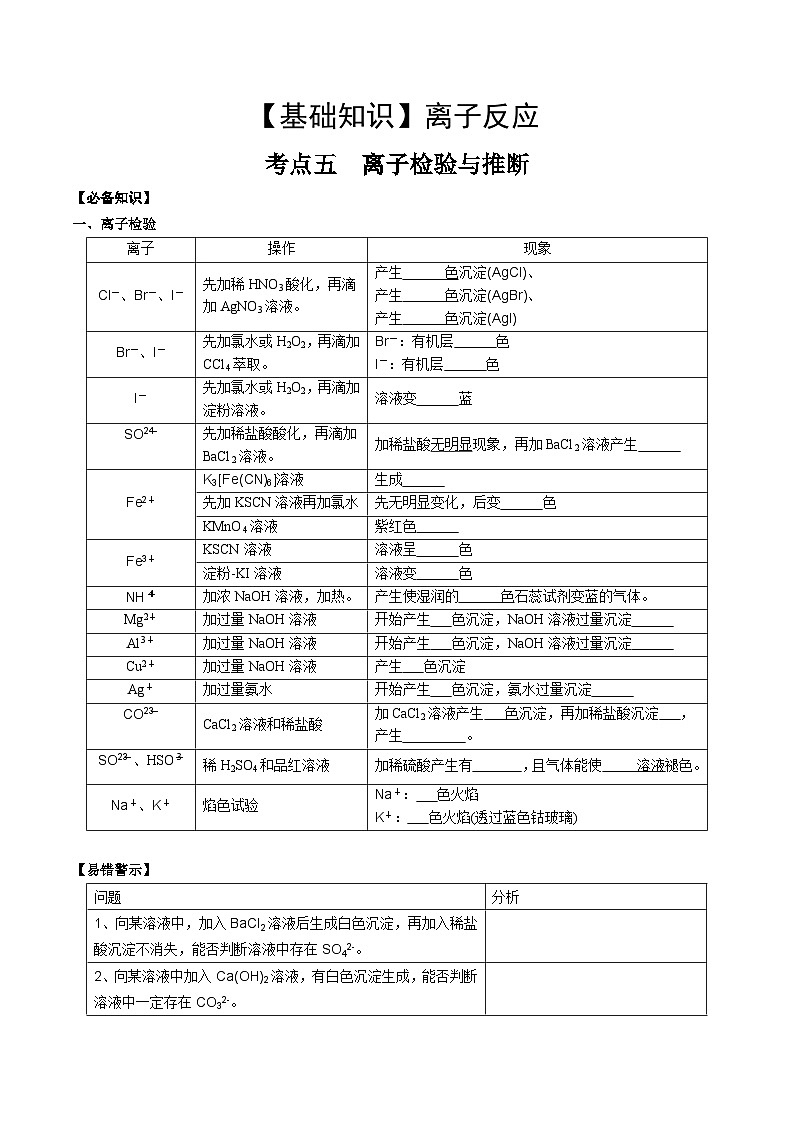
一、离子检验
【易错警示】
【拓展】离子检验操作答题模版
①实验操作(取少量或适量待检溶液于试管中,加入……试剂,再加入……试剂)
②现象描述(①溶液由……变为……,②有……生成,③没有……等)
③得出结论(如“若……说明……,若……说明……”)
例、在三草酸合铁酸钾的热分解产物含有FeO和Fe2O3,检验Fe2O3存在的方法是:
__________________________________________。
【答案】取少量产品溶于足量稀盐酸,加入KSCN溶液,若溶液呈血红色,说明存在Fe2O3。
例、结晶析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论_________________________________________。
已知Na2S2O3·5H2O遇酸易分解:S2O32-+2H+===S↓+SO2↑+H2O。
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液。
【答案】 取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤,取滤液)于一试管中,滴加BaCl2溶液,若产生白色沉淀则说明含有Na2SO4杂质(合理即可)
例、榴石矿石可以看作由CaO、FeO、Fe2O3、Al2O3、SiO2组成。试设计实验证明榴石矿石中含有FeO(试剂任选,说明实验操作与现象):________________________________________。
【答案】取矿石少许,加稀硫酸充分溶解后,向其中滴加酸性高锰酸钾溶液,若紫色褪去,证明矿石中含有FeO(不能加盐酸溶解)
例、(2014江苏卷)已知:5SO32-+2IO3-+2H+===I2+5SO42-+H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3-的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在,然后_____________________________________________。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。
【答案】 从水层取少量溶液,加入1~2mL淀粉溶液,加盐酸酸化,滴加FeCl3溶液,若溶液变蓝,说明废水中含有I-,另从水层取少量溶液加入1~2mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明废水中含IO3-。
例、(NH4)2SO4是常用的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
[查阅资料](NH4)2SO4在260 ℃和400 ℃时分解产物不同。
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)。
连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400 ℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SOeq \\al(2-,3),无SOeq \\al(2-,4)。进一步研究发现,气体产物中无氮氧化物。
检验装置D内溶液中有SOeq \\al(2-,3)而无SOeq \\al(2-,4)的实验操作和现象是_________________________。
【答案】 取少量装置D内溶液于试管中,滴加BaCl2溶液,生成白色沉淀,加入足量稀盐酸后,沉淀完全溶解,放出无色有刺激性气味的气体
例、(2020·江苏卷)设计以FeSO4溶液、氨水- NH4HCO3混合溶液为原料,制备FeCO3的实验方案:______________。【FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5】。
【答案】在搅拌下向FeSO4溶液中缓慢加入氨水-NH4HCO3混合溶液,控制溶液pH不大于6.5;静置后过滤,所得沉淀用蒸馏水洗涤2~3次;取最后一次洗涤后的滤液,滴加盐酸酸化的BaCl2溶液,不出现白色沉淀。
二、离子推断的“四原则”
(1)肯定原则:根据实验现象,推出肯定存在或肯定不存在的离子。
(2)互斥原则:即相互反应的离子不能大量共存。
(3)进出原则:即加入试剂时带入(“进”)的离子和发生反应时消耗(“出”)的离子,对后续实验是否有影响。
(4)守恒原则:即溶液中电荷守恒。
例、某溶液可能含有等物质的量的Ba2+、Na+、NHeq \\al(+,4)、H+、Cl-、I-、SOeq \\al(2-,3)、SOeq \\al(2-,4)中的几种,向该溶液中滴加少量新制氯水,所得溶液为无色。判断不正确的是( )
A.肯定不含NHeq \\al(+,4) B.肯定不含H+ C.肯定含有SOeq \\al(2-,3) D.肯定不含Cl-
【答案】 A
例、一瓶无色澄清的溶液,其中可能含有H+、NHeq \\al(+,4)、Na+、Al3+、Fe3+、I-、NOeq \\al(-,3)、COeq \\al(2-,3)、SOeq \\al(2-,4)、[Al(OH)4](或AlOeq \\al(-,2))-。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性 ②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色 ③该溶液的焰色试验没有黄色;根据以上实验结果,下列推断正确的是( )
A.向该溶液中加入BaCl2溶液不一定能观察到白色沉淀
B.可以确定没有Na+、Fe3+、COeq \\al(2-,3)、[Al(OH)4]-(或AlOeq \\al(-,2)),不能确定是否有NOeq \\al(-,3)
C.该溶液可能是NH4NO3与HI的混合 D.一定没有Al3+、COeq \\al(2-,3)和NOeq \\al(-,3)
【答案】 A
【解析】 不能确定是否含SOeq \\al(2-,4),则向该溶液中加入BaCl2溶液不一定能观察到白色沉淀,故A正确;一定不含Na+、Fe3+、NOeq \\al(-,3)、COeq \\al(2-,3)、[Al(OH)4]-(或AlOeq \\al(-,2))-,故B、C错误;不能确定是否含Al3+,故D错误。
【跟踪练习】
1、(2023·湖南卷)取一定体积的两种试剂进行反应,改变两种试剂的滴加顺序(试剂浓度均为0.1 ml·L-1),反应现象没有明显差别的是( )
【答案】D
【解析】A.向氨水中滴加AgNO3溶液并振荡,由于开始时氨水过量,振荡后没有沉淀产生,发生的反应为;向AgNO3溶液中滴加氨水并振荡,开始时生成白色沉淀且沉淀逐渐增多,发生的反应为;当氨水过量后,继续滴加氨水沉淀逐渐减少直至沉淀完全溶解,发生的反应为,因此,改变两种试剂的滴加顺序后反应现象有明显差别,A不符合题意;
B.向NaOH中滴加Al2(SO4)3溶液并振荡,由于开始时NaOH过量,振荡后没有沉淀产生,发生的反应为;向Al2(SO4)3溶溶液中滴加NaOH并振荡,开始时生成白色沉淀且沉淀逐渐增多,发生的反应为;当NaOH过量后,继续滴加NaOH沉淀逐渐减少直至沉淀完全溶解,发生的反应为,因此,改变两种试剂的滴加顺序后反应现象有明显差别,B不符合题意;
C.向H2C2O4溶液中滴加酸性KMnO4溶液并振荡,由于开始时H2C2O4是过量的,KMnO4可以被H2C2O4完全还原,可以看到紫红色的溶液褪为无色,发生的反应为;向KMnO4溶液中滴加酸性H2C2O4溶液并振荡,由于开始时KMnO4是过量的,KMnO4逐渐被H2C2O4还原,可以看到紫红色的溶液逐渐变浅,最后变为无色,因此,改变两种试剂的滴加顺序后反应现象有明显差别,C不符合题意。
2、(2022·全国乙卷,9)某白色粉末样品,可能含有Na2SO4、Na2SO3、Na2S2O3和Na2CO3。取少量样品进行如下实验:
①溶于水,得到无色透明溶液;②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出,离心分离;③取②的上层清液,向其中滴加BaCl2溶液有沉淀生成。
该样品中确定存在的是( )
A.Na2SO4、Na2S2O3 B.Na2SO3、Na2S2O3
C.Na2SO4、Na2CO3 D.Na2SO3、Na2CO3
【答案】 A
【解析】 向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出,说明固体中存在Na2S2O3,发生反应:S2Oeq \\al(2-,3)+2H+===S↓+H2O+SO2↑,由于盐酸过量,向②的上层清液中滴加BaCl2溶液,有沉淀生成,则沉淀为BaSO4,说明固体中存在Na2SO4,不能确定是否有Na2SO3和Na2CO3,Na2SO3、Na2CO3与过量稀盐酸反应的现象可以被Na2S2O3与过量稀盐酸反应的现象覆盖掉。
3、(2022·广东,4)实验室进行粗盐提纯时,需除去Ca2+、Mg2+和SOeq \\al(2-,4),所用试剂包括BaCl2以及( )
A.Na2CO3、NaOH、HCl B.Na2CO3、HCl、KOH
C.K2CO3、HNO3、NaOH D.Na2CO3、NaOH、HNO3
【答案】 A
【解析】 粗盐提纯时,用NaOH除去Mg2+,用BaCl2除去SOeq \\al(2-,4),用Na2CO3除去Ca2+及多余的Ba2+,最后用盐酸除去多余的COeq \\al(2-,3)、OH-。
4、(2020·全国卷Ⅱ,8)某白色固体混合物由NaCl、KCl、MgSO4、CaCO3中的两种组成,进行如下实验:①混合物溶于水,得到澄清透明溶液;②做焰色试验,通过钴玻璃可观察到紫色;③向溶液中加碱,产生白色沉淀。根据实验现象可判断其组成为( )
A.KCl、NaCl B.KCl、MgSO4 C.KCl、CaCO3 D.MgSO4、NaCl
【答案】 B
【解析】 由信息①得到澄清透明溶液,可排除碳酸钙;由信息②焰色试验透过钴玻璃可观察到紫色,说明含有钾离子,可推测含有氯化钾;由信息③向溶液中加入碱产生白色沉淀,可推测含有硫酸镁,所以B正确。
5、下列离子在未知溶液中的检验方法正确的是( )
【答案】 D
【解析】 A项,HCOeq \\al(-,3)会产生干扰,错误;B项,SOeq \\al(2-,3)会产生干扰,错误;C项,使酸性高锰酸钾溶液褪色的不一定是Fe2+,如SOeq \\al(2-,3)等,错误;D项,新制氯水能把I-氧化成I2,淀粉遇碘变蓝,因此可以检验I-的存在,正确。
6、通过实验得出的结论正确的是( )
A.将某固体试样完全溶于盐酸,再滴加Ba(NO3)2溶液,出现白色沉淀,则该固体试样中存在SOeq \\al(2-,4)
B.将某固体试样完全溶于盐酸,再滴加KSCN溶液,没有出现红色,则该固体试样中不存在Fe3+
C.在某固体试样加水后的溶液中,滴加NaOH溶液,没有产生使湿润红色石蕊试纸变蓝的气体,该固体试样中仍可能存在NHeq \\al(+,4)
D.在某固体试样加水后的上层清液中,滴加盐酸出现白色沉淀,再加NaOH溶液沉淀溶解,则该固体试样中存在SiOeq \\al(2-,3)
【答案】 C
【解析】 当固体中含有SOeq \\al(2-,3)时,在酸性条件下滴加Ba(NO3)2溶液会被氧化生成硫酸根离子,有相同现象,故不一定是SOeq \\al(2-,4),A错误;若固体为FeCl3和Fe的混合物时,也有相同的现象,故固体试样中可能存在Fe3+,B错误;检验NHeq \\al(+,4)时应加NaOH溶液,加热,产生使湿润红色石蕊试纸变蓝的气体,选项中没有加热,故不能确定有没有铵根离子,C正确;滴加盐酸出现白色沉淀,再加NaOH溶液沉淀溶解,可能原固体中有[Al(OH)4]-(或AlOeq \\al(-,2))-,不一定为SiOeq \\al(2-,3),D错误。
7、某固体混合物由NaCl、BaCl2、Al2(SO4)3、FeCl3、Na2CO3中的两种组成,进行如下实验:①将混合物溶于水,溶液变浑浊同时有气泡产生;②向①反应液中滴加稀硫酸至过量,沉淀完全溶解;③向②溶液中滴加KSCN溶液,未见明显现象;④取③反应后的液体做焰色试验,可观察到黄色火焰,根据实验现象可判断其组成为( )
A.BaCl2、Al2(SO4)3 B.BaCl2、Na2CO3 C.Al2(SO4)3、Na2CO3 D.FeCl3、Na2CO3
【答案】 C
【解析】 根据实验①可知溶于水的过程中发生碳酸根离子和Al3+或Fe3+的相互促进的水解反应,根据实验②可知,沉淀不是BaSO4,一定没有BaCl2,结合实验①④,可确定一定有Na2CO3,根据实验③可知没有FeCl3,则一定有Al2(SO4)3。
8、某无色溶液可能由K2CO3、MgCl2、NaHCO3、BaCl2溶液中的一种或几种组成。取样,向溶液中加入烧碱溶液出现白色沉淀;另取样,加入稀硫酸也出现白色沉淀并放出气体。据此分析,下列判断中正确的是( )
A.一定有MgCl2 B.一定有MgCl2和NaHCO3
C.一定有K2CO3 D.一定有BaCl2和NaHCO3
【答案】 D
【解析】 向溶液中加入烧碱溶液出现白色沉淀,可能是NaOH与MgCl2反应生成Mg(OH)2白色沉淀,也可能是NaOH与NaHCO3反应生成Na2CO3,Na2CO3与BaCl2反应生成BaCO3白色沉淀;加入稀硫酸也出现白色沉淀并放出气体,该白色沉淀一定是稀硫酸与BaCl2生成的BaSO4,气体是稀硫酸与K2CO3或NaHCO3反应生成的CO2,因一定存在BaCl2,则一定没有K2CO3,故一定有NaHCO3;综上所述,该无色溶液一定含有BaCl2和NaHCO3,一定没有K2CO3,可能有MgCl2,故D正确。
9、某同学为检验溶液中是否含有常见的四种离子,进行了如图操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。下列结论正确的是( )
A.原溶液中一定含有SOeq \\al(2-,4) B.原溶液中一定含有NHeq \\al(+,4)
C.原溶液中一定含有Cl- D.原溶液中一定含有Fe3+
【答案】 B
【解析】 原溶液中加入盐酸酸化的硝酸钡,如果其中含有亚硫酸根离子,则会被氧化为硫酸根离子,所以原溶液中不一定含有SOeq \\al(2-,4),故A错误;产生能使红色石蕊试纸变蓝的气体是氨气,所以原溶液中一定含有NHeq \\al(+,4),故B正确;原溶液中加入盐酸酸化的硝酸钡,引进了氯离子,能和硝酸银反应生成氯化银沉淀的离子不一定是原溶液中含有的氯离子,故C错误;原溶液中加入盐酸酸化的硝酸钡,如果其中含有亚铁离子,则亚铁离子会被氧化为铁离子,铁离子遇硫氰化钾溶液而使溶液呈红色,所以原溶液中不一定含有Fe3+,故D错误。
10、某无色溶液X可能含有K+、Na+、NHeq \\al(+,4)、Mg2+、Ba2+、COeq \\al(2-,3)、Cl-、SOeq \\al(2-,4)中若干种,且各离子浓度相同,为确定其组成,依次进行下列实验。
①取少量溶液X,向其中加入足量的氢氧化钠溶液,有白色沉淀A产生;微热,闻到刺激性气味。
②过滤①中的混合物,在滤液中加入足量的氢氧化钡溶液,有白色沉淀B产生,再加入足量的稀硝酸,沉淀不溶解。
根据上述实验,下列说法正确的是( )
A.溶液X中一定含有NHeq \\al(+,4)、Mg2+、SOeq \\al(2-,4),可能含有COeq \\al(2-,3)
B.溶液X中是否含有Na+、K+需要通过焰色试验确定
C.白色沉淀A和白色沉淀B都是纯净物
D.溶液X中一定没有COeq \\al(2-,3)、Cl-
【答案】 C
【解析】 取少量溶液X,向其中加入足量的氢氧化钠溶液,有白色沉淀A产生,溶液X中一定含有镁离子,一定不存在碳酸根离子;微热,闻到刺激性气味,说明溶液X中含有铵根离子;由在滤液中加入足量的氢氧化钡溶液,有白色沉淀B产生,再加入足量的稀硝酸,沉淀不溶解,说明溶液X中一定含有硫酸根离子,一定不含有钡离子;由各离子浓度相同,结合离子共存可知,溶液中一定含有氯离子,不含有钠离子和钾离子,则X溶液中一定含有镁离子、铵根离子、硫酸根离子、氯离子,一定不含有钾离子、钠离子、钡离子、碳酸根离子,沉淀A为氢氧化镁、沉淀B为硫酸钡。
11、某溶液中可能含有Na+、SOeq \\al(2-,4)、SOeq \\al(2-,3)、Cl-、Br-、COeq \\al(2-,3)、HCOeq \\al(-,3)中的一种或多种,进行如下图所示的实验,每次实验所加试剂均过量。下列说法正确的是( )
A.一定没有SOeq \\al(2-,3) B.不能确定是否含有HCOeq \\al(-,3)
C.可能存在Br- D.肯定存在的离子有Na+、COeq \\al(2-,3)、HCOeq \\al(-,3)
【答案】D
【解析】待测溶液中加入BaCl2溶液,所得溶液A中加入NaOH溶液,得到沉淀B,则B为BaCO3,原溶液中一定含有HCOeq \\al(-,3)。溶液B中加入氯水,得无色溶液C,则原溶液中不含有Br-;溶液B中加入AgNO3溶液,虽然生成白色AgCl沉淀,但由于加入了BaCl2,所以不能肯定原溶液中是否含有Cl-。沉淀A中加入稀HNO3,生成气体D为CO2,则原溶液中一定含有COeq \\al(2-,3);生成的白色沉淀D为BaSO4,则原溶液中可能含有SOeq \\al(2-,3)或SOeq \\al(2-,4),或二者的混合物。由以上分析知,不能肯定原溶液中是否存在SOeq \\al(2-,3),A项不正确;由以上分析可知,可确定原溶液中一定含有HCOeq \\al(-,3),B项不正确;由以上分析可知,原溶液中加入氯水,所得溶液呈无色,则原溶液中不存在Br-,C项不正确;由以上分析知,原溶液中肯定存在COeq \\al(2-,3)、HCOeq \\al(-,3),依据溶液呈电中性的原则,原溶液中一定含有Na+,D项正确。离子
操作
现象
Cl-、Br-、I-
先加稀HNO3酸化,再滴加AgNO3溶液。
产生白色沉淀(AgCl)、
产生淡黄色沉淀(AgBr)、
产生黄色沉淀(AgI)
Br-、I-
先加氯水或H2O2,再滴加CCl4萃取。
Br-:有机层橙红色
I-:有机层紫红色
I-
先加氯水或H2O2,再滴加淀粉溶液。
溶液变蓝
SOeq \\al(2-,4)
先加稀盐酸酸化,再滴加BaCl2溶液。
加稀盐酸无明显现象,再加BaCl2溶液产生白色沉淀
Fe2+
K3[Fe(CN)6]溶液
生成蓝色沉淀
先加KSCN溶液再加氯水
先无明显变化,后变红色
KMnO4溶液
紫红色褪去
Fe3+
KSCN溶液
溶液呈红色
淀粉-KI溶液
溶液变蓝色
NHeq \\al(+,4)
加浓NaOH溶液,加热。
产生使湿润的红色石蕊试剂变蓝的气体。
Mg2+
加过量NaOH溶液
开始产生白色沉淀,NaOH溶液过量沉淀不溶解
Al3+
加过量NaOH溶液
开始产生白色沉淀,NaOH溶液过量沉淀溶解
Cu2+
加过量NaOH溶液
产生蓝色沉淀
Ag+
加过量氨水
开始产生白色沉淀,氨水过量沉淀溶解
COeq \\al(2-,3)
CaCl2溶液和稀盐酸
加CaCl2溶液产生白色沉淀,再加稀盐酸沉淀溶解,产生无色气体。
SOeq \\al(2-,3)、HSOeq \\al(-,3)
稀H2SO4和品红溶液
加稀硫酸产生有刺激性气味的气体,且气体能使品红溶液褪色。
Na+、K+
焰色试验
Na+:黄色火焰
K+:紫色火焰(透过蓝色钴玻璃)
问题
分析
1、向某溶液中,加入BaCl2溶液后生成白色沉淀,再加入稀盐酸沉淀不消失,能否判断溶液中存在SO42-。
不能。可能存在Ag+干扰。
2、向某溶液中加入Ca(OH)2溶液,有白色沉淀生成,能否判断溶液中一定存在CO32-。
不能。可能存在SOeq \\al(2-,4)、SOeq \\al(2-,3)等干扰。
3、向某溶液中滴入稀盐酸,产生能使澄清石灰水变浑浊的气体,能否判断溶液中一定存在CO32-。
不能。可能存在HCOeq \\al(-,3)、HSOeq \\al(-,3)、SOeq \\al(2-,3)等干扰。
4、向某溶液中加入稀NaOH溶液,把湿润无色酚酞试纸放在试管口,试纸不变红,则溶液中一定不存在NH4+。
不能。需要浓NaOH溶液,加热。
5、向某溶液中滴加氯水,再加入KSCN溶液,溶液变红色,则溶液中一定存在Fe2+。
不能。可能存在Fe3+干扰。
6、做某溶液的焰色反应实验,火焰呈黄色,则溶液中一定存在钠元素,不存在钾元素。
不能。K+需透过蓝色钴玻璃观察。
7、加入稀盐酸酸化的Ba(NO3)2溶液,出现白色沉淀,则溶液中可能有SO32-或SO42-或Ag+。
正确。
8、加入盐酸,产生白色沉淀,滴加硝酸白色沉淀不溶解,则溶液中有Ag+。
正确。
9、往某溶液滴加氢氧化钠溶液有白色沉淀生成,则该溶液中一定含有Mg2+或Al3+。
不能。可能存在Ag+等干扰。
10、滴入硝酸酸化的Ba(NO3)2溶液,产生白色沉淀,溶液中一定存在SO42-。
不能。可能存在HSOeq \\al(-,3)、SOeq \\al(2-,3)等干扰。
11、无色溶液加入CCl4无现象,滴加氯水后CCl4层呈紫红色,则溶液中一定存在I-不存在Br-。
不能证明不存在Br-。
12、某溶液中滴加氨水,立即出现白色沉淀,后逐渐增多,最后部分溶解,说明原溶液中肯定有Ag+,可能有Al3+或Mg2+。
正确。
选项
试剂①
试剂②
A
氨水
AgNO3溶液
B
NaOH溶液
Al2(SO4)3溶液
C
H2C2O4溶液
酸性KMnO4溶液
D
KSCN溶液
FeCl3溶液
选项
离子
检验方法
A
COeq \\al(2-,3)
向样品中加入足量盐酸,将生成的无色无味的气体通入澄清石灰水中,观察溶液是否变浑浊
B
SOeq \\al(2-,4)
向样品中先加入稀硝酸酸化,再滴加氯化钡溶液,观察是否有白色沉淀生成
C
Fe2+
取少量溶液于试管中,加入酸性高锰酸钾溶液,观察溶液紫色是否褪去
D
I-
取少量溶液于试管中,加入新制氯水,再加入淀粉溶液,观察溶液是否变蓝色
高考化学一轮复习基础知识讲义专题三考点四 离子共存(2份打包,原卷版+解析版): 这是一份高考化学一轮复习基础知识讲义专题三考点四 离子共存(2份打包,原卷版+解析版),文件包含高考化学一轮复习基础知识讲义专题三考点四离子共存学生版doc、高考化学一轮复习基础知识讲义专题三考点四离子共存解析版doc等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。
高考化学一轮复习基础知识讲义专题三考点三 离子方程式正误的判断(2份打包,原卷版+解析版): 这是一份高考化学一轮复习基础知识讲义专题三考点三 离子方程式正误的判断(2份打包,原卷版+解析版),文件包含高考化学一轮复习基础知识讲义专题三考点三离子方程式正误的判断解析版doc、高考化学一轮复习基础知识讲义专题三考点三离子方程式正误的判断学生版doc等2份试卷配套教学资源,其中试卷共16页, 欢迎下载使用。
高考化学一轮复习基础知识讲义专题三考点三 化学与STSE(2份打包,原卷版+解析版): 这是一份高考化学一轮复习基础知识讲义专题三考点三 化学与STSE(2份打包,原卷版+解析版),文件包含高考化学一轮复习基础知识讲义专题三考点三化学与STSE解析版doc、高考化学一轮复习基础知识讲义专题三考点三化学与STSE学生版doc等2份试卷配套教学资源,其中试卷共17页, 欢迎下载使用。












