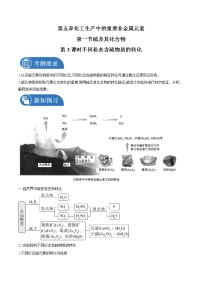
高中化学人教版 (2019)必修 第二册实验活动5 不同价态含硫物质的转化精品导学案
展开一、自然界中硫的存在和转化
1.自然界中硫的存在
(1)游离态的硫主要存在于________附近或________________中。
(2)化合态的硫广泛存在于动植物体内和海洋、大气、地壳中:
①动植物体内:含硫蛋白质等;
②岩层深处和海底的无氧环境中:金属硫化物,如黄铁矿(________)、黄铜矿(________)等;
③地表附近的富氧环境中:硫酸盐,如石膏(____________)、芒硝(____________)等;
④大气中:少量的H2S、________、SO3等。
2.自然界中不同价态含硫物质的转化
二、实验探究不同价态含硫物质的转化
1.硫的价-类二维图
(1)硫元素的化合价与氧化性、还原性之间的关系
(2)硫元素常见的化合价有________________价,可以通过___________反应实现不同价态含硫物质的相互转化。
2.实验设计:不同价态含硫物质的转化
(1)设计实验实现不同价态含硫物质的转化,遵循的原则是科学性、可行性、安全性和绿色化。
(2)实验设计方案
►问题一 自然界中硫的存在和转化
【典例1】硫在自然界中的循环过程如图所示,下列说法不正确的是( )
A.石油和煤等化石燃料中含有硫元素
B.大气中的二氧化硫只来源于火山喷发产生的气体
C.地壳中的硫元素常以硫化物和硫酸盐的形式存在
D.动植物遗体被微生物分解后,可产生SOeq \\al(2-,4)和SO2
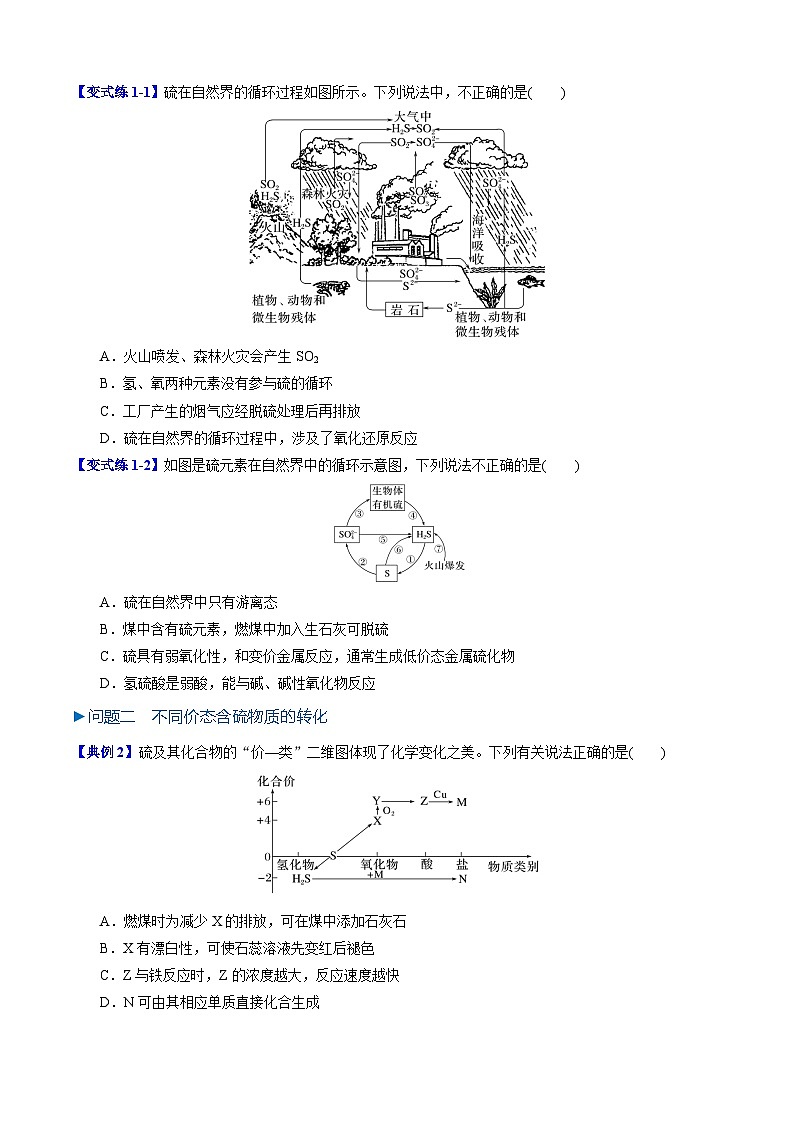
【变式练1-1】硫在自然界的循环过程如图所示。下列说法中,不正确的是( )
A.火山喷发、森林火灾会产生SO2
B.氢、氧两种元素没有参与硫的循环
C.工厂产生的烟气应经脱硫处理后再排放
D.硫在自然界的循环过程中,涉及了氧化还原反应
【变式练1-2】如图是硫元素在自然界中的循环示意图,下列说法不正确的是( )
A.硫在自然界中只有游离态
B.煤中含有硫元素,燃煤中加入生石灰可脱硫
C.硫具有弱氧化性,和变价金属反应,通常生成低价态金属硫化物
D.氢硫酸是弱酸,能与碱、碱性氧化物反应
►问题二 不同价态含硫物质的转化
【典例2】硫及其化合物的“价—类”二维图体现了化学变化之美。下列有关说法正确的是( )
A.燃煤时为减少X的排放,可在煤中添加石灰石
B.X有漂白性,可使石蕊溶液先变红后褪色
C.Z与铁反应时,Z的浓度越大,反应速度越快
D.N可由其相应单质直接化合生成
【归纳小结】硫及其化合物间的转化规律
(1)在硫元素的不同价态中, eq \(S,\s\up6(-2)) 是硫元素的最低价态,只有还原性; eq \(S,\s\up6(+6)) 是硫元素的最高价态,只有氧化性; eq \(S,\s\up6(0)) 、 eq \(S,\s\up6(+4)) 是硫元素的中间价态,既有氧化性又有还原性。
(2)当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态。
(3)当遇到强氧化剂或强还原剂时,硫元素的化合价可能发生“跳位”变化。例如:
H2S+3H2SO4(浓) eq \(=====,\s\up7(△)) 4SO2↑+4H2O,
8HI+H2SO4(浓)===H2S↑+4I2+4H2O。
(4)硫元素的相邻价态之间一般不会发生氧化还原反应,如S和H2S、S和SO2、SO2和H2SO4,所以可用浓硫酸干燥SO2气体。
(5)连续氧化关系:H2S eq \(――→,\s\up7(O2)) S eq \(――→,\s\up7(O2)) SO2 eq \(――→,\s\up7(O2)) SO3。
(6)通过非氧化还原反应实现含相同价态硫元素的物质之间的转化:
③SO3eq \(—————→,\s\up7(H2O))H2SO4—→Na2SO4
【变式练2-1】Na2SO3中+4价的硫既有氧化性又有还原性。从以下试剂中选择合适试剂验证上述性质。新制氯水、Na2S溶液、Na2SO3溶液、稀H2SO4、NaOH溶液。
【变式练2-2】物质的类别和核心元素的化合价是研究物质性质的重要视角。如图是硫及其化合物的价—类二维图。下列说法不正确的是( )
A.图中由d转化为e需加入氧化剂
B.将a与c混合,可生成淡黄色固体
C.将c通入酸性高锰酸钾溶液中,溶液褪色,体现了c的漂白性
D.实验室常用f和70%的H2SO4反应制取c
【基础强化】
1.下列说法不正确的是( )
A.硫是一种黄色的难溶于水的晶体
B.硫的化合物常存在于火山喷出的气体中和矿泉水里
C.硫易燃烧,其燃烧产物是大气污染物之一
D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
2.下列有关硫及其化合物的说法正确的是( )
A.SO2、H2SO3均具有还原性,故浓H2SO4均能氧化SO2和H2SO3
B.H2S与浓H2SO4在不同的条件下反应的氧化产物只能是SO2
C.单质eq \(――→,\s\up7(+O2))氧化物eq \(――→,\s\up7(+H2O))酸或碱eq \(―――――→,\s\up7(+NaOH或HCl))盐,能按照上述转化关系直接转化的可以是硫元素
D.硫黄制备硫酸经历两步:Seq \(―――→,\s\up7(O2/点燃))SO3eq \(――→,\s\up7(H2O))H2SO4
3.下列关于不同价态含硫物质的转化实验中,硫元素的化合价变化合理的是( )
A.图Ⅰ:0价→+2价B.图Ⅱ:0价→+6价
C.图Ⅲ:+4价→+6价D.图Ⅳ:+6价→+4价
4.下列关于SO2和SO3的叙述正确的是( )
A.它们中的硫元素均可在有的反应中显氧化性,有的反应中显还原性
B.加入含Ba2+的溶液都能生成不溶于稀盐酸的白色沉淀
C.常温下,它们均可以使品红溶液褪色
D.都属于酸性氧化物,溶于水都生成酸
5.如图所示是某一短周期元素的“价—类二维图”。图中箭头表示物质间的转化均能一步完成,a、g的焰色均为黄色。下列说法错误的是( )
A.x为O2,y为H2O
B.c为S,e为SO3
C.f的稀溶液具有强氧化性
D.反应a→b的离子方程式可能是S2-+2H+===H2S↑
6.已知S2-+Cl2===2Cl-+S↓,下列说法正确的是( )
A.Cl2是氧化剂B.氧化性:S>Cl2
C.还原性:S2-
A.过程Ⅰ中,SO2未被氧化
B.双碱法脱硫过程中,Ca(OH)2可以循环利用
C.过程Ⅱ中,1 ml O2可氧化2 ml Na2SO3
D.总反应为2Ca(OH)2+2SO2+O2===2CaSO4+2H2O
8.硫元素的几种化合物及其单质存在下列转化关系(反应条件省略)。
浓H2SO4eq \(――→,\s\up7(Cu),\s\d5(①))SO2eq \(―――→,\s\up7(NaOH溶液),\s\d5(②))Na2SO3eq \(――→,\s\up7(S),\s\d5(③))Na2S2O3eq \(――→,\s\up7(稀H2SO4),\s\d5(④))S
下列判断不正确的是( )
A.反应①中氧化剂与还原剂物质的量之比为1∶1
B.反应②表明SO2具有酸性氧化物的性质
C.反应③属于四大基本反应类型中的化合反应
D.反应④中稀H2SO4作氧化剂
9.在通常情况下,A为固态单质。根据如图转化关系,回答下列问题:
(1)写出A~E的化学式:
A.__________;B.__________;C.____________;D.____________;E.____________。
(2)写出下列反应的化学方程式:
①E→C:____________________________________;
②C→D:____________________________________;
③B→C:_____________________________________。
10.某工业烟气中含有CO、CO2、N2、SO2等气体,用Na2SO3溶液吸收并回收SO2的过程如图所示。
(1)SO2的浓度:Ⅰ________(填“>”或“<”)Ⅱ。
(2)图示过程中可以循环利用的物质是_______________(填化学式)。
(3)上述吸收过程中发生的主要反应的化学方程式是_________________________________。
(4)解吸过程需要加热,在这个过程中常伴有少量SOeq \\al(2-,4)产生。
①证明产物中含SOeq \\al(2-,4)的实验方法是:取少量解吸后的溶液,____________________________
________________________________________________________________(填操作和现象)。
②产生SOeq \\al(2-,4)的原因是________________________________________________。
【能力提升】
1.青矾,又名绿矾、皂矾,在中国古代被用于医药、陶瓷生产中。《金石类》中记载“青矾烧之赤色,气熏人,衣服当之易烂,载木不盛”,《景德镇陶录》中记载:“矾红釉,用青矾炼红加铅粉、广胶合成”。下列说法不正确的是( )
A.青矾主要成分是FeSO4·7H2O
B.“赤色”“炼红”可能指分解产生了Fe3O4
C.“气熏人,衣服当之易烂,载木不盛”可能指产生了SO2、SO3气体
D.青矾分解过程发生的是氧化还原反应
2.灼烧绿矾的化学方程式为2FeSO4·7H2Oeq \(=====,\s\up7(高温))Fe2O3+SO2↑+SO3↑+14H2O。将绿矾灼烧后生成的气体通入下图装置,下列叙述不正确的是( )
A.①中棉团颜色褪去
B.②中棉团颜色褪去,体现了SO2的还原性
C.③中同时有BaSO3和BaSO4生成
D.④中可发生反应:SO2+2NaOH===Na2SO3+H2O
3.硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法中不正确的是( )
A.过程①中,生成CuS的反应为H2S+Cu2+===CuS↓+2H+
B.过程②中,Fe3+作氧化剂
C.回收S的总反应为2H2S+O2===2H2O+2S
D.过程③中,各元素化合价均未改变
4.在实验室进行铁粉和硫粉混合加热的实验,产物又进行了系列实验,流程如图。下列说法正确的是( )
A.气体A和D含有同一物质,且均为氧化产物
B.硫元素至少参加了2个氧化还原反应
C.沉淀F可以和NaOH溶液在加热的条件下反应
D.若固体B中加浓硫酸,发生反应时被氧化的和被还原的均为同一种元素
5.物质的类别和元素的化合价是研究物质性质的两个重要角度。回答下列问题:
Ⅰ.硫元素在不同价态之间的转化为:
SO2eq \(――→,\s\up7(反应①))Na2SO3溶液eq \(――→,\s\up7(反应②))Na2S2O3溶液
(1)“反应①”常使用NaOH溶液,该转化说明SO2的类别属于________________。
(2)欲制备Na2S2O3,从氧化还原的角度分析,“反应②”合理的是__________(填字母)。
a.Na2SO3+Na2SO4 b.Na2SO3+S c.Na2SO3+Na2S2O5
Ⅱ.某实验小组用铜片与浓硫酸反应并验证SO2性质的实验装置如图。
(3)装置A用于验证SO2的________性,装置D的作用是____________________________。
(4)装置B的现象为________________,装置C中反应的离子方程式为__________________________。
(5)若用装置乙代替装置甲,装置乙的优点是___________________________(任写一点)。
(6)将28.8 g的铜片加入到25 mL 18 ml·L-1的硫酸中并加热,被还原的硫酸的物质的量为______(填字母)。
A.大于0.225 ml
B.等于0.225 ml
C.小于0.225 ml
D.在0.225 ml和0.45 ml之间
1.了解含硫物质在自然界中的存在与转化,熟悉自然界中常见的含硫物质的类别及硫元素的化合价。
2.根据硫元素化合价会分析含硫物质的性质,并能设计实验实现不同价态含硫物质的相互转化
转化目标(价态变化)
选择试剂
实验操作和现象
实验结论
H2eq \(S,\s\up6(-2))→eq \(S,\s\up6(0))
eq \(S,\s\up6(+4))O2→eq \(S,\s\up6(0))
eq \(S,\s\up6(+4))O2→H2eq \(S,\s\up6(+6))O4
H2eq \(S,\s\up6(+6))O4→eq \(S,\s\up6(+4))O2
性质
还原性
氧化性
试剂
现象
反应的离子方程式
高中化学人教版 (2019)必修 第二册实验活动5 不同价态含硫物质的转化精品学案及答案: 这是一份高中化学人教版 (2019)必修 第二册<a href="/hx/tb_c4000037_t4/?tag_id=42" target="_blank">实验活动5 不同价态含硫物质的转化精品学案及答案</a>,共4页。
化学人教版 (2019)实验活动5 不同价态含硫物质的转化精品学案: 这是一份化学人教版 (2019)<a href="/hx/tb_c4000037_t4/?tag_id=42" target="_blank">实验活动5 不同价态含硫物质的转化精品学案</a>,文件包含人教版1019高中化学必修2同步讲义第03讲不同价态含硫物质的转化教师版docx、人教版1019高中化学必修2同步讲义第03讲不同价态含硫物质的转化学生版docx等2份学案配套教学资源,其中学案共17页, 欢迎下载使用。
高中化学实验活动5 不同价态含硫物质的转化精品导学案: 这是一份高中化学实验活动5 不同价态含硫物质的转化精品导学案,共21页。学案主要包含了新知学习,知识进阶,问题探究,知识归纳总结,效果检测等内容,欢迎下载使用。