












2025年高考化学大一轮大单元一 第一章 第二讲 离子反应 离子方程式(课件+讲义+练习)
展开1、全面、系统复习回顾基本知识。了解知识规律的来龙去脉,透彻理解概念的内涵外延,让学生经历教材由薄变厚的过程。要正确理解基础,不是会做几个简单题就叫基础扎实。对于一轮复习,基础就是像盖房子一样,需要着力做好两件大事:一是夯实地基,二是打好框架。2、扎实训练学科基本技能、理解感悟学科基本方法。一轮复习,要以教材为本,全面细致的回顾课本知识,让学生树立“教材是最好的复习资料”的观点,先引导学生对教材中所涉及的每个知识点进行重新梳理,对教材中的概念、定理、定律进一步强化理解。3、培养学生积极的学习态度、良好的复习习惯和运用科学思维方法、分析解决问题的能力。落实解题的三重境界:一是“解”,解决问题。二是“思”,总结解题经验和方法。三是“归”,回归到高考能力要求上去。解题上强化学生落实三个字:慢(审题),快(书写),全(要点全面,答题步骤规范)。 4、有计划、有步骤、有措施地指导学生补齐短板。高三复习要突出重点,切忌主次不分,无的放矢。要在“精讲”上下足功夫。抓住学情,讲难点、重点、易混点、薄弱点;讲思路、技巧、规范;讲到关键处,讲到点子上,讲到学生心里去。
2025年高考化学大一轮复习
1.了解电解质及其分类,掌握强弱电解质的本质区别。2.理解电解质在水溶液中的电离以及电解质溶液的导电性。3.了解离子反应的概念、离子反应发生的条件,并能正确书写离子方程式以及判断离子能否大量共存。
考点一 离子反应与离子大量共存的判断
考点二 离子方程式的书写及正误判断
离子反应与离子大量共存的判断
1.电解质的概念(1)概念在 或 能够导电的化合物,称为电解质,二者情况下均不导电的化合物称为非电解质。
强电解质:在水溶液中_________弱电解质:在水溶液中_________
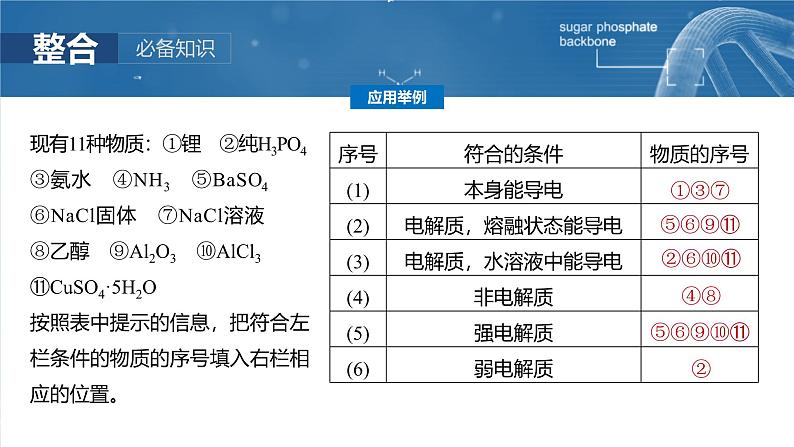
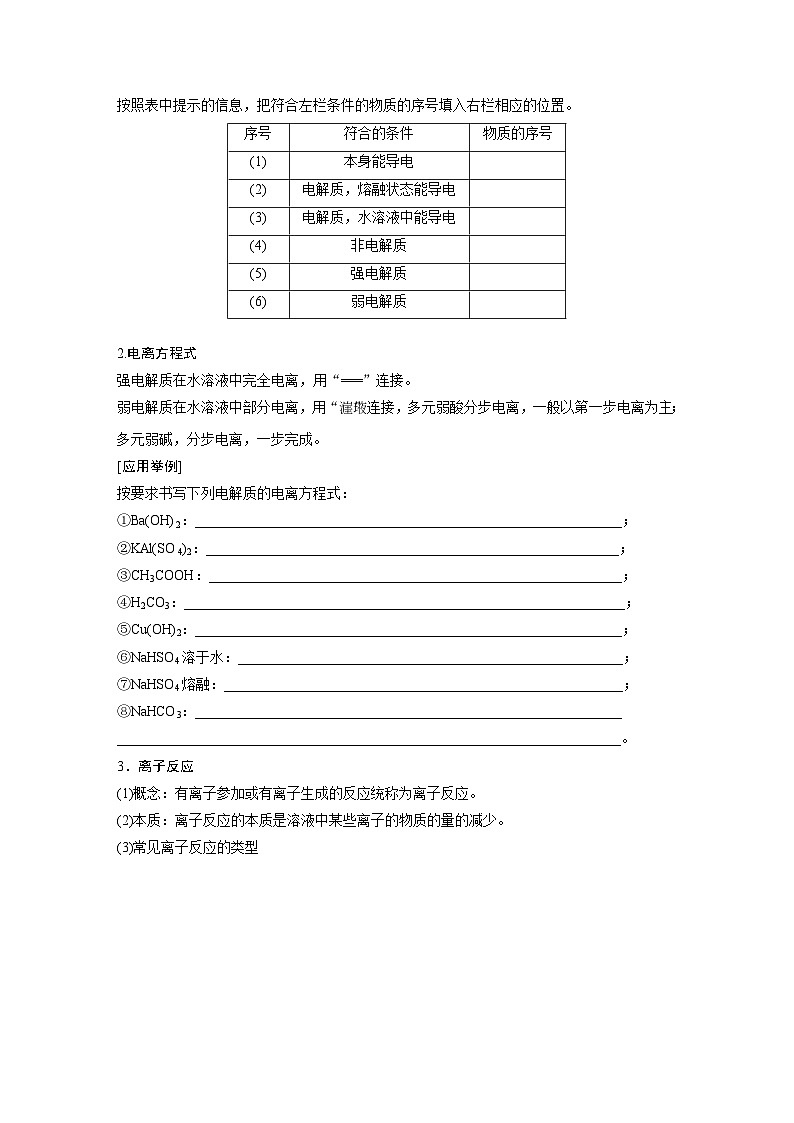
现有11种物质:①锂 ②纯H3PO4③氨水 ④NH3 ⑤BaSO4⑥NaCl固体 ⑦NaCl溶液 ⑧乙醇 ⑨Al2O3 ⑩AlCl3 ⑪CuSO4·5H2O按照表中提示的信息,把符合左栏条件的物质的序号填入右栏相应的位置。
2.电离方程式强电解质在水溶液中完全电离,用“===”连接。弱电解质在水溶液中部分电离,用“ ”连接,多元弱酸分步电离,一般以第一步电离为主;多元弱碱,分步电离,一步完成。
按要求书写下列电解质的电离方程式:①Ba(OH)2:______________________;②KAl(SO4)2:____________________________;③CH3COOH:____________________________;④H2CO3:_________________________________________;⑤Cu(OH)2:_______________________;⑥NaHSO4溶于水:__________________________;⑦NaHSO4熔融:__________________________;⑧NaHCO3:___________________________________________。
Ba(OH)2===Ba2++2OH-
CH3COOH CH3COO-+H+
Cu(OH)2 Cu2++2OH-
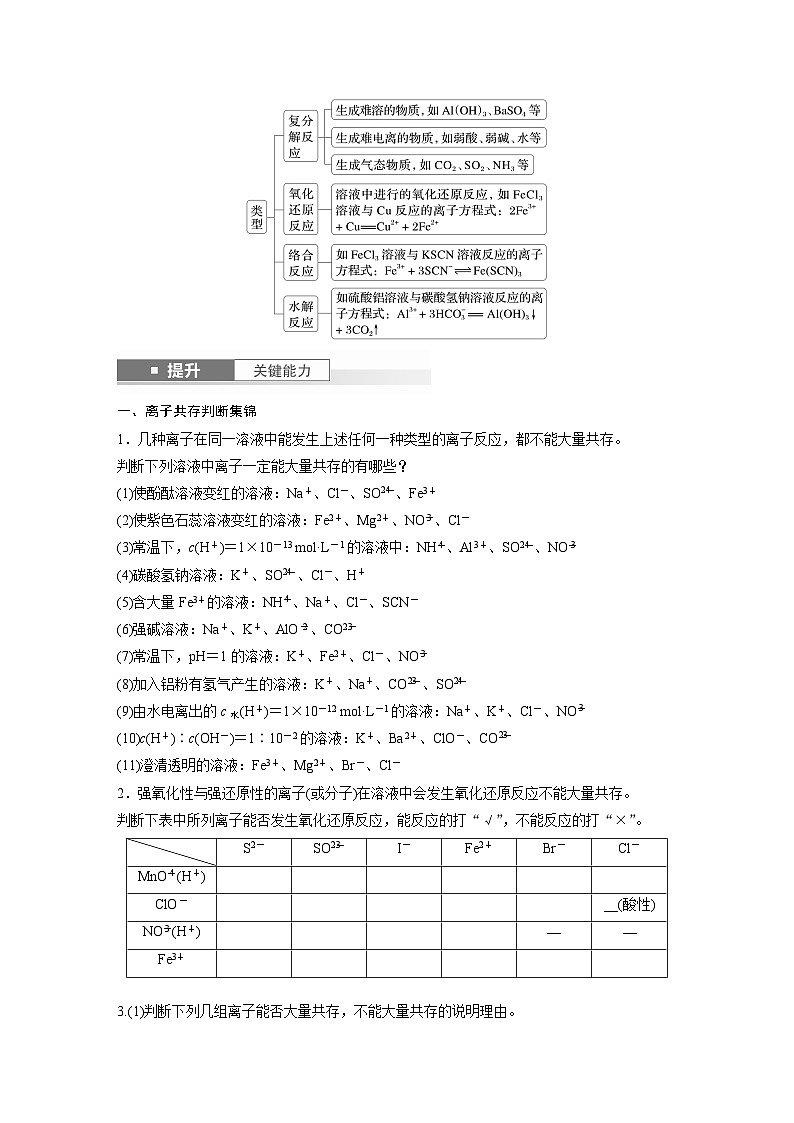
3.离子反应(1)概念:有离子参加或有离子生成的反应统称为离子反应。(2)本质:离子反应的本质是溶液中某些离子的物质的量的减少。(3)常见离子反应的类型
一、离子共存判断集锦1.几种离子在同一溶液中能发生上述任何一种类型的离子反应,都不能大量共存。判断下列溶液中离子一定能大量共存的有哪些?
答案 (6)(9)(11)
2.强氧化性与强还原性的离子(或分子)在溶液中会发生氧化还原反应不能大量共存。判断下表中所列离子能否发生氧化还原反应,能反应的打“√”,不能反应的打“×”。
3.(1)判断下列几组离子能否大量共存,不能大量共存的说明理由。①Na+、Fe2+、 :_____。②H+、Fe2+、 :______________________________________。③向含有Fe2+、Cl-、Na+、H+的溶液中滴入H2O2:________________________________。(2)S2-与 Cl-与ClO-在碱性条件下能否大量共存:____(填“能”或“不能”)。写出上述两组离子在酸性条件下反应的离子方程式:________________________________、______________________________。
不能,H2O2在酸性条件下
===3S↓+3H2O
Cl-+ClO-+2H+===Cl2↑+H2O
二、离子反应过程中溶液导电性变化分析4.下列几种导电性变化图像,把符合要求的图像字母填在相应的题目后面的括号中。
(1)向H2SO4溶液中加入等体积、等物质的量浓度的Ba(OH)2溶液( )(2)向H2S溶液中通入Cl2直至过量( )(3)向AgNO3溶液中通入少量HCl( )(4)向氨水中通入HCl直至过量( )(5)向NaOH溶液中通入少量Cl2( )(6)向饱和石灰水中不断通入CO2( )
(1)H+与OH-中和生成极弱电解质水,Ba2+与 结合成难溶BaSO4,溶液中自由移动的离子浓度降低。(2)和(4)都是因发生离子反应,使弱电解质生成强电解质,自由移动的离子浓度增加。(3)和(5)虽然发生了离子反应,但自由移动离子的浓度基本未发生改变。(6)开始阶段CO2与Ca(OH)2反应生成CaCO3沉淀,离子浓度降低至Ca(OH)2完全反应后,继续通入CO2,CO2、H2O与CaCO3反应生成可溶性的Ca(HCO3)2,自由移动离子的浓度又增加。
5.将等浓度的H2SO4、NaHSO4溶液,分别滴入两份相同的Ba(OH)2溶液中,其电导率与滴入溶液体积变化的曲线如图所示。下列分析正确的是A.b→d反应的离子方程式为H++OH-===H2OB.d点溶液中,Na+与 的物质的量之比为1∶1C.c点导电能力相同,所以两溶液中含有相同量的OH-D.a、b两点Ba2+均沉淀完全,所以对应的溶液均显中性
Ba(OH)2溶液和H2SO4、NaHSO4溶液反应的化学方程式分别为H2SO4+Ba(OH)2===BaSO4↓+2H2O,NaHSO4+Ba(OH)2===BaSO4↓+NaOH+H2O、2NaHSO4+Ba(OH)2===BaSO4↓+Na2SO4+2H2O,溶液导电能力与离子浓度成正比,根据图知,曲线①在a点溶液电导率接近0,说明该点溶液离子浓度最小,应该为Ba(OH)2和H2SO4的反应,则曲线②为Ba(OH)2和NaHSO4的反应。b→d反应为向NaOH溶液中继续滴加NaHSO4溶液,实际上是酸碱中和反应,离子方程式为H++OH-===H2O,故A项正确;
d点时溶质为Na2SO4,根据化学式知,Na+与 的物质的量之比为2∶1,故B项错误;c点,①中稀硫酸过量,溶质为硫酸,②中溶质为NaOH、Na2SO4,则该点两种溶液中氢氧根离子浓度不同,故C项错误;a点液体为纯水,b点溶质为NaOH,所以a点呈中性,b点呈碱性,故D项错误。
电解质溶液导电原理及影响因素
(1)导电原理电解质电离出的阴、阳离子在外加电场的作用下,发生定向移动实现导电过程。(2)影响因素①离子浓度:一般情况下,自由移动的离子浓度越大,所带电荷数越多,电解质溶液导电能力越强。②离子种类:离子浓度相同时,不同离子导电能力不同。③溶液温度:一般情况下,温度升高,电解质溶液导电能力增强。
离子方程式的书写及正误判断
1.离子方程式(1)概念:用 来表示反应的式子。(2)意义:离子方程式不仅可以表示 ,还可以表示_____________________。2.离子方程式中物质的“拆分”原则(1)一般原则:能拆分写成离子形式的物质是易溶的强电解质,包括 、 、大多数 。除此之外的物质不能拆分。
实际参加反应的离子符号
(3)微溶物的拆分①微溶物作为产物视为沉淀,不拆分。②作反应物时,澄清溶液中,微溶物拆分为离子,浑浊液中微溶物不拆分,如Ca(OH)2。(4)产物NH3·H2O的拆分①不加热或稀溶液中,写成“NH3·H2O”。②加热或浓溶液中,写成“NH3↑”和“H2O”。
3.离子方程式规范书写的基本要求(1)符合事实:离子反应要符合客观事实,不可臆造产物及反应。(2)方程式正确:化学式与离子使用正确合理。(3)符号正确:“===” “↑”“↓”等使用正确。(4)三个守恒:两边原子数、电荷数必须守恒,氧化还原反应离子方程式中氧化剂得电子总数与还原剂失电子总数要相等。
一、常见离子方程式的书写1.完成下列反应的离子方程式:(1)注意氧化物、难溶物质、气体、难电离物质的书写形式。①过氧化钠溶于水___________________________________。②向AlCl3溶液中滴加过量的氨水__________________________________。③Cl2溶于水____________________________。
2Na2O2+2H2O===4Na++4OH-+O2↑
Cl2+H2O H++Cl-+HClO
④向NaHSO3溶液中加入过量NaHSO4溶液_________________________。
(2)注意微溶物质、 与碱反应的条件。①向澄清石灰水中加入稀盐酸_________________。②Na2SO4溶液与AgNO3溶液混合_______________________。③铵盐溶液与强碱溶液混合加热检测____________________________。
OH-+H+===H2O
(3)注意单质、浓酸的拆分(浓硫酸、浓磷酸不拆分)。①用MnO2与浓盐酸共热制Cl2________________________________________。②铜溶于浓硝酸______________________________________。
二、多重反应离子方程式的书写2.完成下列反应的离子方程式。(1)Ba(OH)2溶液与H2SO4溶液混合_________________________________________。(2)Ba(OH)2溶液与(NH4)2SO4溶液混合______________________________________________。(3)CuSO4溶液与Ba(OH)2溶液混合______________________________________________。
三、“四角度”判断离子方程式的正误3.能正确表示下列反应的离子方程式的打“√”,不能的打“×”。(1)从“拆分”视角判断①食醋去除水垢中的CaCO3:CaCO3+2H+===Ca2++H2O+CO2↑(2023·北京,6B)( )②H2SO3溶液中滴入氯化钙溶液: +Ca2+===CaSO3↓(2023·浙江1月选考,7D)( )③向氢氧化钡溶液中加入盐酸:H++OH-===H2O(2021·湖北,4A)( )
④向硝酸银溶液中滴加少量碘化钾溶液:Ag++I-===AgI↓(2021·湖北,4B)( )⑤过氧化物转化为碱: +2H2O===4OH-+O2↑(2022·广东,14C)( )⑥电解饱和食盐水:2Cl-+2H+ Cl2↑+H2↑(2018·江苏,7D)( )
(2)从原理的视角①Cl2制备84消毒液(主要成分是NaClO):Cl2+2OH-===Cl-+ClO-+H2O(2023·北京,6A)( )②SO2与KClO溶液反应:SO2+2ClO-+H2O===2HClO+ (2021·辽宁,4D)( )③乙醇与K2Cr2O7酸性溶液反应:3CH3CH2OH+ +16H+―→ 3CH3COOH+4Cr3++11H2O(2022·浙江6月选考,13C)( )
④向0.1 ml·L-1Na2CO3溶液中通入CO2,溶液pH从12下降到约为9,反应的离子方程式为: (2021·江苏,11C)( )⑤溴与冷的NaOH溶液反应:Br2+OH-===Br-+BrO-+H+(2022·浙江6月选考,13D)( )
(3)从是否符合“三守恒”的视角①利用覆铜板制作印刷电路板:2Fe3++Cu===2Fe2++Cu2+(2023·北京,6C)( )②用铝粉和NaOH溶液反应制取少量H2:Al+2OH-=== +H2↑(2019·江苏,7B)( )③NaOH溶液与I2反应的离子方程式:I2+2OH-===I-+ +H2O(2021·江苏,9A)( )④酸性硫酸亚铁溶液在空气中被氧化:4Fe2++O2+4H+===4Fe3++2H2O(2017·浙江11月选考,12C)( )
⑤高锰酸钾与浓盐酸制氯气的反应: +4Cl-+8H+===Mn2++2Cl2↑+4H2O(2018·浙江4月选考,13B)( )⑥钠与水反应:Na+2H2O===Na++2OH-+H2↑(2017·江苏,6A)( )
(4)从是否符合指定用量关系的视角①氢氧化钠溶液与过量的碳酸氢钙溶液反应:OH-+Ca2++ ===CaCO3↓+H2O(2018·浙江4月选考,13D)( )②0.1 ml·L-1 NaAlO2溶液中通入过量CO2:(2020·江苏,7C)( )③0.1 ml·L-1 AgNO3溶液中加入过量浓氨水:Ag++NH3+H2O===AgOH↓+ (2020·江苏,7D)( )
④NaHCO3溶液与少量的Ba(OH)2溶液混合: +Ba2++OH-===BaCO3↓+H2O(2022·湖南,11D)( )
1.(2022·浙江6月选考,2)下列物质属于强电解质的是A.HCOOH D.C2H2
2.下列说法正确的是A.CO2的水溶液能导电,所以CO2是电解质B.BaSO4难溶于水,其水溶液的导电能力极弱,所以BaSO4的电离方程式为BaSO4 Ba2++C.液溴不导电,所以溴是非电解质D.强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强
因为CO2+H2O H2CO3,H2CO3电离出H+和 从而使溶液导电,而不是CO2自身电离,因此H2CO3是电解质,CO2是非电解质,A错误;电解质强弱的划分不是根据其溶解度的大小,BaSO4溶解度很小,但溶于水的BaSO4完全电离,所以BaSO4是强电解质,不能用“ ”,B错误;电解质和非电解质都是化合物,液溴是单质,C错误;电解质导电能力的强弱与溶液中自由移动的离子的浓度大小以及所带的电荷多少有关,所以强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强,D正确。
石灰乳不能拆,反应为Cl2+Ca(OH)2===Ca2++ClO-+Cl-+H2O,B错误;
氨水显碱性,会与Ag+、Cu2+反应,不能大量共存,A项错误;
5.(2022·重庆,4)下列操作中,不会影响溶液中K+、Al3+、Fe3+、Ba2+、Cl-、等离子大量共存的是A.加入ZnSO4 B.加入Fe粉C.通入NH3 D.通入CO2
向溶液中加入硫酸锌,硫酸根离子会与溶液中的钡离子反应生成BaSO4沉淀,故A不符合题意;向溶液中加入铁粉,铁离子会与铁反应生成亚铁离子,故B不符合题意;向溶液中通入氨气,铝离子、铁离子会与氨水反应生成氢氧化铝、氢氧化铁沉淀,故C不符合题意;向溶液中通入二氧化碳,二氧化碳与溶液中离子均不发生反应,故D符合题意。
6.(2023·郑州高三联考)下列过程中的化学反应,相应的离子方程式正确的是A.向石灰石中加入盐酸:CaCO3+2H+===Ca2++CO2↑+H2OB.利用氢氧化钠溶液吸收废气NO2:2NO2+2OH-=== +H2OC.向硫酸镁溶液中滴加氢氧化钡溶液:Mg2++2OH-===Mg(OH)2↓D.将ICl滴入NaOH溶液中:ICl+2OH-===I-+ClO-+H2O
ICl中碘为+1价、氯为-1价,将ICl滴入NaOH溶液中发生反应生成次碘酸钠和氯化钠,反应的离子方程式为ICl+2OH-===IO-+Cl-+H2O,D错误。
7.滴有酚酞的Ba(OH)2溶液显红色,在上述溶液中分别滴加X溶液后有下列现象。下列说法不正确的是
A.实验Ⅰ中溶液红色褪去,说明发生了反应:H++OH-===H2OB.实验Ⅱ中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中依然存在大量 的Na+与OH-C.实验Ⅲ中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应: Ba2++2OH-+2H++ ===BaSO4↓+2H2OD.将实验Ⅱ中Na2SO4溶液换成CuSO4溶液,现象与原实验Ⅱ中的现象相同
CuSO4与Ba(OH)2发生复分解反应:Ba(OH)2+CuSO4===BaSO4↓+Cu(OH)2↓,溶液中离子浓度减小,灯泡逐渐变暗,氢氧根离子浓度减小,红色褪去,而且有蓝色沉淀生成,与加入Na2SO4溶液的实验现象不同,故D符合题意。
8.(2022·全国甲卷,9)能正确表示下列反应的离子方程式为A.硫化钠溶液和硝酸混合:S2-+2H+===H2S↑
9.(2023·浙江6月选考,9)下列反应的离子方程式正确的是A.碘化亚铁溶液与等物质的量的氯气:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
碘化亚铁溶液与等物质的量的氯气反应,碘离子与氯气恰好完全反应:2I-+Cl2===I2+2Cl-,故A错误;
10.(2023·北京海淀高三期末)向0.01 ml·L-1 Ba(OH)2溶液中加入几滴酚酞溶液,然后向混合液中匀速、逐滴加入0.2 ml·L-1 H2SO4溶液,滴加过程中测得溶液电导率的变化如图所示。下列说法不正确的是A.烧杯中红色逐渐变浅直至完全褪去B.由于水存在微弱电离、BaSO4存在微弱溶解,理 论上电导率不会为0
Ba(OH)2浓度减小直至反应完全,烧杯中红色逐渐变浅直至完全褪去,A正确;若用同浓度的Na2SO4溶液代替稀硫酸重复上述实验,反应生成硫酸钡沉淀,溶液中存在钠离子和氢氧根离子,电导率不会减小到几乎为0,电导率变化与原实验不相同,D错误。
11.(2023·湖南,7)取一定体积的两种试剂进行反应,改变两种试剂的滴加顺序(试剂浓度均为0.1 ml·L-1),反应现象没有明显差别的是
A项,氨水不足时,生成AgOH,AgOH极不稳定生成棕黑色Ag2O,氨水过量时,生成澄清银氨溶液;C项,向H2C2O4溶液中滴加酸性KMnO4溶液并振荡,由于开始时H2C2O4是过量的,KMnO4被完全还原,可以看到紫红色的溶液褪为无色;向KMnO4溶液中滴加酸性H2C2O4溶液并振荡,由于开始时KMnO4是过量的,可以看到紫红色的溶液逐渐变浅,最后变为无色。
12.(2023·福州第一中学高三模拟)在海洋碳循环中,通过如图所示的途径固碳。下列说法错误的是A.该循环过程中未涉及氧化还原反应
二氧化碳和水在叶绿素作用下光合作用是氧化还原反应,A错误;
13.向50 g质量分数为10.6%的Na2CO3溶液中,逐滴加入CaCl2稀溶液。测得溶液中离子的数量变化如图。请据此分析以下问题:
(1)请指出图中曲线表示的离子符号:A_____;C_____;D_____。
碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,离子方程式为 +Ca2+===CaCO3↓,反应过程中,钠离子数量不变,为曲线C;氯离子数量增大,为曲线A;碳酸根离子数量减小,为曲线B;溶液中碳酸根离子数量最小时,钙离子数量开始增大,为曲线D。
(2)反应的离子方程式为______________________。(3)当A、C曲线相交时,生成的沉淀质量为____g。
14.请按要求书写下列离子方程式:(1)向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,写出反应的离子方程式:_______________________________________________。在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为__________________________。
2025年高考化学大一轮大单元一 第一章 热点强化1 与量有关的离子方程式的书写(课件+讲义+练习): 这是一份2025年高考化学大一轮大单元一 第一章 热点强化1 与量有关的离子方程式的书写(课件+讲义+练习),文件包含大单元一第一章热点强化1与量有关的离子方程式的书写pptx、大单元一第一章热点强化1与量有关的离子方程式的书写教师版docx、大单元一第一章热点强化1与量有关的离子方程式的书写学生版docx等3份课件配套教学资源,其中PPT共12页, 欢迎下载使用。
第一章 第二讲 离子反应 离子方程式-2025年高考化学一轮总复习课件: 这是一份第一章 第二讲 离子反应 离子方程式-2025年高考化学一轮总复习课件,共55页。PPT课件主要包含了栏目索引,考点一,③④⑥,⑥⑦⑨,考点二,2发生条件,离子符号,化学反应,同一类型等内容,欢迎下载使用。
课件 高考化学一轮复习第一单元 物质及其变化 第二讲 离子反应 离子方程式: 这是一份课件 高考化学一轮复习第一单元 物质及其变化 第二讲 离子反应 离子方程式,共60页。PPT课件主要包含了夯实必备知识,电解质及其分类,不导电,氧化物,氢化物,自由移动的离子,溶于水,受热熔化,自由移动,OH-等内容,欢迎下载使用。












