






还剩48页未读,
继续阅读
所属成套资源:全套人教版高中化学选择性必修1课时教学课件
成套系列资料,整套一键下载
高中化学人教版 (2019)选择性必修1第一节 原电池集体备课ppt课件
展开
这是一份高中化学人教版 (2019)选择性必修1第一节 原电池集体备课ppt课件,共56页。PPT课件主要包含了原电池,一次电池,二次电池,燃料电池,能量转化效率,单位质量,单位体积,重金属,锂离子,干电池等内容,欢迎下载使用。
知识点一 化学电源和一次电池
1.化学电源概述(1)化学电源的分类________是各种化学电源的雏形,常分为__________、__________和__________。(2)化学电池的优点具有____________高,供能稳定可靠,使用方便,易于维护等优点。
(3)判断电池优劣的主要标准①比能量:__________或__________所能输出______的多少,单位是W·h·kg-1或W·h·L-1。②比功率:单位质量或单位体积所能输出______的大小,单位是W·kg-1或W·L-1。③电池可储存时间的长短。
(4)化学电池的回收利用使用后的废旧电池中常含有________、酸和碱等物质,随意丢弃会对生态环境和人体健康造成危害。因此,废旧电池要进行回收利用。(5)化学电源的发展方向小型化、供电方便、工作寿命长、不需要维护的电池受到人们的青睐,如______电池、________电池等。
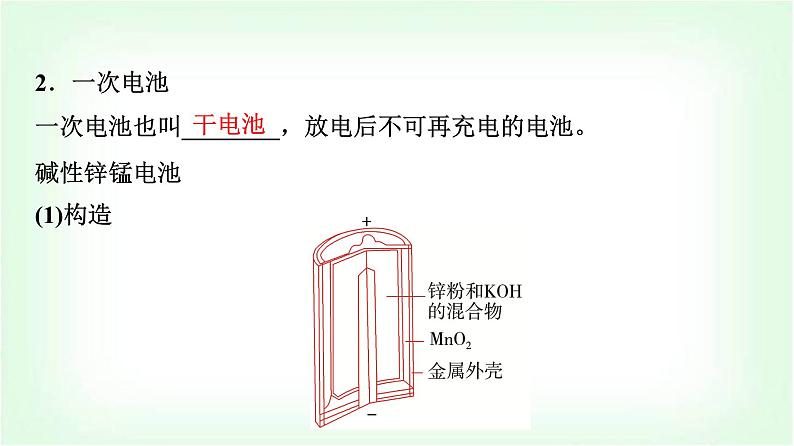
2.一次电池一次电池也叫________,放电后不可再充电的电池。碱性锌锰电池(1)构造
普通锌锰电池和碱性锌锰电池的构造如下图所示:
普通锌锰电池工作原理为Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnO(OH)。回答下列问题:(1)你能指出两种干电池中的正、负极材料及电解质溶液吗?(2)试写出碱性锌锰电池的正、负极反应式?(3)对比两种干电池,它们的优缺点是什么?(4)为什么废旧电池不能随意丢弃,要回收利用?
[提示] (1)普通锌锰电池的负极为Zn,正极为石墨棒,电解质溶液为NH4Cl糊。碱性锌锰电池的负极为Zn,正极为MnO2,电解质为KOH。(2)负极反应式:Zn+2OH--2e-===Zn(OH)2,正极反应式:MnO2+H2O+e-===MnO(OH)+OH-。(3)普通锌锰电池中的NH4Cl糊呈酸性,能腐蚀负极材料Zn,故该干电池不能长时间储存;碱性锌锰电池比普通锌锰电池性能好,它的比能量和可储存时间均有所提高,是普通锌锰干电池的升级换代产品。
(4)废旧电池中常含有重金属、酸和碱等物质,能污染水源,危害人体健康。因此,应将废旧电池回收利用,这样既可减少环境污染,又可节约资源。
1. Li-SOCl2电池可用于治疗某些心律失常所致的心脏起搏器的驱动。该电池的工作原理示意图如图所示:
下列说法错误的是( )A.负极材料为Li,发生氧化反应B.正极反应式为2SOCl2-4e-===4Cl-+S↓+SO2↑C.LiAlCl4有助于电池内部的导电D.电池工作时Cl-向Li电极移动
B [A.负极材料为Li,锂失电子发生氧化反应,故A正确;B.正极发生还原反应,根据图示,正极反应式为2SOCl2+4e-===4Cl-+S↓+SO2↑,故B错误;C.LiAlCl4有助于电池内部的导电,故C正确;D.电池工作时,阴离子向负极移动,Cl-向Li电极移动,故D正确。]
2.鱼雷采用Al-Ag2O动力电池,以溶有氢氧化钾的流动海水为电解质溶液,电池反应为2Al+3Ag2O+2KOH+3H2O===6Ag+2K[Al(OH)4]。下列说法错误的是( )A.Ag2O为电池的正极B.电子由Ag2O极经外电路流向Al极C.Al在电池反应中被氧化D.溶液中的OH-向Al极迁移
B [该原电池中,Al元素化合价由0价升高为+3价,发生氧化反应,所以Al为负极,Ag2O为正极,A、C正确;放电过程中,电子从负极沿导线流向正极即电子由Al极通过外电路流向Ag2O极,B错误;放电过程中,电解质溶液中阳离子向正极移动、阴离子向负极移动,即溶液中的OH-向Al极迁移,D正确。]
1.二次电池又称____________或________,是一类放电后可以再充电而反复使用的电池。
2.铅酸蓄电池铅酸蓄电池是一种常见的二次电池,其简易装置图、放电反应和充电反应如图所示:
(1)负极是____,正极是______,电解质溶液是________。(2)放电反应原理①负极反应式是____________________________;②正极反应式是_____________________________________________;③放电过程中,负极和正极质量的变化是均______,均生成_______,电解质溶液pH的变化是______。
LixCy-xe-===xLi++Cy
Li1-xCO2+xLi++xe-===LiCO2
放电时,锂离子由石墨中脱嵌移向正极,嵌入钴酸锂晶体中;充电时,锂离子从钴酸锂晶体中脱嵌,由正极回到负极,嵌入石墨中。这样在放电、充电时,锂离子往返于电池的正极、负极之间,完成化学能与电能的相互转化。
1.铅酸蓄电池的结构示意图如图所示,其充、放电时的电池反应为Pb+PbO2+2H2SO4 2PbSO4+2H2O。下列说法正确的是( )
题后归纳 充电电池充电、放电的原理(1)充电电池是既能将化学能转化为电能(放电),又能将电能转化为化学能(充电)的一类特殊电池。需要注意的是充电和放电的反应不互为逆反应。(2)充、放电时各电极上发生的反应
即“正接正、负接负”。
(3)充、放电电池电极反应式的书写充电时阴极(或阳极)的电极反应式与该电池放电时负极(或正极)的电极反应式刚好相反。例如,铅酸蓄电池充电、放电的过程如图所示。
[教材·资料卡片]锂离子电池具有质量小、体积小、储存和输出能量大等特点,是多种便携式电子设备(如智能手机、笔记本电脑等)和交通工具(如电动汽车、电动自行车等)的常用电池。Li-O2电池比能量高,在汽车、航天等领域具有良好的应用前景。近年来,科学家研究了一种光照充电Li-O2电池(如图所示)。光照时,光催化电极产生电子(e-)和空穴(h+),驱动阴极反应(Li++e-===Li)和阳极反应(Li2O2+2h+===2Li++O2↑)对电池进行充电。
(1)放电时,光催化电极为________ (填“负极”或“正极”)。
(2)放电时,Li+从________穿过离子交换膜向_____________迁移。(3)放电时,正极发生的反应为__________________________。(4)充电时,电池的总反应为_______________________。
O2+2Li++2e-===Li2O2
Li2O2===2Li+O2↑
1.燃料电池燃料电池是一种连续地将______和________的化学能直接转化为______的化学电源。电极本身不包含__________,只是一个催化转化元件。
2.氢氧燃料电池(1)基本构造
2H2-4e-===4H+
2H2+4OH--4e-=== 4H2O
O2+4H++4e-===2H2O
O2+4e-+2H2O=== 4OH-
2H2+O2===2H2O
3.燃料电池的优点(1)工作时,燃料和氧化剂连续地由外部供给并在电极上进行反应,生成物不断地被排出,能连续不断地提供电能。(2)能量转换率高,有利于节约能源。(3)排放的废弃物少,绿色环保。4.燃料电池电极反应式的书写方法(1)负极为燃料,失电子,发生氧化反应。如CH4碱性(KOH溶液)燃料电池负极反应式书写方法:
第二步 确定电子转移和变价元素原子守恒
O2+2H2O+4e-===4OH-
设计出燃料电池使汽油氧化直接产生电流是21世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一个电极通入汽油蒸气[以壬烷(C9H20)代表汽油],电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。回答下列问题:(1)写出该燃料电池的两极电极反应式和总反应式。(2)固体电解质中O2-的移动方向是怎样的?(3)若用KOH溶液代替固体电解质,则放电时正、负极电极反应式如何书写?总反应式如何书写?
1.判断正误(正确的打“√”,错误的打“×”)。(1)燃料电池所有能量均转化为电能。( )(2)燃料电池中通入燃料的一极为正极。( )(3)氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e-===2H2O。( )(4)燃料电池电极材料本身不参与化学反应。( )(5)以葡萄糖为燃料的微生物燃料电池,放电过程中,H+从正极区向负极区迁移。( )
2.如图是甲醇燃料电池的结构示意图,甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应式为2CH3OH+3O2===2CO2+4H2O。下列说法不正确的是( )
A.左电极为电池的负极,a处通入的物质是甲醇B.正极反应式为O2+2H2O+4e-===4OH-C.负极反应式为CH3OH+H2O-6e-===CO2↑+6H+D.该电池提供1 ml e-,消耗0.25 ml氧气
D [通入的乙烯作为燃料,发生氧化反应,通入乙烯的一极为负极,D错误。]
题后归纳 燃料电池电极反应式书写的三步骤
1.体温枪能快速检测人体体温,该体温枪所用的电池为一种银锌电池(如图所示),电池的总反应式为Zn+Ag2O+H2O===Zn(OH)2+2Ag。下列关于该电池的说法不正确的是( )
B [A.由电池总反应可知,锌失去电子化合价升高,则Zn是负极,Ag2O中银化合价降低、得到电子被还原,则Ag2O是正极,A正确;B.由选项A分析知,Zn发生氧化反应,Ag2O发生还原反应,B错误;C.原电池工作时,阴离子移向负极,阳离子移向正极,则溶液中OH-向负极移动,K+、H+向正极移动,C正确;D.负极上锌失去电子,在碱性环境中生成氢氧化锌,则电极反应为Zn+2OH--2e-===Zn(OH)2,D正确。]
2.下列有关如图所示铅酸蓄电池的说法正确的是( )
A.放电时,铅被还原B.放电时,电解质溶液pH增大C.充电时,原PbO2极接电源的负极即可复原D.放电时总反应:2PbSO4+H2O===PbO2+Pb+2H2SO4
B [A.放电时,铅作负极,化合价升高,失去电子,被氧化,故A错误;B.放电时,铅、二氧化铅和稀硫酸反应生成硫酸铅和水,稀硫酸浓度降低,因此电解质溶液pH增大,故B正确;C.放电时,PbO2极为正极,则充电时,原PbO2极接电源的正极即可复原,故C错误;D.2PbSO4+2H2O===PbO2+Pb+2H2SO4是充电时总反应,放电时总反应为PbO2+Pb+2H2SO4===2PbSO4+2H2O,故D错误。]
3.热激活电池(又称热电池)可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物一旦受热熔融,电池瞬间即可输出电能。该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。下列关于该电池的说法中,不正确的是( )
4.中国航天事业蓬勃发展,氢氧燃料电池是使用在航天领域常见的燃料电池,其反应原理如图所示。下列说法正确的是( )
A.该电池工作时实现了电能转化为化学能B.该电池中电极a是负极C.电极b的反应式为O2+4H+-4e-===2H2OD.当转移0.2 ml电子时,消耗2.24 L H2
B [A.该电池工作时实现了化学能转化为电能,故A错误;B.该电池中电极a上氢气失电子生成氢离子为负极,故B正确;C.电极b上氧气得电子生成水,电极反应为O2+4H++4e-===2H2O,故C错误;D.由负极反应H2-2e-===2H+可知,当转移0.2 ml电子时,消耗0.1 ml氢气,但气体所处状况未知,消耗氢气的体积不一定是2.24 L,故D错误。]
5.飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。(1)飞船在光照区运行时,太阳能电池帆板将________能转化为____能,除供给飞船使用外,剩余部分用镉镍蓄电池储存起来。其工作原理为
放电时,正极的电极反应式为_____________________________ ____________________;当飞船运行到阴影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性______(填“增大”“减小”或“不变”)。
(2)紧急状况下,应急电池会自动启动,工作原理为Zn+Ag2O+H2O
2Ag+Zn(OH)2,其负极的电极反应式为________________________________。
Zn+2OH--2e-===Zn(OH)2
知识点一 化学电源和一次电池
1.化学电源概述(1)化学电源的分类________是各种化学电源的雏形,常分为__________、__________和__________。(2)化学电池的优点具有____________高,供能稳定可靠,使用方便,易于维护等优点。
(3)判断电池优劣的主要标准①比能量:__________或__________所能输出______的多少,单位是W·h·kg-1或W·h·L-1。②比功率:单位质量或单位体积所能输出______的大小,单位是W·kg-1或W·L-1。③电池可储存时间的长短。
(4)化学电池的回收利用使用后的废旧电池中常含有________、酸和碱等物质,随意丢弃会对生态环境和人体健康造成危害。因此,废旧电池要进行回收利用。(5)化学电源的发展方向小型化、供电方便、工作寿命长、不需要维护的电池受到人们的青睐,如______电池、________电池等。
2.一次电池一次电池也叫________,放电后不可再充电的电池。碱性锌锰电池(1)构造
普通锌锰电池和碱性锌锰电池的构造如下图所示:
普通锌锰电池工作原理为Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnO(OH)。回答下列问题:(1)你能指出两种干电池中的正、负极材料及电解质溶液吗?(2)试写出碱性锌锰电池的正、负极反应式?(3)对比两种干电池,它们的优缺点是什么?(4)为什么废旧电池不能随意丢弃,要回收利用?
[提示] (1)普通锌锰电池的负极为Zn,正极为石墨棒,电解质溶液为NH4Cl糊。碱性锌锰电池的负极为Zn,正极为MnO2,电解质为KOH。(2)负极反应式:Zn+2OH--2e-===Zn(OH)2,正极反应式:MnO2+H2O+e-===MnO(OH)+OH-。(3)普通锌锰电池中的NH4Cl糊呈酸性,能腐蚀负极材料Zn,故该干电池不能长时间储存;碱性锌锰电池比普通锌锰电池性能好,它的比能量和可储存时间均有所提高,是普通锌锰干电池的升级换代产品。
(4)废旧电池中常含有重金属、酸和碱等物质,能污染水源,危害人体健康。因此,应将废旧电池回收利用,这样既可减少环境污染,又可节约资源。
1. Li-SOCl2电池可用于治疗某些心律失常所致的心脏起搏器的驱动。该电池的工作原理示意图如图所示:
下列说法错误的是( )A.负极材料为Li,发生氧化反应B.正极反应式为2SOCl2-4e-===4Cl-+S↓+SO2↑C.LiAlCl4有助于电池内部的导电D.电池工作时Cl-向Li电极移动
B [A.负极材料为Li,锂失电子发生氧化反应,故A正确;B.正极发生还原反应,根据图示,正极反应式为2SOCl2+4e-===4Cl-+S↓+SO2↑,故B错误;C.LiAlCl4有助于电池内部的导电,故C正确;D.电池工作时,阴离子向负极移动,Cl-向Li电极移动,故D正确。]
2.鱼雷采用Al-Ag2O动力电池,以溶有氢氧化钾的流动海水为电解质溶液,电池反应为2Al+3Ag2O+2KOH+3H2O===6Ag+2K[Al(OH)4]。下列说法错误的是( )A.Ag2O为电池的正极B.电子由Ag2O极经外电路流向Al极C.Al在电池反应中被氧化D.溶液中的OH-向Al极迁移
B [该原电池中,Al元素化合价由0价升高为+3价,发生氧化反应,所以Al为负极,Ag2O为正极,A、C正确;放电过程中,电子从负极沿导线流向正极即电子由Al极通过外电路流向Ag2O极,B错误;放电过程中,电解质溶液中阳离子向正极移动、阴离子向负极移动,即溶液中的OH-向Al极迁移,D正确。]
1.二次电池又称____________或________,是一类放电后可以再充电而反复使用的电池。
2.铅酸蓄电池铅酸蓄电池是一种常见的二次电池,其简易装置图、放电反应和充电反应如图所示:
(1)负极是____,正极是______,电解质溶液是________。(2)放电反应原理①负极反应式是____________________________;②正极反应式是_____________________________________________;③放电过程中,负极和正极质量的变化是均______,均生成_______,电解质溶液pH的变化是______。
LixCy-xe-===xLi++Cy
Li1-xCO2+xLi++xe-===LiCO2
放电时,锂离子由石墨中脱嵌移向正极,嵌入钴酸锂晶体中;充电时,锂离子从钴酸锂晶体中脱嵌,由正极回到负极,嵌入石墨中。这样在放电、充电时,锂离子往返于电池的正极、负极之间,完成化学能与电能的相互转化。
1.铅酸蓄电池的结构示意图如图所示,其充、放电时的电池反应为Pb+PbO2+2H2SO4 2PbSO4+2H2O。下列说法正确的是( )
题后归纳 充电电池充电、放电的原理(1)充电电池是既能将化学能转化为电能(放电),又能将电能转化为化学能(充电)的一类特殊电池。需要注意的是充电和放电的反应不互为逆反应。(2)充、放电时各电极上发生的反应
即“正接正、负接负”。
(3)充、放电电池电极反应式的书写充电时阴极(或阳极)的电极反应式与该电池放电时负极(或正极)的电极反应式刚好相反。例如,铅酸蓄电池充电、放电的过程如图所示。
[教材·资料卡片]锂离子电池具有质量小、体积小、储存和输出能量大等特点,是多种便携式电子设备(如智能手机、笔记本电脑等)和交通工具(如电动汽车、电动自行车等)的常用电池。Li-O2电池比能量高,在汽车、航天等领域具有良好的应用前景。近年来,科学家研究了一种光照充电Li-O2电池(如图所示)。光照时,光催化电极产生电子(e-)和空穴(h+),驱动阴极反应(Li++e-===Li)和阳极反应(Li2O2+2h+===2Li++O2↑)对电池进行充电。
(1)放电时,光催化电极为________ (填“负极”或“正极”)。
(2)放电时,Li+从________穿过离子交换膜向_____________迁移。(3)放电时,正极发生的反应为__________________________。(4)充电时,电池的总反应为_______________________。
O2+2Li++2e-===Li2O2
Li2O2===2Li+O2↑
1.燃料电池燃料电池是一种连续地将______和________的化学能直接转化为______的化学电源。电极本身不包含__________,只是一个催化转化元件。
2.氢氧燃料电池(1)基本构造
2H2-4e-===4H+
2H2+4OH--4e-=== 4H2O
O2+4H++4e-===2H2O
O2+4e-+2H2O=== 4OH-
2H2+O2===2H2O
3.燃料电池的优点(1)工作时,燃料和氧化剂连续地由外部供给并在电极上进行反应,生成物不断地被排出,能连续不断地提供电能。(2)能量转换率高,有利于节约能源。(3)排放的废弃物少,绿色环保。4.燃料电池电极反应式的书写方法(1)负极为燃料,失电子,发生氧化反应。如CH4碱性(KOH溶液)燃料电池负极反应式书写方法:
第二步 确定电子转移和变价元素原子守恒
O2+2H2O+4e-===4OH-
设计出燃料电池使汽油氧化直接产生电流是21世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一个电极通入汽油蒸气[以壬烷(C9H20)代表汽油],电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。回答下列问题:(1)写出该燃料电池的两极电极反应式和总反应式。(2)固体电解质中O2-的移动方向是怎样的?(3)若用KOH溶液代替固体电解质,则放电时正、负极电极反应式如何书写?总反应式如何书写?
1.判断正误(正确的打“√”,错误的打“×”)。(1)燃料电池所有能量均转化为电能。( )(2)燃料电池中通入燃料的一极为正极。( )(3)氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e-===2H2O。( )(4)燃料电池电极材料本身不参与化学反应。( )(5)以葡萄糖为燃料的微生物燃料电池,放电过程中,H+从正极区向负极区迁移。( )
2.如图是甲醇燃料电池的结构示意图,甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应式为2CH3OH+3O2===2CO2+4H2O。下列说法不正确的是( )
A.左电极为电池的负极,a处通入的物质是甲醇B.正极反应式为O2+2H2O+4e-===4OH-C.负极反应式为CH3OH+H2O-6e-===CO2↑+6H+D.该电池提供1 ml e-,消耗0.25 ml氧气
D [通入的乙烯作为燃料,发生氧化反应,通入乙烯的一极为负极,D错误。]
题后归纳 燃料电池电极反应式书写的三步骤
1.体温枪能快速检测人体体温,该体温枪所用的电池为一种银锌电池(如图所示),电池的总反应式为Zn+Ag2O+H2O===Zn(OH)2+2Ag。下列关于该电池的说法不正确的是( )
B [A.由电池总反应可知,锌失去电子化合价升高,则Zn是负极,Ag2O中银化合价降低、得到电子被还原,则Ag2O是正极,A正确;B.由选项A分析知,Zn发生氧化反应,Ag2O发生还原反应,B错误;C.原电池工作时,阴离子移向负极,阳离子移向正极,则溶液中OH-向负极移动,K+、H+向正极移动,C正确;D.负极上锌失去电子,在碱性环境中生成氢氧化锌,则电极反应为Zn+2OH--2e-===Zn(OH)2,D正确。]
2.下列有关如图所示铅酸蓄电池的说法正确的是( )
A.放电时,铅被还原B.放电时,电解质溶液pH增大C.充电时,原PbO2极接电源的负极即可复原D.放电时总反应:2PbSO4+H2O===PbO2+Pb+2H2SO4
B [A.放电时,铅作负极,化合价升高,失去电子,被氧化,故A错误;B.放电时,铅、二氧化铅和稀硫酸反应生成硫酸铅和水,稀硫酸浓度降低,因此电解质溶液pH增大,故B正确;C.放电时,PbO2极为正极,则充电时,原PbO2极接电源的正极即可复原,故C错误;D.2PbSO4+2H2O===PbO2+Pb+2H2SO4是充电时总反应,放电时总反应为PbO2+Pb+2H2SO4===2PbSO4+2H2O,故D错误。]
3.热激活电池(又称热电池)可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物一旦受热熔融,电池瞬间即可输出电能。该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。下列关于该电池的说法中,不正确的是( )
4.中国航天事业蓬勃发展,氢氧燃料电池是使用在航天领域常见的燃料电池,其反应原理如图所示。下列说法正确的是( )
A.该电池工作时实现了电能转化为化学能B.该电池中电极a是负极C.电极b的反应式为O2+4H+-4e-===2H2OD.当转移0.2 ml电子时,消耗2.24 L H2
B [A.该电池工作时实现了化学能转化为电能,故A错误;B.该电池中电极a上氢气失电子生成氢离子为负极,故B正确;C.电极b上氧气得电子生成水,电极反应为O2+4H++4e-===2H2O,故C错误;D.由负极反应H2-2e-===2H+可知,当转移0.2 ml电子时,消耗0.1 ml氢气,但气体所处状况未知,消耗氢气的体积不一定是2.24 L,故D错误。]
5.飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。(1)飞船在光照区运行时,太阳能电池帆板将________能转化为____能,除供给飞船使用外,剩余部分用镉镍蓄电池储存起来。其工作原理为
放电时,正极的电极反应式为_____________________________ ____________________;当飞船运行到阴影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性______(填“增大”“减小”或“不变”)。
(2)紧急状况下,应急电池会自动启动,工作原理为Zn+Ag2O+H2O
2Ag+Zn(OH)2,其负极的电极反应式为________________________________。
Zn+2OH--2e-===Zn(OH)2













