





还剩52页未读,
继续阅读
所属成套资源:全套鲁科版高中化学选择性必修第一册课时教学课件
成套系列资料,整套一键下载
鲁科版高中化学选择性必修第一册第2章第2节第1课时化学平衡常数平衡转化率基础课课件
展开
这是一份鲁科版高中化学选择性必修第一册第2章第2节第1课时化学平衡常数平衡转化率基础课课件,共60页。
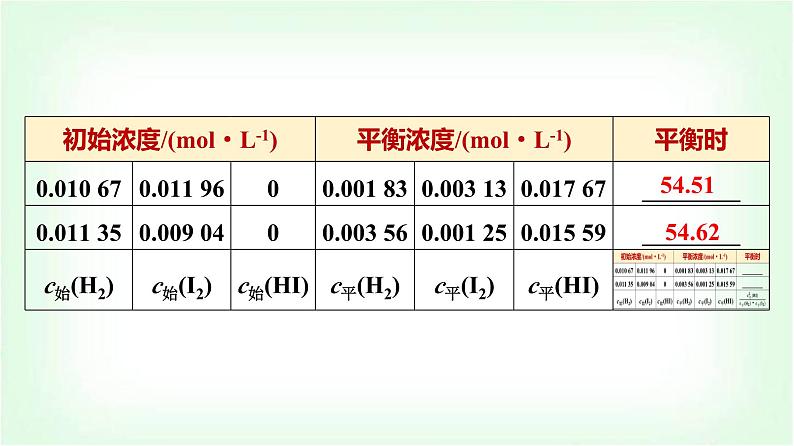
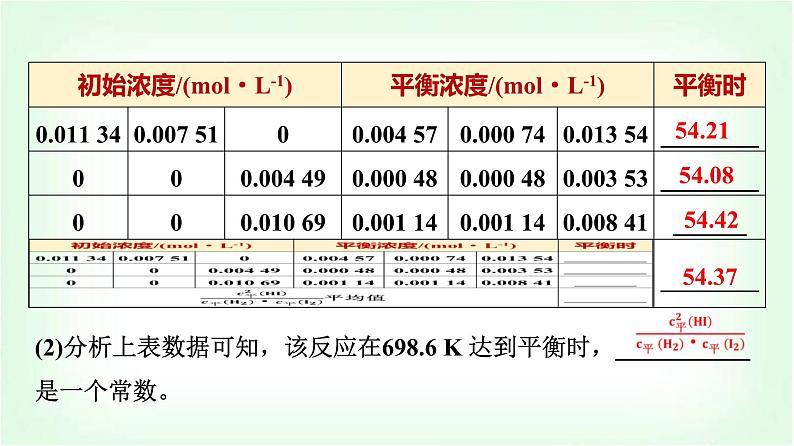
第1课时 化学平衡常数 平衡转化率(基础课)第2章 化学反应的方向、限度与速率第2节 化学反应的限度1.通过“H2(g)+I2(g)⥫⥬2HI(g)”体会化学平衡常数模型构建过程,能书写化学平衡常数表达式;能进行平衡常数、转化率的简单计算。2.能利用平衡常数和浓度商的关系判断化学反应是否达到平衡状态及平衡移动的方向。1.可逆反应的含义:在相同条件下同时向正、逆两个方向进行的反应。2.可逆反应的特征:在一定条件下反应物不可能全部转化为反应产物,反应只能进行到一定的程度,存在一定的反应限度。3.化学平衡状态:在一定条件下可逆反应进行到一定程度时,反应物和反应产物的浓度不再随时间的延长而发生变化,正反应速率和逆反应速率相等的状态。一、化学平衡常数1.交流·研讨(1)698.6 K 时反应体系H2(g)+I2(g)⥫⥬2HI(g)中各物质的浓度,如下表所示:必备知识 自主预习54.5154.62(2)分析上表数据可知,该反应在698.6 K 达到平衡时,___________是一个常数。 54.2154.0854.4254.37 程度大(3)影响因素①内因:反应物的__________。②外因:反应体系的______。本身性质温度(4)应用①判断反应可能进行的程度 逆向<平衡状态=正向>③判断反应的热效应 吸放放吸练一练 写出下列各反应的平衡常数表达式:(1)CO(g)+H2O(g)⥫⥬CO2(g)+H2(g)____________________。(2)3Fe(s)+4H2O(g)⥫⥬Fe3O4(s)+4H2(g)____________。(3)N2(g)+3H2(g)⥫⥬2NH3(g)_________________________。 2.规律(1)同一反应的不同反应物,其转化率可能不同;当按照反应系数之比投入反应物时,反应物转化率相同。(2)多种反应物参加反应时,提高一种反应物的物质的量,可以______其他反应物的转化率,而该反应物本身的转化率会______。提高降低练一练 25 ℃时,密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:则A的平衡转化率为________,B的平衡转化率为________。25%50% 在一定条件下的容积不变的密闭容器中,合成氨反应如下:关键能力 情境探究探究化学平衡状态的建立。请根据图示填表:最大最大最大减小减小减小不变不变不变1.利用速率关系判断化学平衡状态的“两角度”(1)对于同一物质而言,该物质的生成速率等于它的消耗速率。(2)对于不同物质而言,速率之比等于化学方程式中化学式前的系数之比,但必须是不同方向的速率。2.利用“变量” 与“不变量” 判断【例题】 可逆反应2NO2(g)⥫⥬2NO(g)+O2(g)在恒容的密闭容器中进行,该反应达到平衡状态的标志是( )①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部√ 思维建模判断可逆反应是否达到平衡状态的思路1.在恒温恒容的密闭体系中,可逆反应:A(s)+2B(g)⥫⥬2C(g) ΔH<0,不能作为该反应达到化学平衡的标志的是( )①v正(B)=v逆(C) ②n(B)∶n(C)=1∶1 ③容器内压强不再改变 ④容器内气体的密度不再改变 ⑤容器内混合气体的平均相对分子质量不再改变A.②④⑤ B.②③ C.①③⑤ D.③④√B [①当某反应物的正反应速率与某反应产物的逆反应速率之比等于化学式前的系数之比时,可推出v(正)=v(逆),即反应达到平衡状态;②当反应物与反应产物的物质的量之比等于化学式前的系数之比时,无法确定v(正)与v(逆)的关系,也无法判断是否达到平衡状态;③该反应Δvg=0,不管是否达到平衡状态,压强均不变;④⑤由于A为固体,当平衡发生移动时,恒容条件下气体的质量发生改变,气体的密度及平均相对分子质量都发生相应的改变,当气体的密度及平均相对分子质量不再改变时说明反应达到平衡,故答案为B。]2.(双选)对于可逆反应4NH3(g)+5O2(g)⥫⥬4NO(g)+6H2O(g),下列叙述正确的是( )A.达到平衡状态时,4v正(O2)=5v逆(NO)B.若单位时间内生成x mol NO的同时消耗x mol NH3,则反应达到平衡状态C.恒容容器中气体密度不再改变不能说明反应达到平衡状态D.化学反应速率关系:2v正(NH3)=3v正(H2O)√√AC [4v正(O2)=5v逆(NO),转化成同种物质表示的正、逆反应速率相等,即达到平衡状态,A项正确;无论是否达到平衡状态,都存在单位时间内生成x mol NO的同时消耗x mol NH3,无法判断是否达到平衡状态,B项错误;体积恒定,气体质量始终不变,密度始终不变,不能说明反应达到平衡状态,C项正确;根据反应中系数关系可知3v正(NH3)=2v正(H2O),D项错误。] ②⑥⑨[解析] 对于反应前后气体分子总数相等的可逆反应,可从化学反应速率、化学键断裂、物质的量浓度、转化率、颜色、温度等方面判断反应是否达到平衡状态。在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)⥫⥬ CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:化学平衡常数的理解与应用1.该反应的化学平衡常数K的表示式是什么? 2.该反应ΔH>0还是ΔH<0?提示:ΔH>0,该反应为吸热反应,因为K随温度升高而增大。3.在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度:c(CO2)为2 mol·L-1、c(H2)为1.5 mol·L-1、c(CO)为1 mol·L-1、c(H2O)为3 mol·L-1,则下一时刻,反应向哪个方向进行? (2)化学平衡常数是指某一具体反应的平衡常数,化学反应方向改变或化学式前的系数改变,化学平衡常数均发生改变。举例如下:(3)注意事项①K越大,反应物的转化率越高,正反应进行的程度越大。②K受温度影响,与反应物或反应产物的浓度变化无关。③催化剂能加快化学反应速率,但对化学平衡常数无影响。2.化学平衡常数的应用(1)判断反应进行程度的大小。(2)判断反应是否平衡及不平衡时的反应方向。(3)判断反应的热效应。1.(双选)已知在25 ℃时,下列反应的平衡常数如下:①N2(g)+O2(g)⥫⥬2NO(g) K1=1×10-30②2H2(g)+O2(g)⥫⥬2H2O(g) K2=2×1081 mol-1·L③2CO2(g)⥫⥬2CO(g)+O2(g) K3=4×10-92 mol·L-1 √√ √羰基硫(COS)是具有臭鸡蛋气味的无色气体,在工业生产中可用作粮食熏蒸剂,能够防止某些昆虫、线虫和真菌的危害。羰基硫可由一氧化碳与硫化氢在一定温度、常压下催化反应制得。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)⥫⥬COS(g)+H2(g) K=0.1,反应前CO的物质的量为10 mol,平衡后CO的物质的量为8 mol。有关化学平衡常数及平衡转化率的计算1.反应前H2S的物质的量是多少? 2.CO的平衡转化率为多少? 3.羰基硫(COS)的产率为多少? 1.明确三个量及其关系(1)三个量:起始量、变化量、平衡量。(2)三个关系:①对于同一反应物,起始量-变化量=平衡量。②对于同一反应产物,起始量+变化量=平衡量。③各物质的转化量之比等于化学方程式中各物质的化学式前面的系数之比。2.掌握一种方法──“三段式”法 mA(g)+nB(g)⥫⥬pC(g)+qD(g)初始浓度/(mol·L-1) a b 0 0转化浓度/(mol·L-1) mx nx px qx平衡浓度/(mol·L-1) a-mx b-nx px qx 1.在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表所示:下列说法错误的是( )A.反应达到平衡时,X的转化率为50%B.反应可表示为X(g)+3Y(g)⥫⥬2Z(g),其平衡常数为1 600 mol-2·L2C.增大压强,平衡常数增大D.改变温度可以改变此反应的平衡常数√ 2.将等物质的量的CH4和H2O(g)充入1 L恒容密闭反应器,发生反应:CH4(g)+H2O(g)⥫⥬CO(g)+3H2(g)。某温度下反应达到平衡,平衡常数K=27 mol2·L-2,此时测得CO的物质的量为0.10 mol。求:CH4的平衡转化率(计算结果保留两位有效数字)。 [答案] 91%[教材 观察·思考]1.(1)反应SO2(g)+NO2(g)⥫⥬SO3(g)+NO(g),若在一定温度下,将物质的量浓度均为2 mol·L-1的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求在该温度下,此反应的平衡常数是多少?(2)在(1)中温度下,若SO2(g)的初始浓度增大到3 mol·L-1,NO2(g)的初始浓度仍为2 mol·L-1,达到化学平衡时各物质的浓度分别是多少?[答案] (1)1(2)c平(SO3)=c平(NO)=1.2 mol·L-1,c平(SO2)=1.8 mol·L-1,c平(NO2)=0.8 mol·L-12.计算(1)中NO2的转化率,(2)中SO2、NO2的转化率并比较,你能得出什么结论? 1.(双选)一定条件下反应2AB(g)⥫⥬A2(g)+B2(g)达到平衡状态的标志是( )A.单位时间内生成n mol A2,同时消耗2n mol ABB.容器内,3种气体AB、A2、B2共存C.AB的消耗速率等于A2的消耗速率的2倍D.容器中各组分的物质的量分数不随时间变化学习效果 随堂评估√243题号1√CD [该反应无论是否达到平衡状态,都存在单位时间内生成n mol A2,同时消耗2n mol AB,A项错误;容器内3种气体AB、A2、B2共存,无法判断是否达到平衡状态,B项错误;AB的消耗速率等于A2的消耗速率的2倍,正、逆反应速率相等,此时达到平衡状态,C项正确;容器中各组分的物质的量分数不随时间变化,说明反应达到平衡状态,D项正确。]243题号1 23题号14√ 23题号41√ 23题号414.一定温度下,在密闭容器中,发生反应:2NO2(g)⥫⥬2NO(g)+O2(g),达到化学平衡时,测得混合气中NO2浓度为0.06 mol·L-1,O2的浓度为0.12 mol·L-1。求:(1)该可逆反应的平衡常数K=_______________。(2)此时NO2的转化率为________。243题号11.92 mol·L-180% 243题号1 课时分层作业(十二) 化学平衡常数 平衡转化率题号13524687910√ 题号13524687910 题号13524687910√ 3.在一定条件下,有下列分子数之比相同的可逆反应,其平衡常数K分别是① H2(g)+F2(g)⥫⥬2HF(g) K=1047;② H2(g)+Cl2(g)⥫⥬2HCl(g) K=1017;③ H2(g)+Br2(g)⥫⥬2HBr(g) K=109;④ H2(g)+I2(g)⥫⥬2HI(g) K=1。比较K大小,可知各反应的正反应进行的程度由大到小的顺序是( )A.①②③④ B.④②③① C.①④③② D.无法确定题号13524687910√A [化学平衡常数越大,表示该反应的正反应进行的程度越大,故A正确。] 题号13524687910√ 题号135246879105.对于如下反应,其反应过程的能量变化示意图如图:题号13524687910下列说法正确的是( )A.K3=K1+K2B.加催化剂,反应① 的反应热降低,反应速率加快C.ΔH3=ΔH1+ΔH2D.增大压强,K1减小,K2增大,K3不变题号13524687910√ 题号13524687910 题号13524687910√7.把7 mol A气体和5 mol B气体混合放入2 L密闭容器中,在一定条件下发生反应:3A(g)+B(g)⥫⥬2C(s)+xD(g),经5 min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.2 mol·L-1·min-1,求:(1)B的转化率为________。(2)x为_____。(3)平衡时压强与初始时压强之比为_____。(4)该温度下此反应的平衡常数为______________。题号1352468791020%2 [解析] 把7 mol A气体和5 mol B气体混合放入2 L密闭容器中,在一定条件下发生反应: 3A(g)+B(g)⥫⥬2C(s)+xD(g),经 5 min 达到平衡,此时生成2 mol C,测得D的平均反应速率为 0.2 mol·L-1·min-1,则生成D的物质的量为0.2 mol·L-1·min-1×2 L ×5 min =2 mol,则可列出三段式: 3A(g)+B(g)⥫⥬2C(s)+xD(g)初始量/mol 7 5 0 0转化量/mol 3 1 2 2平衡量/mol 4 4 2 2题号13524687910 题号13524687910(选择题有一个或两个选项符合题目要求)8.将一定量的硫氢化铵固体置于恒容密闭容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH4HS(s)⥫⥬NH3(g)+H2S(g)。下列选项中,不能用来判断该反应已达到平衡状态的是( )A.v正(NH3)=v逆(H2S)B.密闭容器中混合气体的密度不变C.密闭容器中的压强不变D.密闭容器中氨的体积分数不变题号13524687910√ 题号135246879109.在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ⥫⥬M(g)+N(g)。题号13524687910下列说法正确的是( )A.实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1B.实验②中,该反应的平衡常数K=2.0C.实验③中,达到平衡时,Y的转化率为40%D.实验④中,达到平衡时,b=0.06题号13524687910√√ 题号13524687910 题号1352468791010.100 kPa时,反应2NO(g)+O2(g)⥫⥬2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)⥫⥬N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。题号13524687910(1)图1中A、B、C三点表示不同温度、压强下2NO(g)+O2(g)⥫⥬ 2NO2(g)达到平衡时NO的转化率,则________点对应的压强最大。(2)100 kPa、25 ℃时,2NO2(g)⥫⥬N2O4(g)平衡体系中N2O4的物质的量分数为________(保留三位有效数字,下同),N2O4的分压p(N2O4)=______kPa,计算平衡常数Kp=________ kPa-1(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(3)100 kPa、25 ℃时,V mL NO与0.5V mL O2混合后最终气体的体积为________mL。题号13524687910B66.7%66.70.060 20.6V[解析] (1)图1中曲线为等压线,A、C在等压线下方,B在等压线上方,A、C点相对等压线,NO的平衡转化率减小,则平衡逆向移动,为减小压强所致,B点相对等压线,NO的平衡转化率增大,则平衡正向移动,为增大压强所致,故压强最大的点为B。题号13524687910 题号13524687910
第1课时 化学平衡常数 平衡转化率(基础课)第2章 化学反应的方向、限度与速率第2节 化学反应的限度1.通过“H2(g)+I2(g)⥫⥬2HI(g)”体会化学平衡常数模型构建过程,能书写化学平衡常数表达式;能进行平衡常数、转化率的简单计算。2.能利用平衡常数和浓度商的关系判断化学反应是否达到平衡状态及平衡移动的方向。1.可逆反应的含义:在相同条件下同时向正、逆两个方向进行的反应。2.可逆反应的特征:在一定条件下反应物不可能全部转化为反应产物,反应只能进行到一定的程度,存在一定的反应限度。3.化学平衡状态:在一定条件下可逆反应进行到一定程度时,反应物和反应产物的浓度不再随时间的延长而发生变化,正反应速率和逆反应速率相等的状态。一、化学平衡常数1.交流·研讨(1)698.6 K 时反应体系H2(g)+I2(g)⥫⥬2HI(g)中各物质的浓度,如下表所示:必备知识 自主预习54.5154.62(2)分析上表数据可知,该反应在698.6 K 达到平衡时,___________是一个常数。 54.2154.0854.4254.37 程度大(3)影响因素①内因:反应物的__________。②外因:反应体系的______。本身性质温度(4)应用①判断反应可能进行的程度 逆向<平衡状态=正向>③判断反应的热效应 吸放放吸练一练 写出下列各反应的平衡常数表达式:(1)CO(g)+H2O(g)⥫⥬CO2(g)+H2(g)____________________。(2)3Fe(s)+4H2O(g)⥫⥬Fe3O4(s)+4H2(g)____________。(3)N2(g)+3H2(g)⥫⥬2NH3(g)_________________________。 2.规律(1)同一反应的不同反应物,其转化率可能不同;当按照反应系数之比投入反应物时,反应物转化率相同。(2)多种反应物参加反应时,提高一种反应物的物质的量,可以______其他反应物的转化率,而该反应物本身的转化率会______。提高降低练一练 25 ℃时,密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:则A的平衡转化率为________,B的平衡转化率为________。25%50% 在一定条件下的容积不变的密闭容器中,合成氨反应如下:关键能力 情境探究探究化学平衡状态的建立。请根据图示填表:最大最大最大减小减小减小不变不变不变1.利用速率关系判断化学平衡状态的“两角度”(1)对于同一物质而言,该物质的生成速率等于它的消耗速率。(2)对于不同物质而言,速率之比等于化学方程式中化学式前的系数之比,但必须是不同方向的速率。2.利用“变量” 与“不变量” 判断【例题】 可逆反应2NO2(g)⥫⥬2NO(g)+O2(g)在恒容的密闭容器中进行,该反应达到平衡状态的标志是( )①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部√ 思维建模判断可逆反应是否达到平衡状态的思路1.在恒温恒容的密闭体系中,可逆反应:A(s)+2B(g)⥫⥬2C(g) ΔH<0,不能作为该反应达到化学平衡的标志的是( )①v正(B)=v逆(C) ②n(B)∶n(C)=1∶1 ③容器内压强不再改变 ④容器内气体的密度不再改变 ⑤容器内混合气体的平均相对分子质量不再改变A.②④⑤ B.②③ C.①③⑤ D.③④√B [①当某反应物的正反应速率与某反应产物的逆反应速率之比等于化学式前的系数之比时,可推出v(正)=v(逆),即反应达到平衡状态;②当反应物与反应产物的物质的量之比等于化学式前的系数之比时,无法确定v(正)与v(逆)的关系,也无法判断是否达到平衡状态;③该反应Δvg=0,不管是否达到平衡状态,压强均不变;④⑤由于A为固体,当平衡发生移动时,恒容条件下气体的质量发生改变,气体的密度及平均相对分子质量都发生相应的改变,当气体的密度及平均相对分子质量不再改变时说明反应达到平衡,故答案为B。]2.(双选)对于可逆反应4NH3(g)+5O2(g)⥫⥬4NO(g)+6H2O(g),下列叙述正确的是( )A.达到平衡状态时,4v正(O2)=5v逆(NO)B.若单位时间内生成x mol NO的同时消耗x mol NH3,则反应达到平衡状态C.恒容容器中气体密度不再改变不能说明反应达到平衡状态D.化学反应速率关系:2v正(NH3)=3v正(H2O)√√AC [4v正(O2)=5v逆(NO),转化成同种物质表示的正、逆反应速率相等,即达到平衡状态,A项正确;无论是否达到平衡状态,都存在单位时间内生成x mol NO的同时消耗x mol NH3,无法判断是否达到平衡状态,B项错误;体积恒定,气体质量始终不变,密度始终不变,不能说明反应达到平衡状态,C项正确;根据反应中系数关系可知3v正(NH3)=2v正(H2O),D项错误。] ②⑥⑨[解析] 对于反应前后气体分子总数相等的可逆反应,可从化学反应速率、化学键断裂、物质的量浓度、转化率、颜色、温度等方面判断反应是否达到平衡状态。在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)⥫⥬ CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:化学平衡常数的理解与应用1.该反应的化学平衡常数K的表示式是什么? 2.该反应ΔH>0还是ΔH<0?提示:ΔH>0,该反应为吸热反应,因为K随温度升高而增大。3.在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度:c(CO2)为2 mol·L-1、c(H2)为1.5 mol·L-1、c(CO)为1 mol·L-1、c(H2O)为3 mol·L-1,则下一时刻,反应向哪个方向进行? (2)化学平衡常数是指某一具体反应的平衡常数,化学反应方向改变或化学式前的系数改变,化学平衡常数均发生改变。举例如下:(3)注意事项①K越大,反应物的转化率越高,正反应进行的程度越大。②K受温度影响,与反应物或反应产物的浓度变化无关。③催化剂能加快化学反应速率,但对化学平衡常数无影响。2.化学平衡常数的应用(1)判断反应进行程度的大小。(2)判断反应是否平衡及不平衡时的反应方向。(3)判断反应的热效应。1.(双选)已知在25 ℃时,下列反应的平衡常数如下:①N2(g)+O2(g)⥫⥬2NO(g) K1=1×10-30②2H2(g)+O2(g)⥫⥬2H2O(g) K2=2×1081 mol-1·L③2CO2(g)⥫⥬2CO(g)+O2(g) K3=4×10-92 mol·L-1 √√ √羰基硫(COS)是具有臭鸡蛋气味的无色气体,在工业生产中可用作粮食熏蒸剂,能够防止某些昆虫、线虫和真菌的危害。羰基硫可由一氧化碳与硫化氢在一定温度、常压下催化反应制得。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)⥫⥬COS(g)+H2(g) K=0.1,反应前CO的物质的量为10 mol,平衡后CO的物质的量为8 mol。有关化学平衡常数及平衡转化率的计算1.反应前H2S的物质的量是多少? 2.CO的平衡转化率为多少? 3.羰基硫(COS)的产率为多少? 1.明确三个量及其关系(1)三个量:起始量、变化量、平衡量。(2)三个关系:①对于同一反应物,起始量-变化量=平衡量。②对于同一反应产物,起始量+变化量=平衡量。③各物质的转化量之比等于化学方程式中各物质的化学式前面的系数之比。2.掌握一种方法──“三段式”法 mA(g)+nB(g)⥫⥬pC(g)+qD(g)初始浓度/(mol·L-1) a b 0 0转化浓度/(mol·L-1) mx nx px qx平衡浓度/(mol·L-1) a-mx b-nx px qx 1.在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表所示:下列说法错误的是( )A.反应达到平衡时,X的转化率为50%B.反应可表示为X(g)+3Y(g)⥫⥬2Z(g),其平衡常数为1 600 mol-2·L2C.增大压强,平衡常数增大D.改变温度可以改变此反应的平衡常数√ 2.将等物质的量的CH4和H2O(g)充入1 L恒容密闭反应器,发生反应:CH4(g)+H2O(g)⥫⥬CO(g)+3H2(g)。某温度下反应达到平衡,平衡常数K=27 mol2·L-2,此时测得CO的物质的量为0.10 mol。求:CH4的平衡转化率(计算结果保留两位有效数字)。 [答案] 91%[教材 观察·思考]1.(1)反应SO2(g)+NO2(g)⥫⥬SO3(g)+NO(g),若在一定温度下,将物质的量浓度均为2 mol·L-1的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%,试求在该温度下,此反应的平衡常数是多少?(2)在(1)中温度下,若SO2(g)的初始浓度增大到3 mol·L-1,NO2(g)的初始浓度仍为2 mol·L-1,达到化学平衡时各物质的浓度分别是多少?[答案] (1)1(2)c平(SO3)=c平(NO)=1.2 mol·L-1,c平(SO2)=1.8 mol·L-1,c平(NO2)=0.8 mol·L-12.计算(1)中NO2的转化率,(2)中SO2、NO2的转化率并比较,你能得出什么结论? 1.(双选)一定条件下反应2AB(g)⥫⥬A2(g)+B2(g)达到平衡状态的标志是( )A.单位时间内生成n mol A2,同时消耗2n mol ABB.容器内,3种气体AB、A2、B2共存C.AB的消耗速率等于A2的消耗速率的2倍D.容器中各组分的物质的量分数不随时间变化学习效果 随堂评估√243题号1√CD [该反应无论是否达到平衡状态,都存在单位时间内生成n mol A2,同时消耗2n mol AB,A项错误;容器内3种气体AB、A2、B2共存,无法判断是否达到平衡状态,B项错误;AB的消耗速率等于A2的消耗速率的2倍,正、逆反应速率相等,此时达到平衡状态,C项正确;容器中各组分的物质的量分数不随时间变化,说明反应达到平衡状态,D项正确。]243题号1 23题号14√ 23题号41√ 23题号414.一定温度下,在密闭容器中,发生反应:2NO2(g)⥫⥬2NO(g)+O2(g),达到化学平衡时,测得混合气中NO2浓度为0.06 mol·L-1,O2的浓度为0.12 mol·L-1。求:(1)该可逆反应的平衡常数K=_______________。(2)此时NO2的转化率为________。243题号11.92 mol·L-180% 243题号1 课时分层作业(十二) 化学平衡常数 平衡转化率题号13524687910√ 题号13524687910 题号13524687910√ 3.在一定条件下,有下列分子数之比相同的可逆反应,其平衡常数K分别是① H2(g)+F2(g)⥫⥬2HF(g) K=1047;② H2(g)+Cl2(g)⥫⥬2HCl(g) K=1017;③ H2(g)+Br2(g)⥫⥬2HBr(g) K=109;④ H2(g)+I2(g)⥫⥬2HI(g) K=1。比较K大小,可知各反应的正反应进行的程度由大到小的顺序是( )A.①②③④ B.④②③① C.①④③② D.无法确定题号13524687910√A [化学平衡常数越大,表示该反应的正反应进行的程度越大,故A正确。] 题号13524687910√ 题号135246879105.对于如下反应,其反应过程的能量变化示意图如图:题号13524687910下列说法正确的是( )A.K3=K1+K2B.加催化剂,反应① 的反应热降低,反应速率加快C.ΔH3=ΔH1+ΔH2D.增大压强,K1减小,K2增大,K3不变题号13524687910√ 题号13524687910 题号13524687910√7.把7 mol A气体和5 mol B气体混合放入2 L密闭容器中,在一定条件下发生反应:3A(g)+B(g)⥫⥬2C(s)+xD(g),经5 min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.2 mol·L-1·min-1,求:(1)B的转化率为________。(2)x为_____。(3)平衡时压强与初始时压强之比为_____。(4)该温度下此反应的平衡常数为______________。题号1352468791020%2 [解析] 把7 mol A气体和5 mol B气体混合放入2 L密闭容器中,在一定条件下发生反应: 3A(g)+B(g)⥫⥬2C(s)+xD(g),经 5 min 达到平衡,此时生成2 mol C,测得D的平均反应速率为 0.2 mol·L-1·min-1,则生成D的物质的量为0.2 mol·L-1·min-1×2 L ×5 min =2 mol,则可列出三段式: 3A(g)+B(g)⥫⥬2C(s)+xD(g)初始量/mol 7 5 0 0转化量/mol 3 1 2 2平衡量/mol 4 4 2 2题号13524687910 题号13524687910(选择题有一个或两个选项符合题目要求)8.将一定量的硫氢化铵固体置于恒容密闭容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH4HS(s)⥫⥬NH3(g)+H2S(g)。下列选项中,不能用来判断该反应已达到平衡状态的是( )A.v正(NH3)=v逆(H2S)B.密闭容器中混合气体的密度不变C.密闭容器中的压强不变D.密闭容器中氨的体积分数不变题号13524687910√ 题号135246879109.在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ⥫⥬M(g)+N(g)。题号13524687910下列说法正确的是( )A.实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1B.实验②中,该反应的平衡常数K=2.0C.实验③中,达到平衡时,Y的转化率为40%D.实验④中,达到平衡时,b=0.06题号13524687910√√ 题号13524687910 题号1352468791010.100 kPa时,反应2NO(g)+O2(g)⥫⥬2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)⥫⥬N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。题号13524687910(1)图1中A、B、C三点表示不同温度、压强下2NO(g)+O2(g)⥫⥬ 2NO2(g)达到平衡时NO的转化率,则________点对应的压强最大。(2)100 kPa、25 ℃时,2NO2(g)⥫⥬N2O4(g)平衡体系中N2O4的物质的量分数为________(保留三位有效数字,下同),N2O4的分压p(N2O4)=______kPa,计算平衡常数Kp=________ kPa-1(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(3)100 kPa、25 ℃时,V mL NO与0.5V mL O2混合后最终气体的体积为________mL。题号13524687910B66.7%66.70.060 20.6V[解析] (1)图1中曲线为等压线,A、C在等压线下方,B在等压线上方,A、C点相对等压线,NO的平衡转化率减小,则平衡逆向移动,为减小压强所致,B点相对等压线,NO的平衡转化率增大,则平衡正向移动,为增大压强所致,故压强最大的点为B。题号13524687910 题号13524687910
相关资料
更多









