




高中第二节 原子结构与元素的性质教学课件ppt
展开(1)含义:元素的性质随原子的核电荷数递增发生周期性递变,这一规律叫做元素周期律。(2)实质:元素性质的周期性变化是元素原子的核外电子排布周期性变化的必然结果。
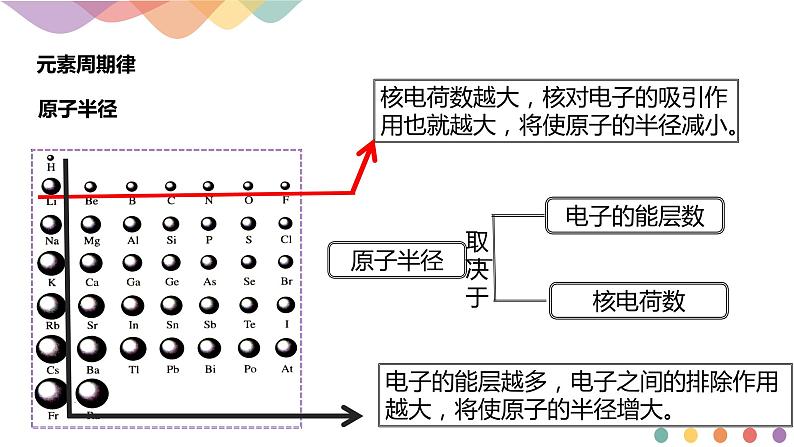
核电荷数越大,核对电子的吸引作用也就越大,将使原子的半径减小。
电子的能层越多,电子之间的排除作用越大,将使原子的半径增大。
比较下列离子半径大小(1) r(Cl-) r(Cl),r(Fe) r(Fe2+) r(Fe3+)(2) r(O2-) r(F-) r(Na+) r(Mg2+) r(Al3+)(3)r(Li+) r(Na+) r(K+) r(Rb+) r(Cs+),r(O2-) r(S2-) r(Se2-) r(Te2-)(4) r(K+) r(Na+) r(Mg2+)总结离子半径大小判断的方法
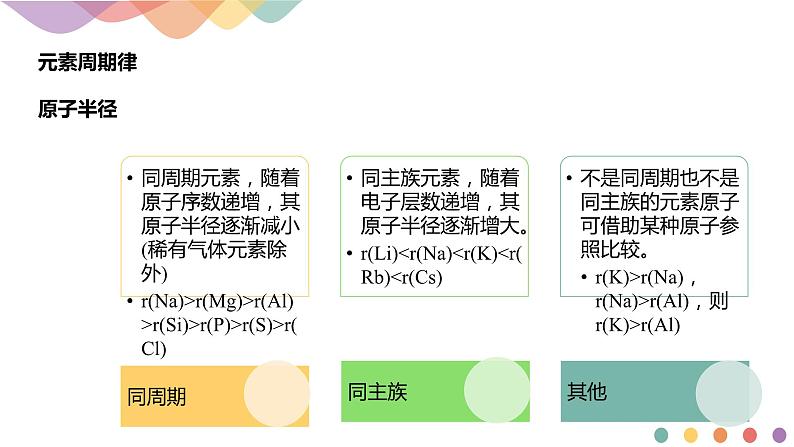
同种元素的粒子半径,阴离子大于原子,原子大于阳离子,低价阳离子大于高价阳离子 r(Cl-)>r(Cl),r(Fe)>r(Fe2+)>r(Fe3+)电子层结构相同的微粒,核电荷数越大,半径越小 r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)带相同电荷的离子,电子层数越多,半径越大 r(Li+)
气态电中性基态原子失去一个电子转化为气态基态正离子所需的最低能量,I1表示。
+1价气态正离子失去一个电子,形成+2价气态正离子所需要的最低能量叫第二电离能,用I2表示;依次类推。
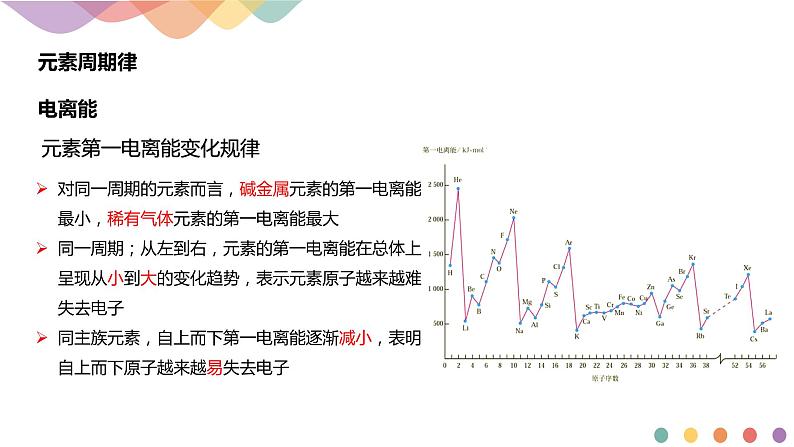
对同一周期的元素而言,碱金属元素的第一电离能最小,稀有气体元素的第一电离能最大同一周期;从左到右,元素的第一电离能在总体上呈现从小到大的变化趋势,表示元素原子越来越难失去电子同主族元素,自上而下第一电离能逐渐减小,表明自上而下原子越来越易失去电子
元素第一电离能变化规律
【学生活动】1、分析第ⅡA族和第ⅢA族,第ⅤA族和第ⅥA族第一电离能出现逆反的原因2、碱金属的电离能与碱金属的活泼性存在什么联系?
第ⅡA族元素的最外层p轨道全空,第ⅤA族元素的最外层p轨道半满,全空和半满状态相对稳定。
碱金属越活泼,碱金属的第一电离能越小
【学生活动】3、下图是钠、镁、铝的逐级电离能,为什么原子的逐级电离能越来越大?这些数据与是钠、镁、铝的化合价有什么联系?
逐级电离能增大原因:同一元素的逐级电离能是逐渐增大的,即I1<I2<I3,这是由于原子失去一个电子变成+1价阳离子,半径变小,核电荷数未变而电子数变少,核对外层电子的吸引作用增强,使第二个电子比第一电子难失去,失去第二个电子比失去第一个电子需要更多的能量。逐级电离能的突变可以判断元素的化合价。
判断元素金属性的强弱 电离能越小、金属越容易失去电子,金属性越强;反之越弱。判断元素的化合价(I1、I2示各级电离能) 如果某元素的In+1>In,则该元素的常见化合价为+n价。 如钠元素I2>I1,所以钠元素的常见化合价为+1价。
判断核外电子的分层排布情况 多电子原子中,元素的各级电离能逐渐增大,有一定的规律性。当电离能的变 化出现突变时,电子层数就有可能发生变化。反映元素原子的核外电子排布特点 同周期元素从左向右,元素的第一电离能并不是逐渐增大的,当能量相同的原子轨道在全空、半充满和全充满状态时,第一电离能就会反常得大,如I1(N)>I1(O),I1(Mg)>I1(Al)。
键合电子:原子中用于形成化学键的电子电负性:用来描述不同元素的原子对键合电子吸引力的大小电负性越大的原子,对键合电子的吸引力越大标准:以氟的电负性为4.0和锂的电负性为1.0作为相对标准,得出各元素的电负性(稀有气体未计)
同周期(稀有气体元素除外),自左向右,元素的电负性逐渐增大,元素的非金属性逐渐增强、金属性逐渐减弱同主族,自上而下,元素的电负性逐渐减小,元素的金属性逐渐增强、非金属性逐渐减弱。
判断元素的金属性和非金属性及其强弱①金属的电负性一般小于1.8,非金属的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性,又有非金属性。②金属元素的电负性越小,金属元素越活泼;非金属元素的电负性越大,非金属元素越活泼。
判断元素的化合价正负(1)电负性数值小的元素在化合物中吸引电子的能力弱,元素的化合价为正值(2)电负性数值大的元素在化合物中吸引电子的能力强,元素的化合价为负值
判断化学键的类型(1)如果两个成键元素原子间的电负性差值大于1.7,它们之间通常形成离子键(2)如果两个成键元素原子间的电负性差值小于1.7,它们之间通常形成共价键
“对角线”规则在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的,
原因是它们的电负性接近,说明它们对键合电子的吸引力相当,表现出的性质相似。
高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质完整版ppt课件: 这是一份高中化学人教版 (2019)选择性必修2<a href="/hx/tb_c4002443_t3/?tag_id=26" target="_blank">第二节 原子结构与元素的性质完整版ppt课件</a>,共21页。PPT课件主要包含了原子半径,原子半径影响因素,同周期,微粒半径比较,一般规律,电离能,元素周期律,影响因素,电子的能层数,核电荷数等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质教学ppt课件: 这是一份高中化学人教版 (2019)选择性必修2<a href="/hx/tb_c4002443_t3/?tag_id=26" target="_blank">第二节 原子结构与元素的性质教学ppt课件</a>,共60页。PPT课件主要包含了元素周期律,元素周期表,电离能电负性,原子半径大小的周期性,电子层数相同的原子,FCl,电子层排布相同的离子,等电子离子序大径小,同种元素的原子与离子,Na+等内容,欢迎下载使用。
高中第二节 反应热的计算教学ppt课件: 这是一份高中第二节 反应热的计算教学ppt课件,共25页。PPT课件主要包含了学习目标,解2巧解,C3H82220,解3十字交叉,Qcm△t,反应热的计算,根据化学方程式计算,课堂小结,根据盖斯定律计算,根据燃烧热计算等内容,欢迎下载使用。













