




高中化学第一节 原电池优质ppt课件
展开把化学能转化成电能的装置,称为原电池
①具有两个能导电的电极
②具有电解质溶液或熔融电解质
④能自发进行氧化还原反应
一般为两种活动性不同的金属或金属与能导电的非金属(石墨等)
用导线连接两极与电解质溶液共同形成闭合回路,也可以让两个电极直接接触
一般负极与电解质溶液发生氧化还原反应
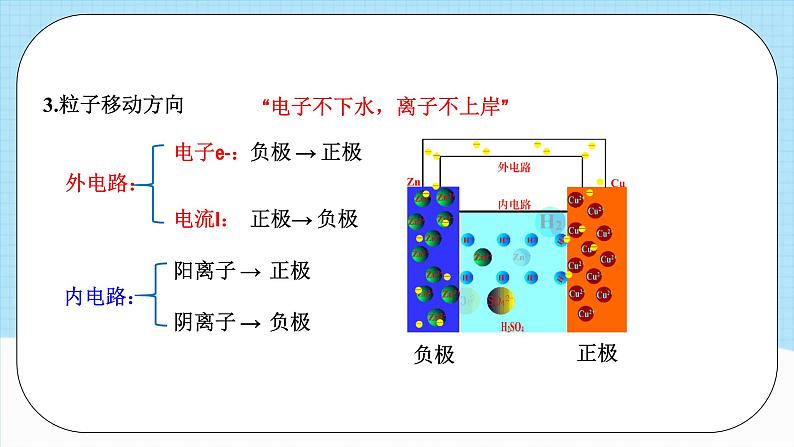
阴离子 → 负极
“电子不下水,离子不上岸”
模块一 原电池的原理
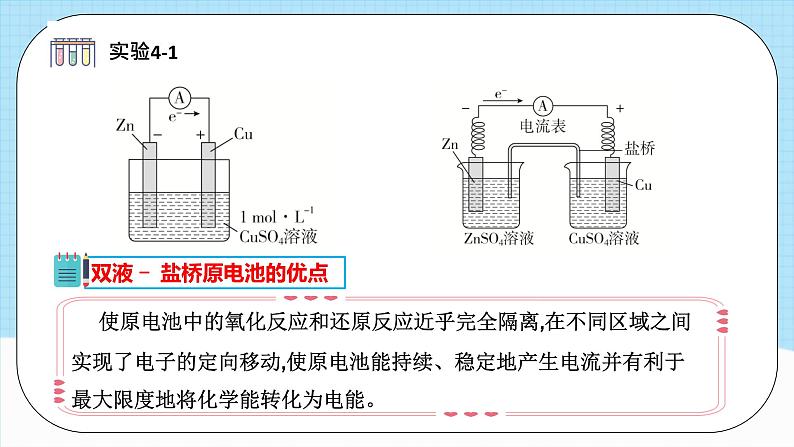
装有饱和的KCl等溶液和琼脂制成的琼胶
Zn Cu
一个原电池由两个半电池组成,一个发生氧化反应,一个发生还原反应,两个半电池用盐桥连接。半电池又叫电极
根据构成原电池的条件来设计原电池,先由电池反应写出电极反应
还原剂+氧化剂===氧化产物+还原产物
还原剂-ne-===氧化产物
氧化剂+ne-===还原产物
确定电极材料,再确定电解质溶液,最后形成闭合回路,构成原电池。
(4)画出原电池装置图。画原电池装置图时注意电极材料和导线的粗细差异,电解质溶液也要画出,并进行相应标注。
(1)根据总反应分析化合价变化,找出氧化反应和还原反应。
(2)根据负极发生氧化反应,正极发生还原反应确定原电池的正、负极。
(3)结合正、负极和电极反应确定电极材料和电解质溶液等,完成原电池装置的设计。
如在Zn与稀硫酸的反应体系中加入少量CuSO4溶液,Zn能置换出少量Cu,在溶液中Zn、Cu、稀硫酸构成原电池,可以加快产生H2的速率。
如金属a、b用导线连接后插入稀硫酸中,若金属b上有气泡产生,根据原电池原理可判断b为正极,金属活动性a>b。
特例:Mg/Al/NaOH溶液形成的原电池中 Al作负极,Mg作正极,但金属活动性:Mg>Al。
特例:Cu/Fe/浓硝酸形成的原电池中 Cu作负极,Fe作正极,但金属活动性:Fe> Cu。
如要保护一个铁闸门,可用导线将其与锌块相连,使锌块作原电池的负极,铁闸门作正极。
模块二 化学电源
将化学能变成电能的装置
广泛应用于移动电话、照相机、计算器、遥控器、汽车、卫星等。
[单位:(w·h/kg),(w·h/L)]
指电池单位质量或单位体积所能输出电能的多少
[单位:(W/kg,W/L)]
指电池单位质量或单位体积所能输出功率的大小.
放电之后不能充电(内部的氧化还原反应无法逆向进行)
一次电池的电解质溶液制成胶状,不流动,也叫做干电池。
常见一次电池有普通锌锰干电池、碱性锌锰干电池、银锌电池等。
电池电压逐渐降低,最后失效
负极:Zn—2e— === Zn2+正极:2MnO2 +2NH4+ + 2e— = 2 MnOOH + 2NH3↑
总反应:Zn+2NH4+ +2MnO2 =Zn2++2NH3↑ +2 MnOOH
容易漏液(锌外壳变薄;糊状NH4Cl显酸性)
负极: Zn + 2OH- - 2e- =Zn(OH)2
正极: 2MnO2+2H2O+2e- = 2MnO(OH) + 2OH-
总反应: Zn+2MnO2+2H2O=Zn(OH)2+ 2MnO(OH)
正极: Ag2O; 负极:Zn; 电解质: KOH溶液
Zn-2e-+2OH-=Zn(OH)2
Ag2O+H2O+2e-=2Ag+2OH-
Zn+Ag2O+H2O=2Ag+Zn(OH)2
充电电池又称二次电池,放电时所进行的氧化还原反应,在充电时又逆向进行,使电池恢复到放电前的状态。
正极: PbO2 负极:Pb 电解质溶液:稀硫酸
负极:Pb + SO42- -2e- == PbSO4
正极:PbO2 +4H+ + SO42- +2e- == PbSO4 +2H2O
负极材料:嵌锂层状石墨(LixC6 )
正极材料:钴酸锂(Li1-xCO2)
电解液:锂导电有机电解液
LixCy-xe-= xLi++Cy
Li1-xCO2+xLi+ +xe-=LiCO2
将燃料(如氢气、甲烷、乙醇)和氧化剂(如氧气)的化学能直接转化为电能的电化学反应装置,
具有清洁、安全、高效等特点。
燃料电池的能量转化率可以达到80%以上。
反应物不储存在电池内部,由外设设备提供燃料和氧化剂。
正极:2O2+8H++8e—=4H2O
总反应:CH4 + 2O2 =CO2+2H2O
酸性电解质下反应式:
负极:CH4+2H2O-8e—=CO2+8H+
正极:2O2+4H2O+8e—=8OH—
总反应:CH4 + 2O2 + 2OH—=CO32- +3H2O
碱性电解质下反应式:
负极:CH4+10 OH—-8e—=CO32-+7H2O
燃料电池书写步骤①析价态,定正负 ②列物质 ③标得失 ④看环境,配守恒
1.燃料电池不燃烧,不写“点燃”条件。 2.电极不参与反应,一般 正负电极 都为 Pt 。3.输入燃料的一极为负极,输入O2的一极为正极。4.电解质酸碱性不同,电极反应不同。
1.控制合适的条件,将反应2Fe3++2I-=2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应B.反应开始时,甲中石墨电极上Fe3+被还原C.电流计读数为零时,反应达到平衡状态D.电流计读数为零后,在甲中溶入FeCl2固体,则乙中的石墨电极为负极
2.把a、b、c、d四种金属浸入稀硫酸中,用导线两两相连组成原电池,若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,b极上产生大量气泡,则四种金属的活动性顺序为( )A.a>b>c>dB.a>c>d>bC.c>a>b>d D.b>d>c>a
3.某原电池装置如图所示。下列有关叙述中,正确的是( )A.电池工作时,盐桥中的Cl-向负极移动B.负极反应式:2H++2e-= H2↑C.工作一段时间后,两烧杯中溶液pH均不变D.Fe作正极,发生氧化反应
化学选择性必修1第一节 原电池精品ppt课件: 这是一份化学选择性必修1<a href="/hx/tb_c4002434_t3/?tag_id=26" target="_blank">第一节 原电池精品ppt课件</a>,文件包含41原电池ppt、实验4-1锌铜原电池实验mp4、实验活动4简单的电镀实验mp4、实验活动5制作简单的燃料电池mp4等4份课件配套教学资源,其中PPT共40页, 欢迎下载使用。
人教版 (2019)第一节 原电池说课课件ppt: 这是一份人教版 (2019)第一节 原电池说课课件ppt,共33页。PPT课件主要包含了构成要素,③能形成闭合回路,两根棒一桶水,原电池,温故而知新,ABCH,思考与讨论,发生氧化反应,发生还原反应,CuSO4溶液等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第一节 原电池优质课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第一节 原电池优质课件ppt,文件包含411原电池的工作原理练习解析版docx、411原电池的工作原理练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。













