


- 第14讲 电离平衡常数 强酸与弱酸比较 (含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1) 试卷 0 次下载
- 第15讲 水的电离(含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1) 试卷 0 次下载
- 第17讲 酸碱中和滴定(含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1) 试卷 0 次下载
- 第18讲 盐类的水解 (含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1) 试卷 0 次下载
- 第19讲 影响盐类水解的主要因素及盐类水解的应用 (含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1) 试卷 0 次下载
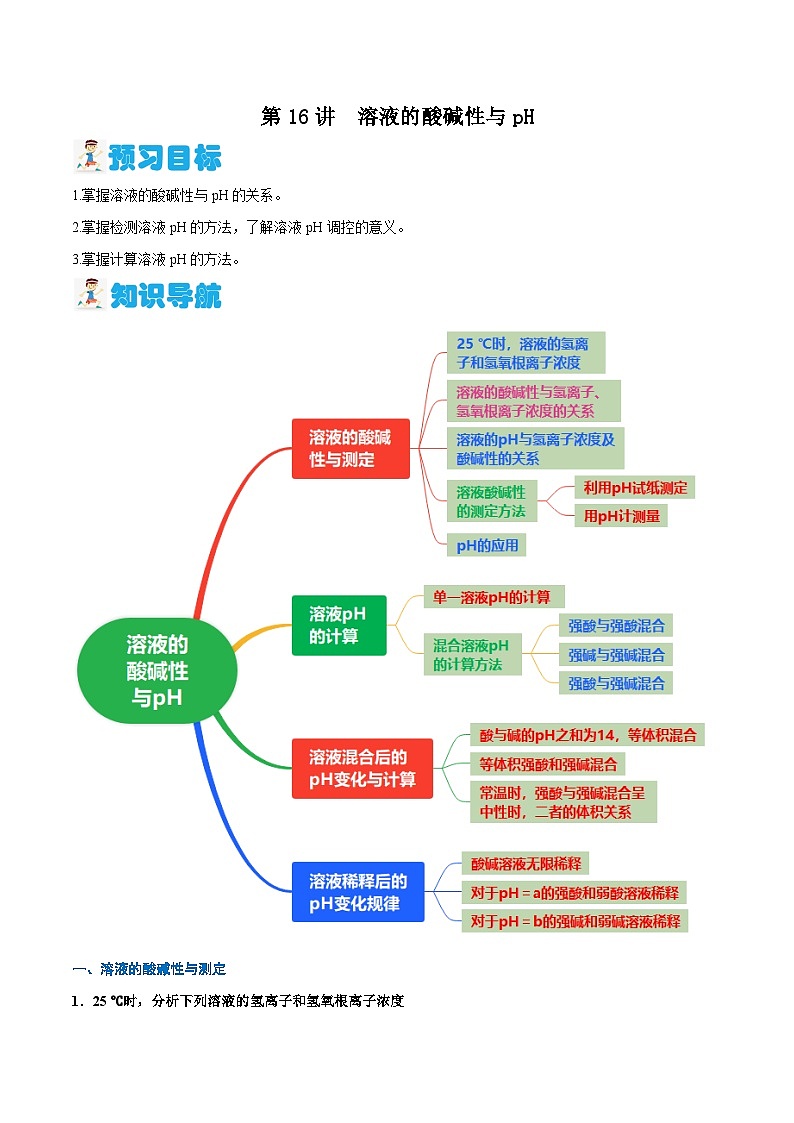
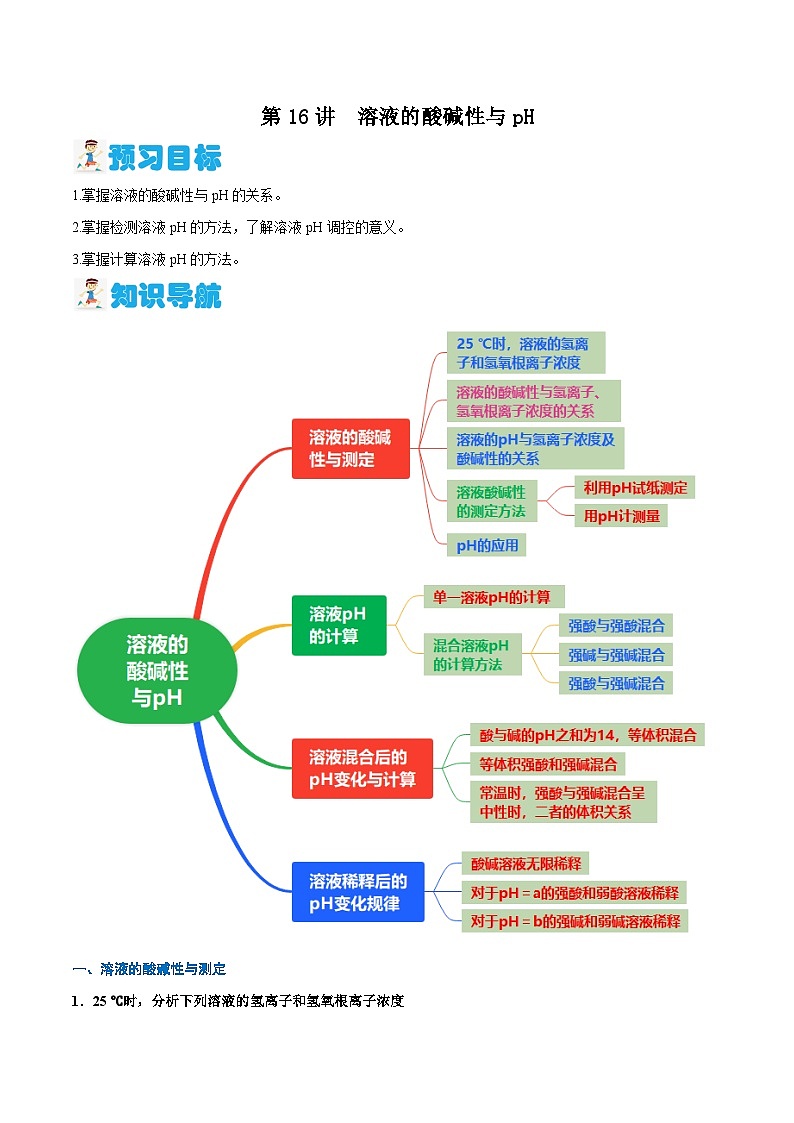
第16讲 溶液的酸碱性与pH(含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1)
展开1.掌握溶液的酸碱性与pH的关系。
2.掌握检测溶液pH的方法,了解溶液pH调控的意义。
3.掌握计算溶液pH的方法。
一、溶液的酸碱性与测定
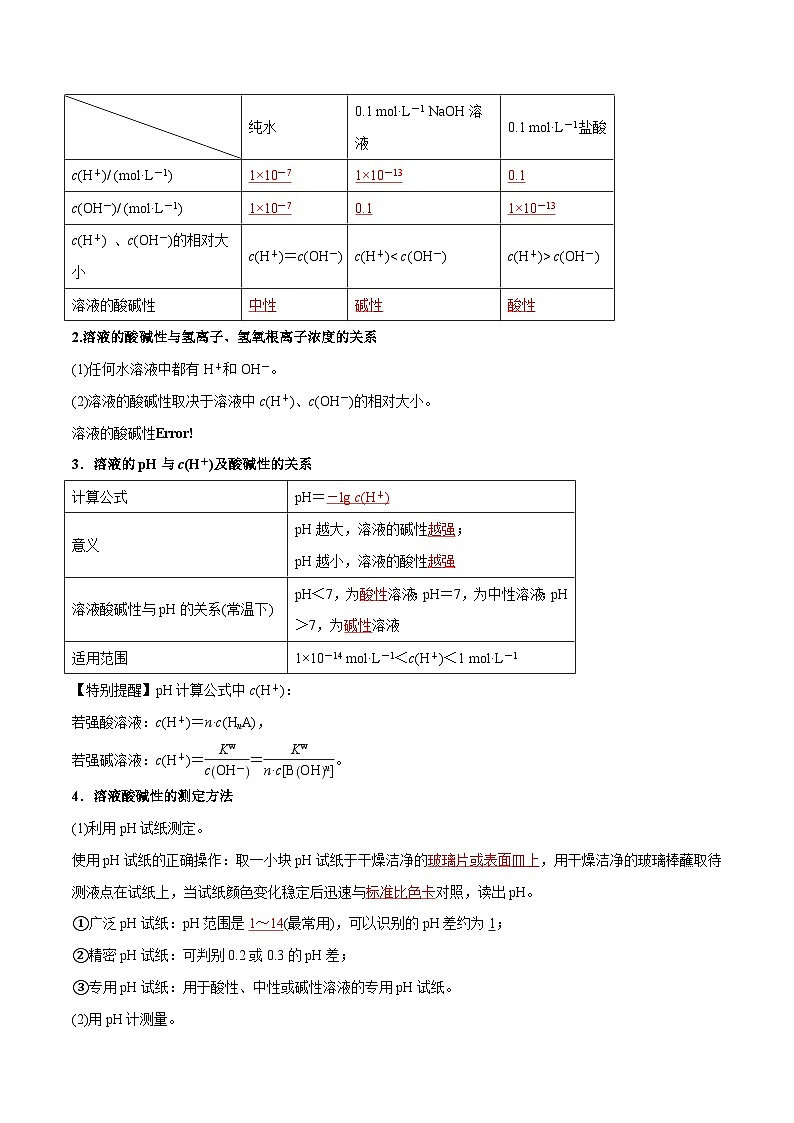
1.25 ℃时,分析下列溶液的氢离子和氢氧根离子浓度
2.溶液的酸碱性与氢离子、氢氧根离子浓度的关系
(1)任何水溶液中都有H+和OH-。
(2)溶液的酸碱性取决于溶液中c(H+)、c(OH-)的相对大小。
溶液的酸碱性eq \b\lc\{\rc\ (\a\vs4\al\c1(酸性溶液:cH+>cOH- ,中性溶液:cH+=cOH-,碱性溶液:cH+
【特别提醒】pH计算公式中c(H+):
若强酸溶液:c(H+)=n·c(HnA),
若强碱溶液:c(H+)=eq \f(Kw,cOH-)=eq \f(Kw,n·c[BOHn])。
4.溶液酸碱性的测定方法
(1)利用pH试纸测定。
使用pH试纸的正确操作:取一小块pH试纸于干燥洁净的 ,用干燥洁净的玻璃棒蘸取待测液点在试纸上,当试纸颜色变化稳定后迅速与 对照,读出pH。
①广泛pH试纸:pH范围是 (最常用),可以识别的pH差约为1;
②精密pH试纸:可判别0.2或0.3的pH差;
③专用pH试纸:用于酸性、中性或碱性溶液的专用pH试纸。
(2)用pH计测量。
pH计,又叫 ,可用来精密测量溶液的pH,其量程为 。
(3)酸碱指示剂法(只能测定溶液的pH范围)。
5.pH的应用
pH在医疗、生活、环保、农业生产和科学实验中都有重要的应用。溶液pH的控制常常是影响实验结果或产品质量、产量的一个关键因素。
【注意事项】测溶液pH时的三注意
(1)不能用湿润的玻璃棒蘸取待测液,也不能将pH试纸先用水润湿,否则会将溶液稀释,可能导致所测定的pH不准确,使酸性溶液的pH变大,碱性溶液的pH变小,但中性溶液不受影响。
(2)若某溶液具有漂白性,则不能用酸碱指示剂测定该溶液的酸碱性,也不能用pH试纸测定其pH。
(3)pH试纸不能测c(H+)>1 ml·L-1或c(OH-)>1 ml·L-1的溶液的pH。
二、溶液pH的计算
1.单一溶液pH的计算
(1)c ml·L-1 HnA强酸溶液的pH (25 ℃)
①c(H+)= ;
②pH=
(2)c ml·L-1 B(OH)n强碱溶液的pH (25 ℃)
①c(OH-)= ;
②c(H+)=eq \f(Kw,cOH-)=eq \f(10-14,nc) ml·L-1;
③pH=14+lg nc。
2.混合溶液pH的计算方法
(1)强酸与强酸混合(稀溶液体积变化忽略)
c混(H+)=eq \f(c1H+·V1+c2H+·V2,V1+V2),然后再求pH。
(2)强碱与强碱混合(稀溶液体积变化忽略)
先计算c混(OH-)=eq \f(c1OH-·V1+c2OH-·V2,V1+V2),
再求c混(H+)=eq \f(Kw,c混OH-),最后求pH。
(3)强酸与强碱混合(稀溶液体积变化忽略)
①恰好完全反应,溶液呈中性,pH=7 (25 ℃)。
②酸过量:
先求c余(H+)=eq \f(cH+·V酸-cOH-·V碱,V酸+V碱),再求pH。
③碱过量:
先求c余(OH-)=eq \f(cOH-·V碱-cH+·V酸,V酸+V碱),再求c(H+)=eq \f(Kw,c余OH-),最后求pH。
【方法技巧】
三、溶液混合后的pH变化与计算
1.酸与碱的pH之和为14,等体积混合
常温时eq \b\lc\{\rc\ (\a\vs4\al\c1(若为强酸与强碱,则pH=7,若为强酸与弱碱,则pH>7,若为弱酸与强碱,则pH<7))
2.等体积强酸(pH1)和强碱(pH2)混合
常温时eq \b\lc\{\rc\ (\a\vs4\al\c1(若pH1+pH2=14,则溶液呈中性,pH=7,若pH1+pH2>14,则溶液呈碱性,pH>7,若pH1+pH2<14,则溶液呈酸性,pH<7))
3.常温时,强酸(pH1)与强碱(pH2)混合呈中性时,二者的体积关系有如下规律:
(1)若pH1+pH2=14,则V酸=V碱。
(2)若pH1+pH2≠14,则eq \f(V酸,V碱)=。
四、溶液稀释后的pH变化规律
1.酸碱溶液无限稀释
常温下,pH只能无限 ,酸溶液pH不可能 ,碱溶液pH不可能 。
2.对于pH=a的强酸和弱酸溶液稀释
常温下,每稀释到原溶液体积的10n倍,强酸的pH就增大 个单位,即pH= ,弱酸的pH范围是: ,可用如图表示。
3.对于pH=b的强碱和弱碱溶液稀释
常温下,每稀释到原溶液体积的10n倍,强碱的pH减小 个单位,即pH= ,弱碱的pH范围是: ,可用如图表示。
4.对于物质的量浓度相同的强酸和弱酸稀释到原溶液体积的相同倍数
强酸pH变化程度比弱酸 (强碱和弱碱类似)。
弱酸、弱碱在稀释过程中有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其pH范围。
c相等的酸或碱溶液稀释后溶液pH的变化如图所示。
考点01 溶液酸碱性的判断与pH
【例1】关于溶液的说法正确的是
A.c(OH-)=c(H+)的溶液一定呈中性B.pH=7的溶液一定呈中性
C.盐溶液中水的电离不会被抑制D.能使甲基橙指示剂变黄的溶液一定呈碱性
【变式1-1】下列说法中正确的是( )
A.某溶液中c(H+)=c(OH-)=10-6ml·L-1,该溶液呈中性
B.溶液中若c(H+)>10-7ml·L-1,则c(H+)>c(OH-),溶液显酸性
C.c(H+)越大,则pH越大,溶液的酸性越强
D.pH为0的溶液,其中只有H+,无OH-
【变式1-2】将pH=3的某一元酸与pH=11的NaOH溶液等体积混合。下列说法正确的是
A.溶液可能呈碱性B.溶液一定呈酸性
C.两者的浓度可能相同D.两者一定完全反应
考点02 溶液pH的计算
【例2】已知:25℃时,Kw=1.0×10-14;100℃时,K w=1×10-12,下列说法正确的是
A.25℃时,0.2ml·L-1 Ba(OH)2溶液和0.2ml·L-1 HCl等体积混合,所得溶液的 pH=7
B.25℃时,0.2ml·L-1NaOH溶液与0.2ml·L-1CH3COOH恰好中和,所得溶液的pH=7
C.100℃时,pH=10的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7
D.25℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的pH>7
【变式2-1】常温时,浓度为的稀盐酸用蒸馏水稀释倍,则稀释后溶液的pH约为
A.2B.7C.10D.12
【变式2-2】下列叙述正确的是
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.25℃时,将pH=3的醋酸溶液与pH=12的Ba(OH)2溶液等体积混合溶液显酸性
C.0.2ml/L的硫酸,与等体积水混合pH=1
D.100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合溶液显中性
考点03 由pH确定酸碱溶液的浓度或体积
【例3】在t℃(KW=1×10-13)时,将pH=13的强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为
A.2:99B.99:2C.1:9D.9:1
【变式3-1】室温时,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中Ba2+恰好完全沉淀时,溶液pH=11,若反应后溶液体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A.1:4B.1:1C.1:2D.1:9
【变式3-2】已知在100℃的温度下(本题涉及的溶液其温度均为100℃),水的离子积KW=1.0×10-12ml2·L-2,下列说法中正确的是
A.0.1ml·L-1的H2SO4溶液,pH=1
B.0.001ml·L-1的NaOH溶液,pH=11
C.0.005ml·L-1的H2SO4溶液与0.01ml·L-1的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性
D.将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液的pH=7,则Ba(OH)2溶液与稀盐酸的体积比为2:9
考点04 溶液稀释以及pH的综合考查
【例4】pH值是判断溶液酸碱性的重要参数。室温下,下列有关溶液中的pH值判断一定正确的是
A.pH=4的番茄汁中c(H+)是pH=6的牛奶中c(H+)的100倍
B.pH=2的酸溶液和pH=12的碱溶液等体积混合后pH=7
C.某正盐溶液pH=7,则该盐一定是强酸强碱盐
D.1ml·L-1醋酸溶液加水稀释10倍后1
①分别向等体积、等物质的量浓度的盐酸和醋酸中滴加NaOH溶液,使溶液呈中性,醋酸消耗的NaOH多;
②等体积、等pH的盐酸和醋酸,分别与NaOH反应,醋酸消耗的NaOH多;
③相同条件下,将pH=2的硫酸溶液和pH=2的醋酸溶液分别稀释成pH=5的溶液,所加水的体积前者大;
④pH=3的稀硫酸跟pH=11的氢氧化钠溶液等体积混合,混合溶液的pH<7;
⑤为了通过测定pH的大小,达到比较HCl和CH3COOH酸性强弱的目的,分别配制100mL0.1ml·L-1的NaCl溶液和CH3COONa溶液测其pH;
⑥同体积同浓度的盐酸和醋酸与足量锌反应,整个反应过程的平均反应速率盐酸的快。
A.①②⑤B.③④⑤C.②④⑤D.②⑤⑥
【变式4-2】室温时,将x mL pH=a 的稀KOH溶液与ymL pH=b的稀硝酸充分反应。下列关于反应后溶液pH的判断,正确的是
A.若x=y,且a + b = 14,则pH>7B.若10x = y,且a + b = 13,则pH = 7
C.若ax=by,且a + b = 13,则pH=7D.若x = 10y,且a + b = 14,则pH>7
1.下列溶液一定显酸性的是
A.含有H+的溶液
B.滴加紫色石蕊溶液后变红色的溶液
C.溶液中c平(H+)=10-6ml·L-1
D.pH<7的溶液
2.下列说法正确的是
A.pH=0的溶液不存在B.使用广泛pH试纸测得某溶液的pH=3.5
C.中性溶液的pH不一定等于7D.适用于任何温度、任何溶液
3.下列叙述正确的是
A.25℃时,pH=3的盐酸与pH=11的氢氧化钠溶液等体积混合后pH=7
B.95℃时,纯水的pH<7,说明加热可导致水呈酸性
C.将NaCl溶液从常温加热至80℃,溶液仍保持中性,pH不变
D.用玻璃棒蘸取0.1m/LNaOH溶液滴在湿润的pH试纸中央,与标准比色卡对比,读出pH为13
4.下列关于溶液酸碱性的说法中,正确的是
A.的溶液一定显酸性
B.的溶液一定显中性
C.的溶液一定显中性
D.不能使酚酞试液变红的溶液一定显酸性
5.常温下,将pH=5的盐酸溶液稀释1000倍后,溶液的pH为
A.等于8B.等于7C.接近7又小于7D.大于7而小于8
6.现有常温下的稀溶液与的稀硫酸溶液,将二者等体积混合,所得溶液呈中性。则下列对两溶液的相关分析不正确的是
A.均为B.若,则
C.a、b均为固定值D.由水电离出的相等
7.下列说法中正确的是
A.在100℃时,pH约为6的纯水呈酸性
B.在常温下,将ml/L盐酸溶液稀释100倍,所得溶液的pH为8
C.在常温下,当水电离出的为ml/L时,此溶液的pH可能为2或12
D.当pH=11的氢氧化钠溶液和氨水各1mL分别稀释100倍,所得氨水的pH略小
8.下列说法不正确的是( )
A.25 ℃时,0.1 ml·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
B.25℃时,将0.1 ml·L-1的NaOH溶液加水稀释100倍,所得溶液的pH=11
C.25℃时,将0.1 ml·L-1的HA溶液加水稀释至pH=4,所得溶液c(OH-)=1×10-10 ml·L-1
D.由水电离出的c(H+)=10-12 ml·L-1的溶液中:Na+、、、Cl-可以大量共存
9.常温下,将0.1 ml·L─1盐酸溶液与0.06 ml·L─1氢氧化钡溶液等体积混合,该混合溶液的pH等于
A.1.7B.2.0C.12.0D.12.4
10.常温下,将的盐酸平均分成两份,向其中一份中加入适量水,向另一份中加入与该盐酸物质的量浓度相同的氢氧化钠溶液,两者的pH都升高了1,则加入的水和氢氧化钠溶液的体积之比为
A.5:1B.6:1C.10:1D.11:1
11.将pH为1的溶液加水稀释至原体积的10倍,会引起( )
A.溶液的pH变为2B.溶液中的增大
C.溶液的导电能力减弱D.溶液中的减小
12.相同温度,相同物质的量浓度的五种溶液:①NH4Cl、②NaHSO4、③NaCl、④CH3COONa、⑤Na2CO3,pH按由大到下的顺序排列正确的是
A.②>①>③>④>⑤B.③>②>①>④>⑤
C.⑤>④>③>①>②D.②>①>③>⑤>④
13.常温下,①pH=2的CH3COOH溶液;②pH=2的H2SO4溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,正确的是( )
A.水电离的c(H+):①=②=③=④
B.将②、④溶液混合后,pH=7,消耗溶液的体积:②<④
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.向10mL上述四溶液中各加入90mL水后,溶液的pH:③>④>①>②
14.常温下,有下列四种溶液:
下列说法正确的是
A.由水电离出的浓度:①>③
B.将④加蒸馏水稀释至原来的100倍时,所得溶液的
C.①与③混合,若溶液,则体积:
D.①与②等体积混合,混合溶液的
15.25℃时的三种溶液:①pH=2的醋酸;②pH=2的硫酸;③pH=12的氢氧化钠溶液。下列有关说法正确的是
A.将①溶液用蒸馏水稀释,使体积扩大100倍,所得溶液pH变为4
B.①与②两溶液的物质的量浓度相等
C.①与③两溶液等体积混合,混合液的pH=7
D.V1 L ②溶液和V2L ③溶液混合,若混合后溶液pH=3,则V1∶V2=11∶9
纯水
0.1 ml·L-1 NaOH溶液
0.1 ml·L-1盐酸
c(H+)/ (ml·L-1)
c(OH-)/ (ml·L-1)
c(H+) 、c(OH-)的相对大小
c(H+)=c(OH-)
c(H+)< c(OH-)
c(H+)> c(OH-)
溶液的酸碱性
计算公式
pH=
意义
pH越大,溶液的碱性 ;
pH越小,溶液的酸性
溶液酸碱性与pH的关系(常温下)
pH<7,为 溶液;pH=7,为中性溶液;pH>7,为 溶液
适用范围
1×10-14 ml·L-1<c(H+)<1 ml·L-1
①
②
③
④
0.1ml/L的NaOH溶液
pH=11的NaOH溶液
0.1ml/L的CH3COOH溶液
pH=3的CH3COOH溶液
第12讲 化学反应的调控 (含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1): 这是一份第12讲 化学反应的调控 (含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1),文件包含第12讲化学反应的调控原卷版暑假弯道超车2024年新高二化学暑假讲义+习题人教版2019选择性必修1docx、第12讲化学反应的调控解析版暑假弯道超车2024年新高二化学暑假讲义+习题人教版2019选择性必修1docx等2份试卷配套教学资源,其中试卷共21页, 欢迎下载使用。
第11讲 化学反应的方向 (含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1): 这是一份第11讲 化学反应的方向 (含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1),文件包含第11讲化学反应的方向原卷版暑假弯道超车2024年新高二化学暑假讲义+习题人教版2019选择性必修1docx、第11讲化学反应的方向解析版暑假弯道超车2024年新高二化学暑假讲义+习题人教版2019选择性必修1docx等2份试卷配套教学资源,其中试卷共18页, 欢迎下载使用。
第08讲 化学平衡常数 (含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1): 这是一份第08讲 化学平衡常数 (含答案)【暑假弯道超车】2024年新高二化学暑假讲义+习题(人教版2019选择性必修1),文件包含第08讲化学平衡常数原卷版暑假弯道超车2024年新高二化学暑假讲义+习题人教版2019选择性必修1docx、第08讲化学平衡常数解析版暑假弯道超车2024年新高二化学暑假讲义+习题人教版2019选择性必修1docx等2份试卷配套教学资源,其中试卷共22页, 欢迎下载使用。












