





2024长沙中考化学一轮复习 微专题6 复分解反应及共存(课件)
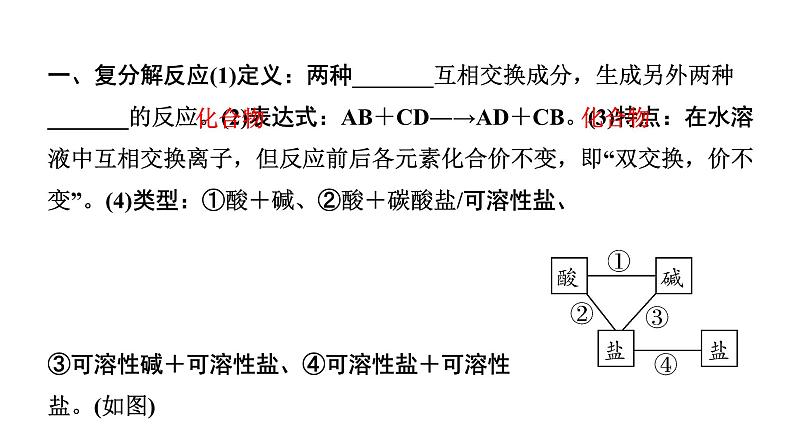
展开一、复分解反应(1)定义:两种_______互相交换成分,生成另外两种_______的反应。(2)表达式:AB+CD―→AD+CB。(3)特点:在水溶液中互相交换离子,但反应前后各元素化合价不变,即“双交换,价不变”。(4)类型:①酸+碱、②酸+碳酸盐/可溶性盐、③可溶性碱+可溶性盐、④可溶性盐+可溶性盐。(如图)
(5)条件:生成物中有_____或____或______。
AgCl、BaSO4:不溶于水,也不溶于酸CaCO3、BaCO3、Mg(OH)2、Al(OH)3、Fe(OH)3、Cu(OH)2:不溶于水,但溶于酸
1. (2021长沙)根据下列各组提供的试剂,判断不能发生反应的一组是( )A. Na2SO4溶液和Ba(NO3)2溶液B. NaOH溶液和稀硫酸C. KNO3溶液和 CaCl2溶液D. Na2CO3溶液和稀盐酸
2. (2022广州)下列物质混合后能够反应,且有明显现象的是( )A. 向氧化铁粉末中滴入氢氧化钠溶液B. 向稀硫酸中滴入稀氢氧化钾溶液C. 将硫酸铵与熟石灰混合研磨D. 向澄清石灰水中滴入氯化钡溶液
3. (不定项选择)(2022绥化)对化学反应A+B=== C+D的下列说法中正确的是( )A. 若A是稀硫酸,则生成物中一定有水B. 若C、D是盐和水,则A、B不一定是酸和碱C. 若A是可溶性碱,B是可溶性盐,则C、D不可能是两种沉淀D. 若A、B、C、D都是化合物,则该反应不一定是复分解反应
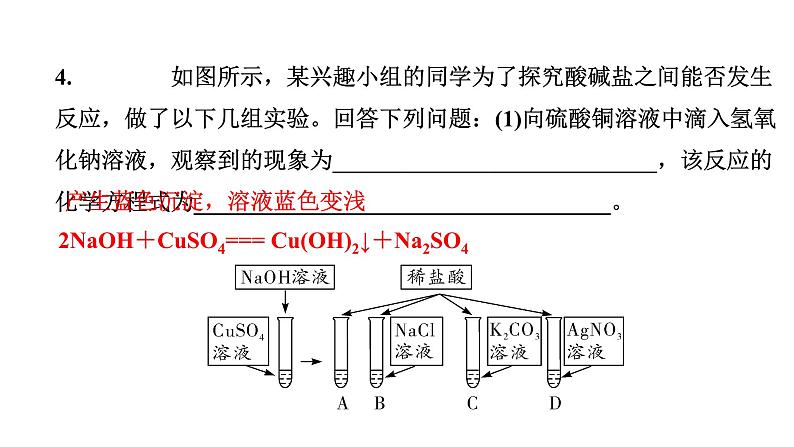
4. 如图所示,某兴趣小组的同学为了探究酸碱盐之间能否发生反应,做了以下几组实验。回答下列问题:(1)向硫酸铜溶液中滴入氢氧化钠溶液,观察到的现象为____________________________,该反应的化学方程式为____________________________________。
产生蓝色沉淀,溶液蓝色变浅
2NaOH+CuSO4=== Cu(OH)2↓+Na2SO4
(2)B试管中无明显现象,不能发生复分解反应,理由是__________________________________________________。(3)观察到C试管中___________,于是得出结论:稀盐酸能与碳酸钾发生反应。(4)D试管中有白色沉淀生成,于是得出结论:稀盐酸能与硝酸银发生反应。反应的化学方程式为______________________________。
没有沉淀、气体或水生成,不符合复分解反应发生的条件
HCl+AgNO3=== AgCl↓+HNO3
5. 某化学兴趣小组的同学为了探究“复分解反应发生的条件”,将CuSO4溶液、NaOH溶液、BaCl2溶液两两混合,实验结束后将三支试管中所有废液倒入同一个干净的烧杯中,充分混合后过滤,得到滤液呈无色。(1)上述三个反应中不能发生复分解反应的是____(填字母)。
(2)写出废液混合后使滤液变无色时一定发生的是氢氧化钠和________(化学式)的反应。(3)取少量滤液于试管中,滴入酚酞溶液,酚酞溶液呈红色,该小组的同学认为滤液成分一定有_____________(化学式)。除上述成分外,对滤液中其余溶质的成分继续进行了如下探究实验:
【作出猜想】猜想Ⅰ:BaCl2;猜想Ⅱ:________。【实验探究】
取少量滤液于试管中,加入适量的Ba(OH)2
(4)【交流拓展】要使蓝色溶液变成无色,还可以用不同于上述原理的化学方法,即在蓝色溶液中加入__________________。
____+OH- === H2O______+OH- === NH3↑+H2O______+2OH- === ________↓(蓝色沉淀)______+3OH- === ________↓(红褐色沉淀)______+2OH- === Mg(OH)2↓(白色沉淀)
二、物质的共存1. 条件:(1)组内物质可溶。(2)在同一溶液中,各物质(即所含离子)之间不发生反应,即不会生成沉淀或气体或水。2. 常见的不能共存的离子对
2____+ === H2O+CO2↑______+ === BaCO3↓(白色沉淀)______+ === CaCO3↓(白色沉淀)
+______=== ______↓(不溶于酸)Cl-+_____ === ______↓ (不溶于酸) +H+ === H2O + CO2↑
3. 物质共存中的隐含条件(1)溶液为电中性(不显电性),即在同一组内物质的离子中,既含阳离子又含阴离子。(2)“酸碱性或pH”条件型:酸性或pH<7,说明溶液中大量存在____;碱性或pH>7,说明溶液中大量存在______。(3)“无色”条件型:溶液中没有Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄色)等。
1. (2023长沙适应性测试卷1)下列物质能在pH=12的无色溶液中大量共存的是( )A. NaNO3、FeCl3、NaClB. H2SO4、AgNO3、K2SO4C. BaCl2、NH4Cl、CuCl2D. NaNO3、Na2CO3、NaOH
2. (2020丹东)下列各组物质的溶液混合后为无色透明溶液,且能在pH=1的溶液中大量共存的是( )A. FeCl3、NH4Cl、K2SO4B. KCl、Na2SO4、HClC. K2CO3、CaCl2、NaClD. Ba(NO3)2、Ca(OH)2、NaNO3
3. (2020荆州)已知某无色溶液中大量共存的物质有KNO3、NaOH、X、BaCl2,其中X可能是( )A. CuSO4 B. K2CO3 C. NaNO3 D. MgCl24. 化学兴趣小组的同学分析某无色透明溶液中含三种溶质,其中正确的是( )A. CuSO4 、H2SO4 、HNO3 B. HCl、 NaOH 、NH4ClC. CaCl2 、K2CO3、KNO3 D. NaNO3、Na2SO4、KCl
5. (2023株洲)下列选项中各溶质的溶液混合,无明显现象的是( )A. NaCl、BaCl2、KNO3B. CuSO4、NaOH、KClC. BaCl2、Na2SO4、HClD. CaCl2、Na2CO3、KNO3
6. 甲、乙两化工厂分布如图所示。箭头代表水流方向,如果在a处取水样检测,水中含有少量NaOH、Na2SO4,在c处取水样检测,pH=7且水中只含有少量NaCl,则b处水中含有的一组物质是( )A. MgSO4 NaClB. H2SO4 Ba(NO3)2C. BaCl2 HClD. H2SO4 MgCl2
7. (2023广西北部湾)下列各组离子在指定的溶液中,能大量共存的一组是( )A. 无色溶液中: K+、Na+、 、 B. 酸性溶液中:Mg2+、Na+、 、Cl-C. pH=11的溶液中:Zn2+、Ba2+、 、Cl-D. 含有大量Ba2+的溶液中:K+、 、 、
8. (2023济宁)为确定某溶液中含有以下离子H+、Mg2+、Ba2+、Cl-、 、 中的几种,进行了以下实验:①经测定,溶液pH=1;②取部分未知溶液,加入过量NaOH溶液,有白色沉淀产生;③取②中部分溶液,加入Na2CO3溶液,无明显现象。
2024长沙中考化学一轮复习 微专题5 中和反应的探究(课件): 这是一份2024长沙中考化学一轮复习 微专题5 中和反应的探究(课件),共19页。PPT课件主要包含了实验装置,溶液由无色变为红色,OH-,H2O,NaCl和NaOH,NaCl,NaCl和HCl,金属如Fe,Cl-,溶液由红色变为无色等内容,欢迎下载使用。
2024长沙中考化学一轮复习 微专题7 碱变质的探究(课件): 这是一份2024长沙中考化学一轮复习 微专题7 碱变质的探究(课件),共20页。PPT课件主要包含了无色酚酞溶液,有气泡产生,产生白色沉淀,硫酸铜,溶液变为红色,稀盐酸,碳酸钙和碳酸钠等内容,欢迎下载使用。
2024长沙中考化学一轮复习 微专题1 化学用语(课件): 这是一份2024长沙中考化学一轮复习 微专题1 化学用语(课件),共11页。PPT课件主要包含了H2O,CO2,SO2,P2O5,CaO,MgO,Al2O3,Fe2O3,CuO,MnO2等内容,欢迎下载使用。












