





第四章 非金属及其化合物 第2讲 卤族元素和其单质的制取-2025届高考化学一轮复习课件
展开导航•课标要求 1.掌握卤素的性质及Cl-、Br-、I-的检验。2.掌握溴、碘单质的提取。3.结合实例认识卤素及其化合物的多样性,了解通过化学反应可以探索物质性质、实现物质转化。
考点一 卤素的性质 卤素离子的检验
考点二 氯、溴、碘单质的制取
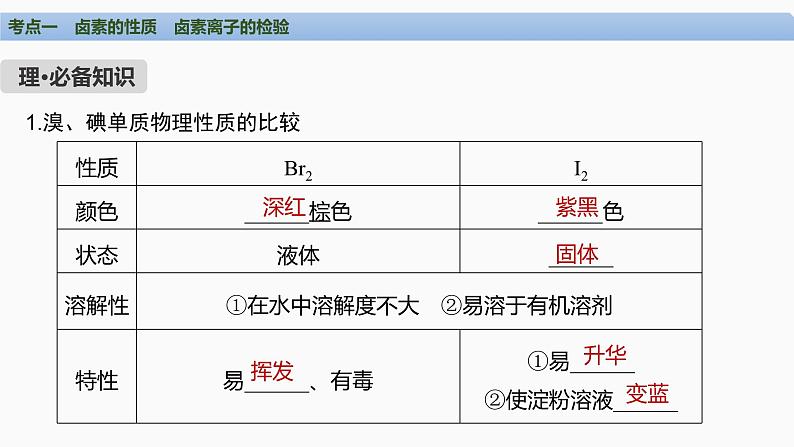
1.溴、碘单质物理性质的比较
2.氯、溴、碘单质化学性质的比较
NaX+NaXO+H2O
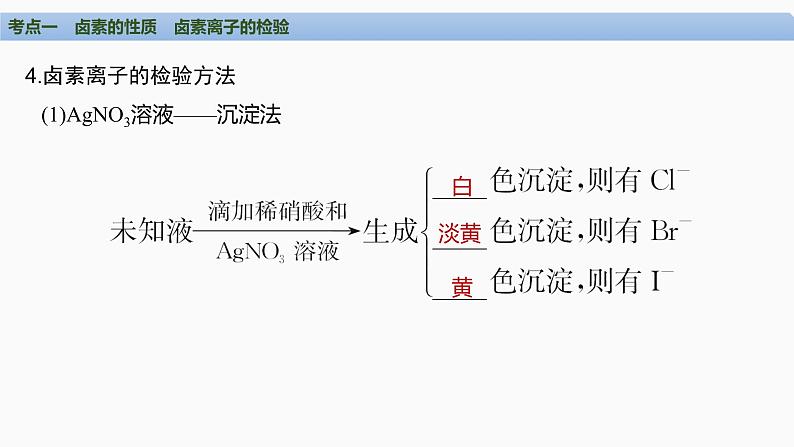
4.卤素离子的检验方法 (1)AgNO3溶液——沉淀法
【判一判】 正误判断(正确打“√”,错误打“×”)。
(1)卤素气态氢化物的水溶液都是强酸溶液。( )(2)浓H2SO4能干燥HCl,所以浓硫酸也能干燥HBr。( )(3)加碘盐能使淀粉变蓝。( )(4)清洗碘升华实验所用试管的操作是先用酒精清洗,再用水清洗。( )(5)液溴易挥发,在存放液溴的试剂瓶中应加水封。( )(6)碘易溶于酒精,所以可用酒精将碘萃取出来。( )(7)用加热的方法可将NaHCO3中混有的少量碘除去。( )答案 (1)× (2)× (3)× (4)√ (5)√ (6)× (7)×
题组一 卤素的性质1.如图是卤素单质(F2、Cl2、Br2、I2)的沸点与相对分子质量的关系图,下列说 法错误的是( )
A.单质①是最活泼的非金属单质B.单质②能使品红溶液褪色C.单质④能使淀粉溶液变蓝D.单质的氧化性:④>③>②>①
解析 从F2→I2,相对分子质量逐渐增大,沸点也逐渐升高,故①为F2,②为Cl2,③为Br2,④为I2。F2是最活泼的非金属单质;单质的氧化性:①>②>③>④,D项错误。
2.为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪 器已略去,气密性已检查)。
实验过程:Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。Ⅳ.……
(1)A中产生黄绿色气体,其电子式是_____________________________________。(2)验证氯气的氧化性强于碘的实验现象是_______________________________。(3)B中溶液发生反应的离子方程式是____________________________________。(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是______________________。(5)过程Ⅲ实验的目的是_________________________________________。(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,________,得电子能力逐渐减弱。
题组二 拟卤素和卤素互化物3.氰[(CN)2]的结构简式为N≡C—C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间。 (1)写出(CN)2的电子式: _________________________________________。 (2)写出(CN)2在常温下与烧碱溶液反应的化学方程式:___________________。 (3)在KBr、KI、KCN的混合溶液中通入少量氯气,发生反应的离子方程式为______________________________________________________________。 答案 (1):NCCN: (2)(CN)2+2NaOH===NaCN+NaCNO+H2O (3)2I-+Cl2===I2+2Cl-
4.一氯化碘(ICl)、三氯化碘(ICl3)是卤素互化物,它们的性质与卤素单质相似。
(1)ICl3与水反应的产物可能为______________________________(填化学式)。(2)ICl在常温下与烧碱溶液反应的离子方程式为__________________________,该反应是否是氧化还原反应?________(填“是”或“否”)。答案 (1)HCl、HIO2(2)ICl+2OH-===Cl-+IO-+H2O 否
题组三 卤素离子的检验5.下列能够检验出KI中是否含有Br-的实验是( )
A.加入足量新制氯水,溶液变色,则含有Br-B.加入酸性KMnO4溶液,观察溶液颜色是否褪去C.加入少量碘水,再加入CCl4振荡,有机层有色,则含有Br-D.加入足量FeCl3溶液,用CCl4萃取后,取水层并加入足量新制氯水,溶液呈 橙色,则含有Br-
6.下列叙述中正确的是( )
A.能使湿润的淀粉-KI试纸变成蓝色的物质一定是Cl2B.用硝酸酸化的硝酸银溶液能一次鉴别NaCl、NaBr、KI三种失去标签的溶液C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-D.某浅黄色的溴水,加入CCl4振荡静置后,上层显橙红色解析 还有很多氧化剂(如HNO3、O3等)能将I-氧化为I2,A项错误;碘单质的CCl4溶液显紫红色,C项错误;CCl4的密度比水大,下层显橙红色,D项错误。
1.氯的制取——氯碱工业
2.海水提溴 (1)工艺流程
1.从淡化海水中提取溴的流程如下:
下列有关说法不正确的是( )A.X试剂可用Na2SO3饱和溶液B.步骤Ⅲ的离子反应:2Br-+Cl2===2Cl-+Br2C.工业上每获得1 ml Br2,理论上需要消耗Cl2 44.8 LD.步骤Ⅳ为蒸馏
2.从海带中提取碘单质,成熟的工艺流程如下,下列关于海带提碘的说法不正 确的是( )
解析 灼烧固体应使用坩埚,A项说法错误;酸性条件下H2O2能将I-氧化为I2,B项说法正确;淀粉遇碘变蓝,C项说法正确;将碘水加入CCl4中,通过萃取、分液可得到I2的CCl4溶液,D项说法正确。
3.用离子交换法从海带中提取碘是一种较为先进的制碘工艺应用技术。
(1)操作Ⅰ的正确图示为________(填字母)。(2)在清液中加入H2SO4和NaClO溶液后,溶液最终变为棕红色,该步骤中NaClO的量要适中,请说明原因: _____________________________________。
1.(2022·辽宁卷)镀锌铁钉放入棕色的碘水中,溶液褪色;取出铁钉后加入少量漂白粉,溶液恢复棕色;加入CCl4,振荡,静置,液体分层。下列说法正确的是( ) A.褪色原因为I2被Fe还原 B.液体分层后,上层呈紫红色 C.镀锌铁钉比镀锡铁钉更易生锈 D.溶液恢复棕色的原因为I-被氧化
解析 A.Zn比Fe活泼,更容易失去电子,还原性更强,先与I2发生氧化还原反应,故溶液褪色原因为I2被Zn还原,A项错误;B.液体分层后,I2在CCl4层,CCl4的密度比水大,则下层呈紫红色,B项错误;C.若镀层金属活泼性大于Fe,则Fe不易生锈,反之,若Fe活泼性大于镀层金属,则Fe更易生锈,由于活泼性:Zn>Fe>Sn,则镀锡铁钉更易生锈,C项错误;D.漂白粉的有效成分为Ca(ClO)2,其具有强氧化性,可将I-氧化,D项正确。
2.(2018·江苏卷)下列有关从海带中提取碘的实验原理和装置能达到实验目的的 是( )
A.用装置甲灼烧碎海带B.用装置乙过滤海带灰的浸泡液C.用装置丙制备用于氧化浸泡液中I-的Cl2D.用装置丁吸收氧化浸泡液中I-后的Cl2尾气
解析 灼烧应在坩埚中进行,A项错误;海带灰浸泡液通过过滤可得海带灰和滤液,B项正确;浓HCl与MnO2反应制备Cl2时需要加热,C项错误;Cl2在饱和NaCl溶液中的溶解度小,应用碱液吸收,D项错误。
3.(2021·全国甲卷节选)碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染 料等方面。回答下列问题: (1)I2的一种制备方法如下图所示:
①加入Fe粉进行转化反应的离子方程式为________________,生成的沉淀与硝酸反应,生成________________________后可循环使用。
②通入Cl2的过程中,若氧化产物只有一种,反应的化学方程式为___________________________________________________________________;若反应物用量比n(Cl2)/n(FeI2)=1.5时,氧化产物为________;当n(Cl2)/n(FeI2)>1.5后,单质碘的收率会降低,原因是_______________________。
(2)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2。上述制备I2的总反应的离子方程式为_____________________________________________________。
1.(2024·吉林省实验中学模拟)下列关于F、Cl、Br、I性质的比较,不正确的是 ( )
A.它们的原子核外电子层数随核电荷数的增加而增多B.被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大C.它们的氢化物的稳定性随核电荷数的增加而增强D.单质的颜色随核电荷数的增加而加深
解析 F、Cl、Br、I原子核外电子层数分别为2、3、4、5,元素的非金属性逐渐减弱,则被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大,A、B正确;F、Cl、Br、I元素的非金属性逐渐减弱,则对应氢化物的稳定性逐渐减弱,C错误;F、Cl、Br、I单质的颜色分别为浅黄绿色、黄绿色、红棕色、紫色,颜色逐渐加深,D正确。
2.下列试剂的保存方法正确的是( )
A.氢氟酸保存在棕色细口玻璃瓶中B.氯水密封于无色试剂瓶中C.液溴易挥发,保存在带有橡胶塞的棕色试剂瓶中,并应加水液封D.碘单质保存在带有玻璃塞的棕色广口玻璃瓶中解析 A项,氢氟酸会腐蚀玻璃,所以保存时不能使用玻璃瓶,A不正确;B项,氯水见光易分解,应密封于棕色试剂瓶中,B不正确;C项,液溴会腐蚀橡胶,试剂瓶不能带有橡胶塞,C不正确;D项,碘单质会腐蚀橡胶,见光易升华,应避光保存,所以应保存在带有玻璃塞的棕色广口玻璃瓶中,D正确。
3.鉴别NaCl溶液、NaBr溶液、NaI溶液可以选用的试剂是( )
①碘水、淀粉溶液 ②氯水、CCl4 ③溴水、苯 ④硝酸、AgNO3溶液⑤氯水、苯 ⑥CCl4、淀粉溶液A.①②④B.②③⑥C.②④⑤ D.④⑤⑥
4.“吹出法”是工业上常用的一种海水提溴技术,该技术主要流程如下:
解析 由题给流程可知,足量氯气与海水中的溴离子发生置换反应生成溴,用热空气将生成的溴吹出,用二氧化硫的水溶液吸收吹出的溴,溴与二氧化硫水溶液反应生成硫酸和氢溴酸,向硫酸和氢溴酸中通入氯气,氯气与溶液中的氢溴酸发生置换反应生成溴,用合适的有机溶剂萃取溴水中的溴,分液得到溴的有机溶液,蒸馏有机溶液得到液溴。
5.某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正 确的是( )
A.E处棉花球变成黄色,说明Cl2的氧化性比Br2强B.F处棉花球变成蓝色,说明Br2的氧化性比I2强C.E处发生反应的离子方程式为Cl2+2Br-===2Cl-+Br2D.G装置中NaOH溶液与Cl2反应的离子方程式为2OH-+Cl2===ClO-+Cl-+H2O
解析 在F处,可能是未反应完的Cl2与KI发生反应置换出I2,使淀粉变蓝色,不能说明Br2的氧化性比I2强。
6.为了从海带浸取液中提取碘,某同学设计了如图实验方案,下列说法正确的 是( )
A.①中反应的离子方程式:2I-+H2O2===I2+2OH-B.②中分液时含I2的CCl4溶液从分液漏斗上口倒出C.③中得到的上层溶液中含有I-D.操作Z的名称是加热
7.某小组比较Cl-、Br-、I- 的还原性,实验如下:
A.实验1中,白烟是NH4ClB.根据实验1和实验2判断还原性:Br->Cl-C.根据实验3判断还原性:I->Br-D.上述实验利用了浓H2SO4的氧化性、难挥发性等性质解析 实验1,试管口挥发出的氯化氢气体与浓氨水挥发出的氨气反应生成白烟氯化铵,故A合理;实验1溶液颜色无明显变化说明浓硫酸不能氧化氯离子,实验2溶液变黄说明浓硫酸能氧化溴离子,所以判断还原性:Br->Cl-,故B合理;②中溶液含有浓硫酸和溴单质,加入碘化钠生成碘单质,可能是浓硫酸把碘离子氧化为碘单质,不能得出还原性:I->Br-,故C不合理;实验1体现浓硫酸的难挥发性,实验2体现浓硫酸的氧化性,故D合理。
9.(2024·深圳中学模拟)溴和碘的提取方法有多种,试解决下列问题。
Ⅰ.全球海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴的含量为65 mg/L。空气吹出法是目前海水提溴的最主要方法之一。其工艺流程如下:
(1)写出步骤③的离子方程式: _______________________________________。(2)步骤⑤的蒸馏过程中,温度应控制在80~90 ℃,温度过高或过低都不利于生产。实验室里蒸馏所用的盛装混合物的仪器名称为________,为控制温度,最好采用的加热方式为________;溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离,分离仪器的名称是_________________。(3)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过________(填试剂名称)溶液,以除去氯气。
(4)步骤①中用硫酸酸化可提高Cl2的利用率,理由是____________________。(5)提取溴单质,采用蒸馏“溴水混合物Ⅱ”而不是蒸馏“溴水混合物Ⅰ”,请说明原因:____________________________________________________。
(1)比较卤素单质的氧化性强弱,各仪器的正确连接顺序(填各接口的字母符号)g接________,________接________,________接________。(2)装置④烧瓶中反应的化学方程式为_____________________________。(3)装置①中的现象是________,装置②中的现象是________,装置③的作用是________________________________________。(4)装置②中反应的离子方程式为__________________________________。(5)若将反应后的②中的溶液滴入KI溶液中,产生的现象是____________________。(6)向反应后的①中加入足量的NaOH溶液,产生的现象是________,反应的化学方程式是_____________________________________________________。
13.(2024·百师联盟一轮复习联考)碘(微溶于水,77 ℃开始升华,溶于KI溶液后呈棕黄色)及其化合物广泛用于医药、染料等方面。请回答下列问题: (1)碘元素从海洋到餐桌上的转化流程如图所示:
②工业上以精碘和氯酸钾为原料生产KIO3。已知氧化产物为KIO3·HIO3同时生成的两种还原产物得到的电子数相同,且还原产物为黄绿色气体和无氧酸盐,则“转化”过程反应的化学方程式为___________________________。
2025届高考化学一轮总复习第5章非金属及其化合物第19讲卤族元素氯溴碘的提取课件: 这是一份2025届高考化学一轮总复习第5章非金属及其化合物第19讲卤族元素氯溴碘的提取课件,共33页。PPT课件主要包含了深红棕,HX+HXO,Br-,Cl2,NaOH,苯或四氯化碳等内容,欢迎下载使用。
大单元二 第五章 第十八讲 卤族元素 溴、碘单质的提取-备战2025年高考化学大一轮复习课件(人教版): 这是一份大单元二 第五章 第十八讲 卤族元素 溴、碘单质的提取-备战2025年高考化学大一轮复习课件(人教版),文件包含大单元二第五章第18讲卤族元素溴碘单质的提取pptx、大单元二第五章第18讲卤族元素溴碘单质的提取教师版docx、大单元二第五章第18讲卤族元素溴碘单质的提取学生版docx等3份课件配套教学资源,其中PPT共56页, 欢迎下载使用。
备战2025届新高考化学一轮总复习第4章非金属及其化合物第16讲卤族元素溴碘的提取课件: 这是一份备战2025届新高考化学一轮总复习第4章非金属及其化合物第16讲卤族元素溴碘的提取课件,共44页。PPT课件主要包含了课标指引,考点一卤族元素,目录索引,素养发展进阶,必备知识•梳理,ns2np5,Br-,关键能力•提升,Cl2,NaOH等内容,欢迎下载使用。












