





备战2025届新高考化学一轮总复习第4章非金属及其化合物第16讲卤族元素溴碘的提取课件
展开1.以卤族元素为例,了解同主族元素性质的递变规律。2.以海水等的开发利用为例,了解依据物质性质及其变化综合利用资源的方法。
考点二 从海水中提取卤素单质
1.卤族元素卤族元素又称卤素,位于元素周期表的第________族,包括氟(F)、氯(Cl)、溴(Br)、碘(I)等,其基态原子的价电子排布均为________。 2.溴、碘单质的物理性质比较
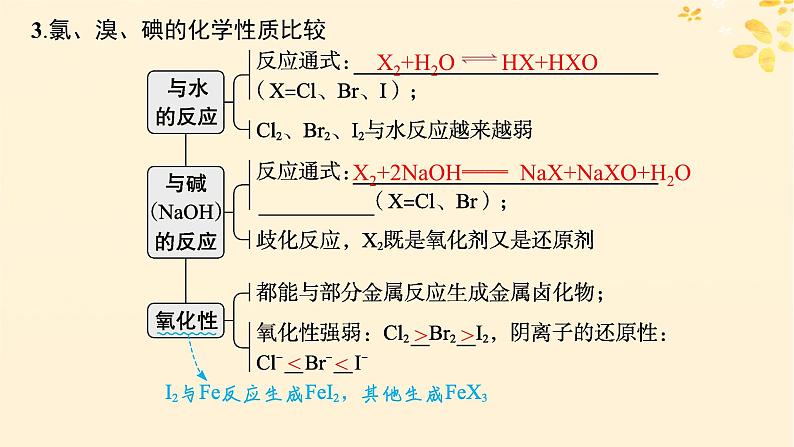
3.氯、溴、碘的化学性质比较
X2+2NaOH══ NaX+NaXO+H2O
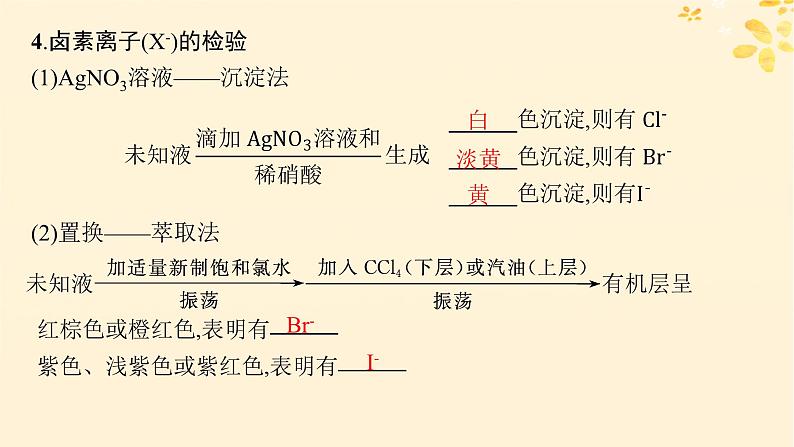
4.卤素离子(X-)的检验(1)AgNO3溶液——沉淀法
(2)置换——萃取法
(3)氧化——淀粉法检验I-
情境思考实验室有三瓶失去标签的无色溶液,分别盛有NaCl溶液、NaBr溶液和KI溶液,请设计两种不同的实验方案进行区分。
方案1:分别取少量三种溶液于三支试管中,并分别滴加AgNO3溶液,产生白色沉淀的是NaCl溶液,产生淡黄色沉淀的是NaBr溶液,产生黄色沉淀的是KI溶液。方案2:分别取少量三种溶液于三支试管中,分别滴加氯水再滴加CCl4,并振荡试管,液体出现分层现象,下层呈橙红色的是NaBr,下层呈紫红色的是KI。
考向1 卤素单质的性质及变化例1某同学进行如下实验:
下列分析不正确的是( )A.Ⅰ中CCl4层显橙色,说明CCl4层含Br2B.Ⅱ中的现象说明I2在CCl4中的溶解度大于在水中的溶解度C.Ⅲ中CCl4层显紫色,说明Cl2的氧化性强于I2D.Ⅲ中CCl4层变为橙色时,水层中仍含有大量I-
[对点训练1] (2023·广东广州期末)某化学小组探究卤族元素的性质,进行如图所示的实验(a~d中均为浸有相应溶液的棉花,夹持装置略)。下列说法正确的是( )
A.具支试管中发生反应的化学方程式为NaClO+2HCl(浓)═NaCl+Cl2↑+H2OB.若a处变为橙色,b处变为蓝色,说明氧化性:氯气>溴>碘C.若c处褪色,说明KMnO4有还原性D.若d处褪色,说明Cl2具有漂白性
解析 具支试管产生的氯气在a处与KBr发生置换反应生成Br2,溶液变橙色,可得氧化性:Cl2>Br2,b处氯气和KI反应生成I2,淀粉遇碘单质变蓝,可得氧化性:Cl2>I2,但I2与Br2的氧化性强弱未知,无法得到氧化性:氯气>溴>碘,B错误;浓盐酸具有挥发性,HCl气体也能与酸性KMnO4溶液发生氧化还原反应使溶液褪色,说明KMnO4有氧化性,C错误;氯气和NaOH溶液反应生成NaCl和NaClO,溶液碱性变弱,酚酞褪色,不是氯气的漂白性造成的,D错误。
考向2 拟卤素和卤素互化物例2拟卤素[如(CN)2、(SCN)2等]、卤素互化物(如IBr、IF5等)的化学性质与卤素单质(X2)相似,能与大多数金属、某些非金属单质、水等发生反应。已知(SCN)2的氧化性介于Br2和I2之间,下列说法中不正确的是( )A.(CN)2与NaOH溶液反应生成NaCN、NaCNO和H2OB.等浓度NaBr和NaI的混合液中加入少量(CN)2,发生反应:2I-+(CN)2═I2+2CN-C.BrCl与水生成HBrO和HCl,则1 ml BrCl反应时转移1 ml电子D.IBr与Zn反应生成ZnBr2和ZnI2
解析 类似于Cl2与NaOH溶液反应,(CN)2与NaOH溶液反应生成NaCN、NaCNO和H2O,A正确;(SCN)2的氧化性介于Br2和I2之间,由于还原性:I->Br-,故等浓度NaBr和NaI的混合液中加入少量(CN)2,只氧化I-生成I2,B正确; BrCl与水生成HBrO和HCl,该反应是非氧化还原反应,不存在电子转移,C错误;IBr的化学性质类似于Cl2,与金属Zn反应生成ZnBr2和ZnI2,D正确。
[对点训练2] 卤素间形成的化合物如“IF5、BrCl、IBr”等称为卤素互化物,化学性质与卤素单质类似,则下列关于卤素互化物的性质的描述及发生的相关反应正确的是( )A.IF5和卤素单质分子都是非极性分子B.IBr与Fe发生反应:3IBr+2Fe═FeI3+FeBr3C.1 ml BrCl与足量FeBr2溶液完全反应时转移的电子的物质的量为1 mlD.IBr与NaOH溶液发生的反应不是氧化还原反应
解析 IF5的分子结构不对称,是极性分子,A错误;由于氧化性:Fe3+>I2,IBr与Fe反应生成FeI2,B错误;BrCl与足量FeBr2反应相当于溴单质与FeBr2反应生成三价铁离子,电子转移情况为BrCl~2e-,故1 ml BrCl与足量FeBr2溶液完全反应时转移的电子的物质的量为2 ml,C错误;IBr中溴显-1价、碘显+1价,IBr与NaOH溶液生成NaIO和NaBr,不是氧化还原反应,D正确。
1.海水提取氯——氯碱工业
电解过程反应的化学方程式为________________________________。
2.海水提取溴(1)工艺流程
(2)主要过程及反应
Cl2+2Br-══ Br2+2Cl-
2HBr+Cl2 ══ 2HCl+Br2
3.海带提取碘(1)实验流程
(2)通入适量Cl2时,发生反应的离子方程式: _______________________。
Cl2+2I-══ I2+2Cl-
考向1 从海水中提取溴的工艺流程及分析例1(2023·广东茂名二模)浩瀚的海洋中蕴藏着丰富的资源,其中海水提溴工艺如图所示,下列说法中不正确的是( )
A.吹出塔中采用热空气有利于溴的吹出B.吸收塔中SO2被氧化C.吸收时可用Fe2(SO4)3溶液代替SO2和水D.蒸馏塔中发生置换反应
解析 利用氯气的氧化性强于溴单质,向海水中通入氯气和酸,发生反应Cl2+2Br-═2Cl-+Br2,液溴易挥发,通入热空气,吹出溴单质,溴的氧化性强于SO2,吸收塔中发生反应Br2+SO2+2H2O═2HBr+H2SO4,将HBr蒸出,蒸馏塔中发生反应Cl2+2HBr═2HCl+Br2,蒸出溴蒸气,然后冷凝,得到液溴。海水中通入氯气和酸,发生反应Cl2+2Br-═2Cl-+Br2,因为液溴易挥发,采用热空气吹出溴单质,A正确;吸收塔中发生反应Br2+SO2+2H2O═2HBr+H2SO4,硫元素化合价升高,SO2被氧化,B正确;根据B项分析,SO2被氧化,二氧化硫作还原剂,Fe2(SO4)3中Fe3+具有强氧化性,不与溴单质反应,因此Fe2(SO4)3不能代替SO2,C错误;蒸馏塔中发生反应Cl2+2HBr═2HCl+Br2,该反应为置换反应,D正确。
[对点训练1] 实验室探究从海水中提取溴的主要过程如图所示,下列装置或操作在实验中未涉及的是( )
解析 将海水中的溴离子氧化需要通入氯气,图中装置是制备氯气的装置,故A不符合题意;将海水蒸发浓缩析出粗盐用到蒸发装置,故B不符合题意;用有机溶剂萃取溴水中的溴用到萃取和分液,故C不符合题意;图中装置是灼烧固体的装置,海水提溴过程中用不到该装置,故D符合题意。
考向2 从海带中提取碘的实验流程及分析例2海带中含有丰富的碘元素,某化学兴趣小组设计的海带提碘实验流程如下图,下列说法中正确的是( )
解析 题给流程中灼烧用到坩埚,萃取分液用到分液漏斗,蒸馏用到直形冷凝管和蒸馏烧瓶,过滤用到漏斗,A正确;氧化过程将碘离子变成碘单质,可选用的氧化剂为O2、H2O2,选Br2会引入杂质,B错误;该过程中海带灼烧、氧化过程中碘离子氧化成碘单质、反萃取过程中碘单质与氢氧化钠溶液反应、酸化分离过程中生成碘单质,共4个氧化还原反应,涉及过滤、分液、蒸馏三种分离操作,C错误;反萃取时反应的离子方程式为I2+2OH-═I-+IO-+H2O,D错误。
[对点训练2] 下列有关从海带中提取碘的实验原理和装置能达到实验目的的是( )
A.用装置甲灼烧碎海带B.用装置乙过滤海带灰的浸泡液C.用装置丙制备用于氧化浸泡液中I-的Cl2D.用装置丁吸收氧化浸泡液中I-后的Cl2尾气
解析 灼烧碎海带应在坩埚中进行,不能用烧杯,装置甲不能达到实验目的, A错误;用装置乙过滤海带灰的浸泡液能达到实验目的,B正确;用浓盐酸和MnO2制取氯气需要加热,装置丙不能达到实验目的,C错误;吸收Cl2应用NaOH溶液,装置丁不能达到实验目的,D错误。
进阶1 练易错·避陷阱1.根据卤族元素的性质和规律,下列有关说法不正确的是( )A.从HF、HCl、HBr、HI酸性递增的事实,可推出F、Cl、Br、I的非金属性递增的规律B.HF、HCl、HBr、HI的热稳定性依次减弱,还原性依次增强C.淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O═2I2+4OH-D.碘在碘化钾溶液中的溶解度大于在纯水中的溶解度
2.下列制取Cl2、用Cl2氧化含I-废液、回收并提纯I2的装置能达到实验目的的是( )
解析 实验室利用MnO2与浓盐酸在加热条件下反应制取Cl2,不能用稀盐酸,A错误;Cl2通入含I-废液中氧化I-生成I2,通入Cl2的导管应长进短出,B错误;过滤时漏斗下端管口应紧靠烧杯内壁,C错误;I2易升华,故常采用升华法提纯碘,D正确。
进阶2 练热点·提素能3.某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )
A.E处棉花球变成黄色,说明Cl2的氧化性比Br2强B.F处棉花球变成蓝色,说明Br2的氧化性比I2强C.E处发生反应的离子方程式为Cl2+2Br-═2Cl-+Br2D.G装置中NaOH溶液与Cl2反应的离子方程式为2OH-+Cl2═ClO-+Cl-+H2O
解析 E处发生反应Cl2+2Br-═2Cl-+Br2,则E处棉花球变成黄色,说明Cl2的氧化性比Br2强,A、C正确;F处可能发生反应Cl2+2I-═2Cl-+I2,也可能发生反应Br2+2I-═2Br-+I2,F处棉花球变蓝色只能说明有碘单质生成,由于氯气的干扰,所以不能说明Br2的氧化性比I2强,B错误;G为尾气处理装置,装置中NaOH溶液与Cl2反应的离子方程式为2OH-+Cl2═ClO-+Cl-+H2O,D正确。
(3)ClO2是现今最常用的自来水消毒剂,可利用反应5KClO3+6HCl═5KCl+6ClO2↑+3H2O制备,该反应中氧化剂与还原剂的物质的量之比为________,每生成1 ml ClO2转移的电子数为________(设NA为阿伏加德罗常数的值)。 (4)①氟气具有极强的氧化性,可与所有金属反应,但在室温下与铁、铜等块状金属反应却并不明显,可能的原因是____________________________________________________________。 ②-40 ℃时,F2与冰反应生成HFO和HF,HFO的电子式是________,请写出HFO与水发生反应生成两种化合物的化学方程式___________________。
金属表面形成一层保护性的金属氟化物薄膜,阻止进一步反应
HFO+H2O══ HF+H2O2
5.溴及其化合物在生产中有广泛应用。工业上常用“吹出法”从海水中提溴,工艺流程示意图如下。
下列说法不正确的是( )A.“吹出法”主要包括氧化、吹出、吸收、蒸馏和冷凝等环节B.海水中Br-经氧化、吹出、吸收后,可实现溴的富集C.“吸收塔”内反应的化学方程式:SO2+Br2+2H2O═H2SO4+2HBrD.“吸收塔”内也可用Na2CO3溶液吸收吹出的Br2:Br2+2Na2CO3+H2O═NaBr+NaBrO3+2NaHCO3
解析 由图可知,向浓缩、酸化后的海水中通入氯气,氯气与海水中的溴离子发生置换反应生成溴,用空气和水蒸气将溴从“吹出塔”中吹出,向“吸收塔”中通入二氧化硫气体,二氧化硫与溴水反应生成硫酸和氢溴酸,向“蒸馏塔”中通入氯气,氯气与氢溴酸发生置换反应生成溴,蒸馏出的溴经冷凝、精馏得到产品。“吹出法”主要包括氧化、吹出、吸收、蒸馏和冷凝等环节,A正确;海水中Br-经氧化、吹出、吸收后,可实现溴的富集,B正确;“吸收塔”中发生反应的化学方程式为SO2+Br2+2H2O═H2SO4+2HBr,C正确;若“吸收塔”内用Na2CO3溶液吸收吹出的Br2,因生成的HBr的酸性强于碳酸,会产生CO2,D错误。
6.从海带中提取碘单质,成熟的工艺流程如下。下列关于海带提碘的说法不正确的是( )
A.实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌B.在含I-的滤液中加入稀硫酸和H2O2后,碘元素发生氧化反应C.在碘水中加入几滴淀粉溶液,溶液变蓝色D.在碘水中加入CCl4得到I2的CCl4溶液,该操作为“萃取”
解析 灼烧干海带应在坩埚中进行,而不应在蒸发皿中灼烧,A错误;在含I-的滤液中加入稀硫酸和H2O2,发生反应:2I-+H2O2+2H+═I2+2H2O,I元素被氧化,B正确;淀粉溶液遇单质I2变蓝色,是其特征反应,C正确;CCl4可萃取碘水中的碘单质,D正确。
新高考化学一轮复习课件第5章 第21讲 卤族元素 溴、碘单质的提取(含解析): 这是一份新高考化学一轮复习课件第5章 第21讲 卤族元素 溴、碘单质的提取(含解析),共60页。PPT课件主要包含了应用举例,真题演练明确考向,课时精练等内容,欢迎下载使用。
(人教版)高考化学一轮复习讲义课件第5章第18讲 卤族元素 溴、碘单质的提取(含解析): 这是一份(人教版)高考化学一轮复习讲义课件第5章第18讲 卤族元素 溴、碘单质的提取(含解析),共55页。PPT课件主要包含了练真题明考向,课时精练等内容,欢迎下载使用。
第11讲 卤族元素 溴、碘单质的提取 课件—2025届高考化学大一轮复习: 这是一份第11讲 卤族元素 溴、碘单质的提取 课件—2025届高考化学大一轮复习,共53页。PPT课件主要包含了必备知识·强基固本,关键能力·核心突破,素养评价·真题演练,知识梳理,自主评价,考向1海水提溴,考向2海带提碘等内容,欢迎下载使用。













