




2024河北化学中考备考重难专题:金属与盐溶液反应后滤液滤渣成分分析 (课件)
展开一、课件设计初衷 基于老师在总复习过程中对重难题型有较大的需求,难易结合化学学科的重难点,为此设计重难专题复习课件,助力高效课堂二、课件亮点1.对专题知识体系的构建侧重专题知识体系分解再构建,根据本区域近五年的中考真题提炼知识点,通过知识点讲授方法和技巧,并进一步形成对应体系,再让学生尝试应用已有体系中的方法与技巧去解决问题,在复习过程中构建自己的重难专题知识体系。会对难题进行分解,降低梯度,准确、高效攻克重难专题。2.过程性分析设置分步动画对方法讲解、解题步骤设置分步动画,按步骤播放,更清晰有条理。三、课件使用场景适用于中考二轮专题复习
一、优先反应原则“远距离置换原则”:在金属活动性顺序中两种金属距离越远越先反应。(1)一种金属和多种盐的混合溶液反应,金属先和最不活泼的金属的盐溶液反应;(2)多种金属与一种盐溶液反应,最活泼的金属先和盐溶液反应。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
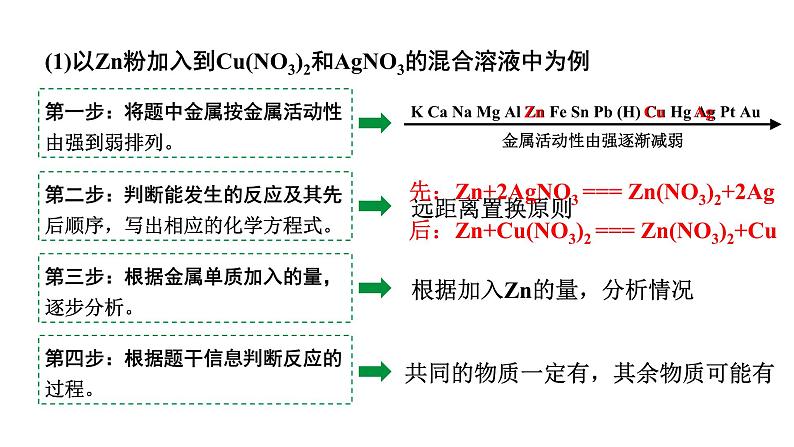
(1)以Zn粉加入到Cu(NO3)2和AgNO3的混合溶液中为例
第一步:将题中金属按金属活动性由强到弱排列。
第二步:判断能发生的反应及其先后顺序,写出相应的化学方程式。
第三步:根据金属单质加入的量,逐步分析。
第四步:根据题干信息判断反应的过程。
根据加入Zn的量,分析情况
共同的物质一定有,其余物质可能有
先:Zn+2AgNO3 === Zn(NO3)2+2Ag后:Zn+Cu(NO3)2 === Zn(NO3)2+Cu
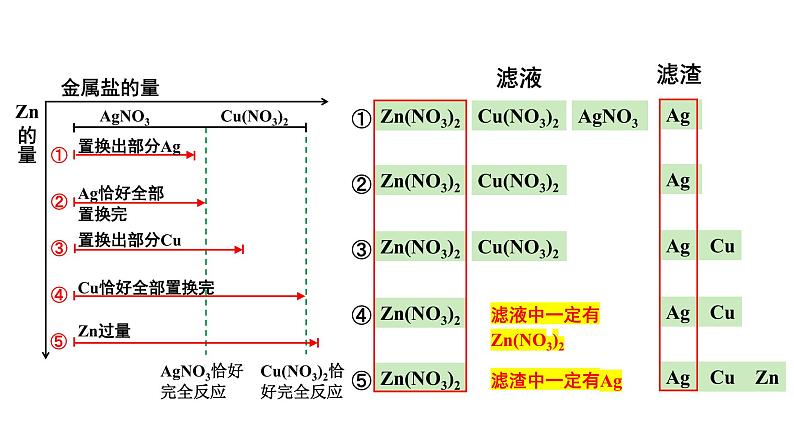
AgNO3恰好完全反应
Cu(NO3)2恰好完全反应
Ag Cu
Ag Cu Zn
滤液中一定有Zn(NO3)2
以Zn粉加入到Cu(NO3)2和AgNO3的混合溶液中为例
先:Zn+2AgNO3 === Zn(NO3)2+2Ag 后:Zn+Cu(NO3)2 === Zn(NO3)2+Cu
Zn与AgNO3反应使固体质量增大,溶液质量减小Zn与Cu(NO3)2反应使固体质量减小,溶液质量增大
65 216 65 64
溶液质量可能相等吗?固体质量呢?
当溶液增大的质量等于溶液减小的质量时,溶液质量相等当固体增大的质量等于固体减小的质量时,固体质量相等
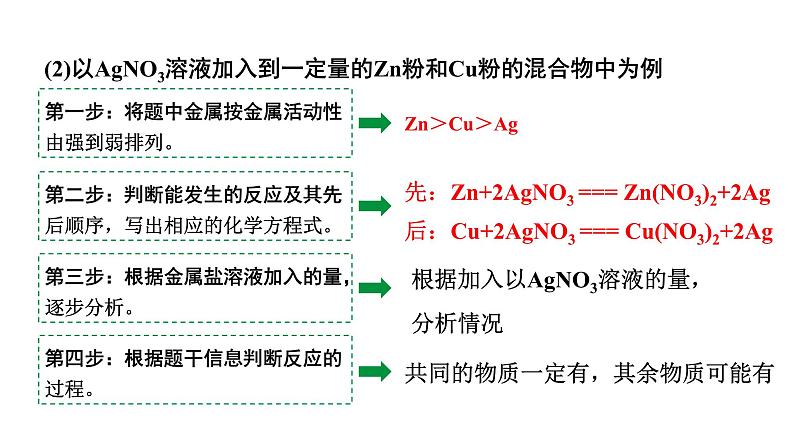
(2)以AgNO3溶液加入到一定量的Zn粉和Cu粉的混合物中为例
第三步:根据金属盐溶液加入的量,逐步分析。
根据加入以AgNO3溶液的量,分析情况
先:Zn+2AgNO3 === Zn(NO3)2+2Ag后:Cu+2AgNO3 === Cu(NO3)2+2Ag
Ag Cu
Ag Cu Zn
在牙膏内部,金属元素存在于溶液中,以离子形式存在,也就是在滤液中。
处于牙膏管口处的,既有以单质形式存在于滤渣中的,也有以离子形式存在于滤液中的。
一旦被挤出牙膏外面,就以单质形式存在,也就是说在滤渣中。
第三步:根据挤出金属的量,逐步分析。
第四步:根据题干信息判断反应后滤液、滤渣的成分。
想象把 Zn一点一点加入Cu(NO3)2和AgNO3的混合溶液中,置换出金属的顺序应该是先Ag后Cu
Zn>Cu>Ag 将最不活泼的金属排在靠近牙膏管口处
金属Zn应该从牙膏底部进入,推动膏体从管口出来。
1.向硝酸银和硝酸铜的混合溶液中加入一定量的锌粉充分反应后过滤,得到滤渣和滤液,再向滤渣中加入稀盐酸,有气泡产生,下列说法正确的是 ( )A.滤液可能呈蓝色B.向滤液中加入稀盐酸无明显现象C.滤渣中只有 Ag、CuD.滤液中的阳离子有 Ag+、Cu2+、Zn2+
硝酸银和硝酸铜反应完全,锌粉过量
Ag Cu Zn
A. 滤渣中一定含有Ag和Cu,滤液中一定含有Zn(NO3)2B. 滤渣中一定不含Zn,滤液中一定含有Zn(NO3)2和Cu(NO3)2C. 滤渣中一定含有Ag,滤液中可能含有Cu(NO3)2和AgNO3D. 滤渣中一定含有Ag和Cu,滤液中可能含有Cu(NO3)2和AgNO3
发生化学反应的先后顺序:
根据金属加入的量,逐步分析
分析得滤渣中没有Zn,排除⑤,其他四种情况都有可能
滤渣中一定含有Ag,可能有Cu
溶液中一定含有Zn(NO3)2,可能有Cu(NO3)2
1.(2023河北改编) 将一定量的铁粉加入到含有Cu(NO3)2和AgNO3的废液中,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。下列判断正确的是( )A. 滤渣中一定含有Ag和Cu,滤液中一定含有Fe(NO3)2B. 滤渣的质量先减小后增加C. 溶液的质量先增加后减小D. 滤渣中一定含有Ag,滤液中可能含有Cu(NO3)2和AgNO3
Ag Cu Fe
滤渣中没有Fe,⑤排除
先:Fe+2AgNO3 === Fe(NO3)2+2Ag 后:Fe+Cu(NO3)2 === Fe(NO3)2+Cu
Fe与AgNO3反应后固体质量增大,溶液质量减小Fe与Cu(NO3)2反应后固体质量增大,溶液质量减小
56 216 56 64
反应结束后,加入Fe粉,固体质量继续增加,溶液的质量不变
1.(2022河北改编) 将一定量的铁粉加入到含有Cu(NO3)2和AgNO3的废液中,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。下列判断正确的是( )A. 滤渣中一定含有Ag和Cu,滤液中一定含有Fe(NO3)2B. 滤渣的质量先减小后增加C. 溶液的质量先增加后减小D. 滤渣中一定含有Ag,滤液中可能含有Cu(NO3)2和AgNO3
溶液的质量持续减小,固体的质量持续增大
2.某化工厂排放的废液中只含有 ZnCl2和CuCl2两种溶质,为回收金属 Cu 并得到 ZnCl2固体,化学小组的同学们设计并进行了如下实验:对于该实验所做的分析不合理的是( )A.加入的过量的 A 物质应该是 ZnB.上述实验中的操作①②③都应该是过滤C.滤渣 B应该是 Zn和Cu的混合物D.滤液I和滤液II中所含的溶质有所不同
滤液I、II中有ZnCl2
Cu Zn
分离固体和液体溶液中的溶质转化为固体
中考化学复习重难突破8金属与盐溶液反应后滤液、滤渣成分的判断课件: 这是一份中考化学复习重难突破8金属与盐溶液反应后滤液、滤渣成分的判断课件,共18页。PPT课件主要包含了FeCuAg,FeNO32,CuFe,ZnCuAg,ZnNO32等内容,欢迎下载使用。
鲁教版中考化学复习第九单元金属重难突破14金属与盐溶液反应后滤液、滤渣成分的判断课件: 这是一份鲁教版中考化学复习第九单元金属重难突破14金属与盐溶液反应后滤液、滤渣成分的判断课件,共18页。PPT课件主要包含了FeCuAg,FeNO32,CuFe,ZnCuAg,ZnNO32等内容,欢迎下载使用。
中考化学复习重难突破8金属与盐溶液反应后滤液、滤渣成分的判断练习课件: 这是一份中考化学复习重难突破8金属与盐溶液反应后滤液、滤渣成分的判断练习课件,共12页。












