

2024杭州联谊学校(“桐・浦・富・兴”教研联盟)高二下学期5月月考化学试题含答案
展开高二年级化学学科 试题
考生须知:
1.本卷共10页满分100分,考试时间90分钟。
2.答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相应数字。
3.所有答案必须写在答题纸上,写在试卷上无效。
4.考试结束后,只需上交答题纸。
5.可能用到的相对原子质量:H 1 B 11 C 12 O 16 Na 23 P 31 Cl 35.5 Fe 56 Ag 108
选择题部分
一、单项选择题(本题共16小题,每小题3分,共48分)
1.下列化学用语只能用来表示一种微粒的是( )
A.化学式:B.球棍模型:
C.化学名称:二氯甲烷D.核外电子排布图:
2.乌金纸是浙江省特有的传统手工艺品。据《天工开物》记载:“用东海巨竹膜为质,豆油点灯,闭塞周围,只留针孔通气,熏染烟光而成此纸。每纸一张打金箔五十度,然后弃去,为药铺包朱(砂)用,尚未破损,盖人巧造成异物也。”下列说法正确的是( )
A.东海巨竹膜、豆油的主要成分都属于天然高分子化合物
B.乌金纸色泽的形成与豆油的不完全燃烧有关
C.打金成箔,说明乌金纸具有良好的延展性
D.乌金纸有良好的耐冲击性能的主要原因是金属钨的硬度大
3.水是自然界中优良的无机溶剂,常温下水的自偶电离可表示为:,下列说法正确的是( )
A.水分子的VSEPR模型为V形B.1ml液态水中存在2ml氢键
C.中O原子杂化方式为D.中键角比中小
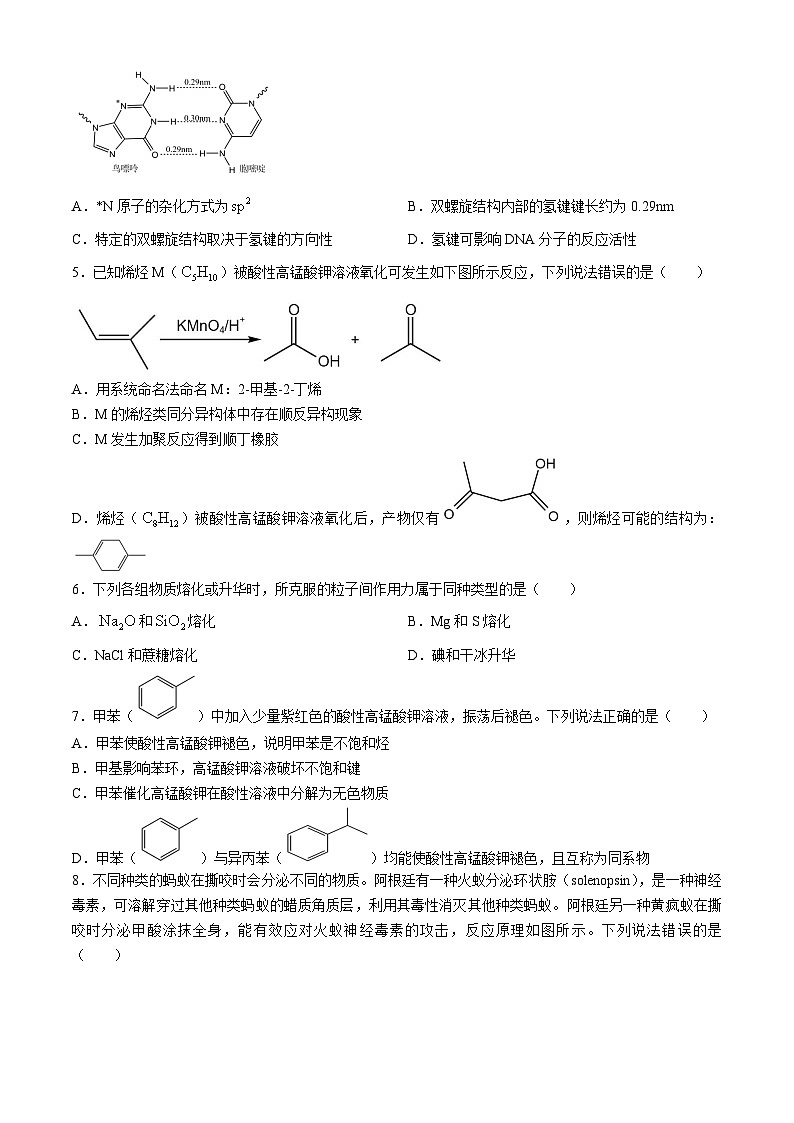
4.DNA双螺旋的两个螺旋链通过氢键相互结合,氢键位于双螺旋结构的内部,主要作用是维持两条互补链的稳定配对,对生命物质的高级结构和生物活性具有重要的意义。部分结构如图所示。下列说法错误的是( )
A.*N原子的杂化方式为B.双螺旋结构内部的氢键键长约为0.29nm
C.特定的双螺旋结构取决于氢键的方向性D.氢键可影响DNA分子的反应活性
5.已知烯烃M()被酸性高锰酸钾溶液氧化可发生如下图所示反应,下列说法错误的是( )
A.用系统命名法命名M:2-甲基-2-丁烯
B.M的烯烃类同分异构体中存在顺反异构现象
C.M发生加聚反应得到顺丁橡胶
D.烯烃()被酸性高锰酸钾溶液氧化后,产物仅有,则烯烃可能的结构为:
6.下列各组物质熔化或升华时,所克服的粒子间作用力属于同种类型的是( )
A.和熔化B.Mg和S熔化
C.NaCl和蔗糖熔化D.碘和干冰升华
7.甲苯()中加入少量紫红色的酸性高锰酸钾溶液,振荡后褪色。下列说法正确的是( )
A.甲苯使酸性高锰酸钾褪色,说明甲苯是不饱和烃
B.甲基影响苯环,高锰酸钾溶液破坏不饱和键
C.甲苯催化高锰酸钾在酸性溶液中分解为无色物质
D.甲苯()与异丙苯()均能使酸性高锰酸钾褪色,且互称为同系物
8.不同种类的蚂蚁在撕咬时会分泌不同的物质。阿根廷有一种火蚁分泌环状胺(slenpsin),是一种神经毒素,可溶解穿过其他种类蚂蚁的蜡质角质层,利用其毒性消灭其他种类蚂蚁。阿根廷另一种黄疯蚁在撕咬时分泌甲酸涂抹全身,能有效应对火蚁神经毒素的攻击,反应原理如图所示。下列说法错误的是( )
A.甲酸和环状胺均能与溶剂水分子形成氢键,都具有良好的水溶性
B.环状胺和甲酸反应后的产物不能有效溶解蜡质角质层
C.环状胺分子中有2个手性碳原子
D.甲酸在环状胺中的电离程度要大于在水中的电离程度
9.Q、X、Y、Z是原子序数依次增大的短周期主族元素,其最外层电子数之和为18。Q与X、Y、Z位于不同周期,基态X原子核外电子所占据原子轨道全充满,Y与Q同族。下列说法错误的是( )
A.Q的简单氢化物是一种常见的制冷剂
B.X单质在空气中易形成氧化膜,阻止单质继续被氧化
C.基态Y原子核外电子有9种空间运动状态
D.Z单质是由单原子分子构成的分子晶体
10.金刚烷的碳架结构相当于是金刚石晶格网络中的一个晶胞,故取名金刚烷。其基本结构是椅式环己烷,它是一种高度对称和非常稳定的化合物。由化合物M合成金刚烷路线如下图所示。下列说法错误的是( )
A.化合物M到化合物N的过程发生了加成反应
B.化合物N的分子式为
C.金刚烷的二氯代物有5种
D.通过X射线衍射图进行化学计算可获得金刚烷键长、键角等分子结构信息
11.物质结构决定性质。下列性质差异与结构因素匹配错误的是( )
12.大环配体在生物医学领域有广泛应用。金属离子可将一组配体组装在一起,配体之间接着发生反应形成“大环配体”,大环配体是含有多个电子给予体原子的环状分子,合成环状分子的过程称之为模块效应。模块效应可以用来制备众多不同孔径的大环配体,若没有金属离子,产物将会是难以明确表示的混合物。大环配体形成原理如下图所示,下列说法错误的是( )
A.在反应中有控制成环大小的作用
B.上述反应的原子利用率为100%
C.模块效应主要发生了加成反应和消去反应
D.大环配体可根据金属离子的半径大小对金属离子进行有效分离
13.环己酮是重要的化工原料。实验室氧化环己醇制备环己酮的流程如图所示。已知环己醇沸点161℃,环己酮的沸点156℃。下列说法正确的是( )
A.环己醇反应过程中,浓的作用是氧化剂
B.NaCl(s)的作用是增强水溶液的极性,降低有机物在水中的溶解度,便于分层
C.98.3%的浓硫酸具有很强的吸水能力,可用于有机相的干燥
D.操作2直接蒸馏可得环己酮
14.向装有一定量蒸馏水的两支试管(标记为1号和2号)中分别加入少量碘单质,充分振荡,溶液呈浅棕色,底部均有少量紫黑色不溶物。继续向两支试管中加入少量,振荡试管、静置,上层溶液无色,下层出现紫红色;再依次向1号试管中加入少量细小锌粒,向2号试管中加入少量KI固体;一段时间后1号、2号试管中下层紫红色消失,1号试管中上层无色,2号试管中上层出现棕色。已知为棕色,下列关于颜色变化的解释错误的是( )
15.某种新型储氢材料的晶胞如图,八面体中心为M金属离子,顶点均为配体;四面体中心为硼原子,顶点均为氢原子。该晶体属于立方晶系,晶胞棱边夹角均为90°,棱长为a pm,下列说法错误的是( )
A.晶体中存在离子键、共价键、配位键等多种作用力
B.晶体类型为混合型晶体
C.八面体中心M金属离子的化合价为+2
D.金属离子M与B原子之间的最短距离为:
16.当1,3-丁二烯和溴单质1:1加成时,其反应机理及能量变化如下,不同反应条件下,经过相同时间测得生成物组成如下表。下列分析错误的是( )
A.产物A、B互为同分异构体,由中间体生成A、B的反应互相竞争
B.相同条件下由活性中间体C生成产物A的速率更快
C.实验1测定产物组成时,体系已达平衡状态
D.实验1在t min,若升高温度至25℃,部分产物A会经活性中间体C转化成产物B
非选择题部分
二、非选择题(本大题共5小题,共52分)
17.(10分)短周期元素X、Y、Z和M原子序数依次增大。X元素的单质是空气中体积分数最高的组分,Y原子核外有5种空间运动状态不同的电子且有1个单电子,基态Z的核外电子所占据原子轨道全充满,M与Z位于同一周期,M的第一电离能大于同周期相邻元素。R元素的+1价阳离子原子核外前三个能层均填满电子。回答下列问题:
(1)R元素位于元素周期表的______区,其简化的核外电子排布式是______。
(2)X、Y、M三种元素的电负性由大到小的顺序是______。(用元素符号表示)
(3)X、Y均可与Z化合,形成的化合物中化学键的离子性成分百分数大小关系是______。(用相应物质的化学式回答)
(4)Y与M形成的阴离子MY6-常用于合成离子液体,从结构角度解释原因______。
18.(10分)碳元素形成的物质种类繁多,回答下列问题。
(1)图1中甲醛分子的价层电子对互斥模型(VSEPR)是______。
(2)图2乙烯分子中键角的原因是______。
(3)图3中带正电荷的碳原子杂化方式是______。
(4)下列关于甲醛、乙烯、丙烯分子说法正确的是______。
A.甲醛分子中C、O之间的π键电子云轮廓图如图所示
B.乙烯分子中含有极性共价键和非极性共价键,分子为非极性分子
C.丙烯分子中键长:碳碳单键<碳碳双键,键能:碳碳单键<碳碳双键
D.图3中Ⅰ的稳定性大于Ⅱ
(5)甲醛、乙烯、丙烯分子在水中的溶解度最大的是______,主要原因是______。
19.(10分)实验室以2-丁醇()为原料制备2-氯丁烷(),实验装置如图所示(夹持、加热装置已略去):
相关信息如表所示:
[实验步骤]
步骤1:在甲装置中的圆底烧瓶内加入无水和50mL 12浓盐酸,充分溶解、冷却,再加入22.84mL 2-丁醇,加热一段时间。
步骤2:将反应混合物移至乙装置的蒸馏烧瓶内,蒸馏并收集115℃以下的馏分。
步骤3:从馏分中分离出有机相,进行系列操作,放置一段时间后过滤。
步骤4:滤液经进一步精制得产品。
回答下列问题:
(1)甲装置中制备2-氯丁烷的反应方程式为______。
Ⅰ中应连接的仪器是______(填“A”或“B”),选择该仪器的原因是______。
(2)下列说法正确的是( )
A.步骤1:无水可提高制取产品的效率
B.步骤2:蒸馏操作时可采用水浴加热以便于控制温度
C.步骤3:使用分液漏斗振荡混合物时需多次打开下端玻璃旋塞放气
D.步骤4:精制产品的方法可以是蒸馏,也可控制温度在-120℃将2-丁醇滤出
(3)步骤3进行系列操作的顺序是④→( )→④→( )(填序号)。
①10%溶液洗涤②10%NaOH溶液洗涤③加入固体
④蒸馏水洗涤⑤加入浓硫酸
(4)测定实验中生成2-氯丁烷的产率。将全部产品加入足量NaOH溶液中,加热,冷却后,加酸将
溶液酸化,再滴入足量的硝酸银溶液,将沉淀过滤、洗涤、干燥。
①将溶液酸化所需的酸是______。
②实验中得到28.70g沉淀,则2-氯丁烷的产率是______。
20.(10分)H、C、N、O、Cl等非金属元素是构成化合物的常见元素,Zn、Ni是重要的过渡金属。
回答下列问题:
(1)N、O、Cl以原子个数比1:1:1形成的分子,各原子最外层均满足8e
-结构,其电子式为______。
(2)已知,写出与物质的量之比2∶1反应的化学方程式______。
(3)化学式为的笼形包合物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞。
①晶胞中的配位原子是______,的配位数是______,______。
②若对该笼形包合物进行加热,首先脱离晶胞的组分是______,说明推测的依据______。
21.(12分)某治疗阿尔茨海默症的药物的中间体Ⅰ合成路线如下。
已知:①Bn为
②(为烃基,、为烃基或H)
(1)A中含氧官能团的名称是______。
(2)化合物B转化为C的反应方程式是______。
(3)化合物G的结构简式是______。
(4)下列说法正确的是______。
A.A转化为B时酯基对位的酚羟基活性比酯基间位酚羟基活性高
B.G转化为H过程中作氧化剂
C.E转化为G的过程经历了加成反应和消去反应
D.可用酸性溶液鉴别产物I中是否还含有杂质H
(5)写出符合下列条件F的同分异构体的结构简式______。
①分子中含有一个六元环
②核磁共振氢谱显示有3种不同化学环境的氢原子
(6)设计以和为原料,合成的路线(用流程图表示,无机
试剂任选)。
2024年5月“桐·浦·富·兴”教研联盟调研测试
高二年级化学学科试题答案
一、选择题(48分)
二、非选择题(52分)
17.(10分)(1)ds(2分) (2分) (2)F>N>P(2分)
(3)(2分) (4)
电荷数低,离子体积大,与阳离子间作用力弱。(2分)
18.(10分)(1)平面三角形(1分)
(2)碳碳双键电子云密度大,对碳氢键共用电子对的斥力大于碳氢单键之间的斥力。(2分)
(3)(2分) (4)BD(2分)
(5)甲醛(HCHO)(1分),HCHO可与水分子之间形成氢键。(2分,画出氢键也可)
19.(10分)(1)(2分) A(1分)
蒸汽与冷凝水接触面积大,冷凝效果好(1分)
(2)AC(2分) (3)①、③(1分)
(4)硝酸(1分,醋酸也可给分) 80%(2分)
20.(10分)(1)(2分) (2)(2分)
(3)①C(1分) 6(1分) 2∶1∶1(1分)
②(1分) 以分子间作用力结合,受热最易被破坏(2分)
21.(12分)(1)酯基、(酚)羟基(1分,少写或错写0分)
(2)(2分)
(3)(1分)
(4)AC(2分)
(5)
(写对2个1分,3个得2分,4个得3分)
(6)(3分)(其他合理答案也得分)
命题人:
夏昌伟 15103103160
邵传强 13968166771选项
性质差异
结构因素
A
沸点:正戊烷(36.1℃)高于新戊烷(9.5℃)
分子间作用力
B
熔点:(700℃)高于(316℃升华)
离子键成分的百分数
C
热稳定性:强于
氢键
D
酸性:强于
羟基极性
选项
颜色变化
解释
A
两试管溶液呈浅棕色
在水中溶解度较小
B
两试管上层浅棕色消失
萃取了上层溶液中的
C
1号试管中下层紫色消失
Zn与有色物质发生了反应
D
2号试管中上层出现棕色
上层溶液中被空气中氧气氧化为
编号
反应条件
反应时间
产物中A的物质的量分数
产物中B的物质的量分数
1
-15℃
t min
62%
38%
2
25℃
t min
12%
88%
物质
熔点/℃
沸点/℃
密度/()
其他
2-丁醇
-114.7
99.5
0.81
与水互溶
2-氯丁烷
-131.3
68.2
0.87
微溶于水
1
2
3
4
5
6
7
8
C
B
C
B
C
D
D
A
9
10
11
12
13
14
15
16
D
C
C
B
B
D
B
C
浙江省杭州市“桐浦富兴”教研联盟2023-2024学年高一下学期6月学考模拟考试化学试题(Word版附答案): 这是一份浙江省杭州市“桐浦富兴”教研联盟2023-2024学年高一下学期6月学考模拟考试化学试题(Word版附答案),文件包含浙江省杭州市“桐浦富兴”教研联盟2023-2024学年高一下学期6月学考模拟考试化学试题docx、浙江省杭州市“桐浦富兴”教研联盟2023-2024学年高一下学期6月学考模拟考试化学试题答案docx等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。
浙江省杭州市桐浦富兴稽阳联谊教研联盟2023-2024学年高二下学期5月月考化学试题(Word版附答案): 这是一份浙江省杭州市桐浦富兴稽阳联谊教研联盟2023-2024学年高二下学期5月月考化学试题(Word版附答案),共10页。试卷主要包含了考试结束后,只需上交答题纸,可能用到的相对原子质量,甲苯等内容,欢迎下载使用。
2020西南名校联盟・高三3+3+3高考备考诊断性联考卷(一)化学试题PDF版含答案: 这是一份2020西南名校联盟・高三3+3+3高考备考诊断性联考卷(一)化学试题PDF版含答案,共11页。












