





2024甘肃中考化学一轮复习之中考考点研究 第五单元 化学方程式(课件)
展开1. (真题组合)判断说法正误:A. 根据质量守恒定律,1 g氢气和9 g氧气反应一定生成10 g水。(省卷2021.8A)( )B. 守恒观———某物质含有碳、氢元素,完全燃烧后一定会生成二氧化碳和水。(兰州2020.18D)( )C. 守恒观———化学反应前后分子的种类不变。(兰州2023.11D)( )
质量守恒定律的理解与应用
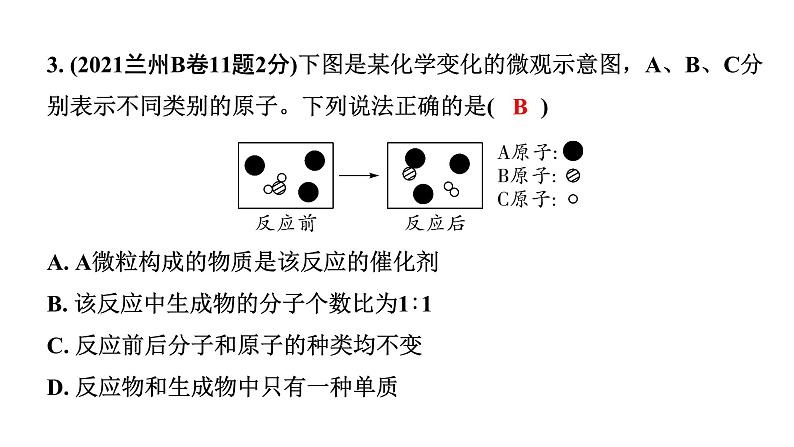
3. (2021兰州B卷11题2分)下图是某化学变化的微观示意图,A、B、C分别表示不同类别的原子。下列说法正确的是( )A. A微粒构成的物质是该反应的催化剂B. 该反应中生成物的分子个数比为1∶1C. 反应前后分子和原子的种类均不变D. 反应物和生成物中只有一种单质
4. (2020兰州24题2分)在密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,在不同时刻测得各物质的质量(单位为克)如表所示,下列说法不正确的是( )A. 该反应中,乙是反应物,丙是生成物B. b=13C. t2时刻,甲、丙物质质量比为5∶32D. 若丙、丁的相对分子质量分别是64、44,则丙、丁的化学计量数之比为1∶1
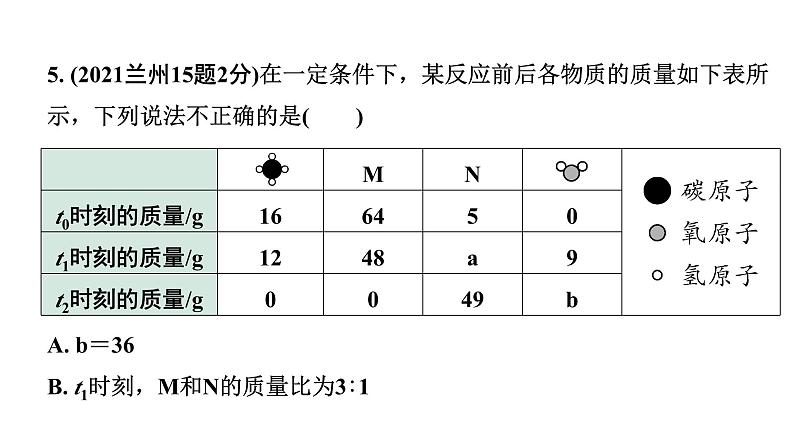
5. (2021兰州15题2分)在一定条件下,某反应前后各物质的质量如下表所示,下列说法不正确的是( )
A. b=36B. t1时刻,M和N的质量比为3∶1
6. [2020省卷13(3)题1分](3)救治:为救治病人,需要提供氧气。氧烛能持续放出高纯氧气,其主要成分发生如下反应:2NaClO3=== 2X+3O2↑,X的化学式为______。①该反应属于基本反应类型中的_________。②NaClO3属于_______(填“化合物”或“氧化物”),其Cl的化合价为____。③推断反应中X的化学式的理论依据是___________________________________。
化学反应前后原子的种类和数目 均不变
9. (2021梧州)一定条件下,甲、乙、丙、丁四种物质在密闭容器中发生反应,测得反应前后各物质的质量如图所示,图中x、y分别表示乙和丙的质量。下列说法错误的是( )A. 反应后甲的质量分数是8%B. x的取值范围:0≤ x ≤40C. y ≤30时,生成物只有一种D. 参加反应的甲与丁的质量比为2∶1
10. (2023兰州21A)判断下列实验能否达到相应的实验目的( )
质量守恒定律的验证(兰州2023.21A)
(1)白磷燃烧的现象为___________________________,发生反应的化学方程式为____________________。(2)实验过程中,气球的作用:一是_________;二是起密封作用。
产生大量白烟,放出大量的热
(3)反应前称量的物质有______________(填序号,下同),反应后称量的物质有______________,反应前后质量不变的物质有_________。(假设白磷完全反应)①玻璃管 ②锥形瓶 ③细沙 ④白磷 ⑤锥形瓶内空气 ⑥气球 ⑦五氧化二磷(4)从微观角度分析,化学反应一定遵守质量守恒定律的原因是____________________________________。
反应前 后原子的种类、数目及质量不变
化学方程式的书写(甘肃5年5考,兰州5年5考)
12. [2021兰州16(2)题1分](2)工业上通常是在高温条件下,在氩气保护的环境中,用四氯化钛(TiCl4)与金属镁反应获得钛和氯化镁,该反应的化学方程式为_____________________________。
13. [2020兰州26(2)题3分]生活中的很多物质与化学密切相关。(2)兰州已进入“地铁时代”。地铁施工产生的废水可用活性炭处理,这是利用了活性炭的______性;地铁使用了大量材料,其中玻璃的制备原理之一是: 用石灰石和石英(SiO2)在高温下反应生成硅酸钙(CaSiO3)和一种温室气体,试写出该反应的化学方程式________________________________。
基本反应类型(省卷5年5考,兰州5年5考)
16. (2021兰州22题5分)向40.0 g BaCl2溶液中滴加一定溶质质量分数的Na2CO3溶液,实验过程中产生沉淀的质量与加入Na2CO3溶液的质量关系如下图所示:(1)生成沉淀的质量是_____g。(2)恰好完全反应时,所得溶液中溶质的质量分数是多少?(写出计算过程)
化学方程式的计算(省卷5年5考,兰州5年5考)
17. (2021省卷17题6分)我国化学家侯德榜创立了侯氏制碱法,为世界制碱工业作出了杰出贡献。在实际生产的产品碳酸钠中会混有少量的氯化钠。现有纯碱样品,为测定该样品中碳酸钠的质量分数,称取样品6 g,放入40 g水中使其完全溶解,再加入稀盐酸26.2 g,恰好完全反应,气体全部逸出,得到氯化钠的不饱和溶液70 g。请计算(写出简要的计算过程):(1)生成二氧化碳的质量。(2)样品中碳酸钠的质量。(3)反应后所得溶液中溶质的质量分数(计算结果精确到0.1%)。
解:(1)根据质量守恒定律可知,反应前后物质的总质量不变,反应前的质量为:6 g+40 g+26.2 g=72.2 g,反应后溶液的质量为70 g,则相差的质量就是生成气体的质量,即:72.2 g-70 g=2.2 g。
微观:原子的______、______、_____不变宏观:物质的_________、_________、元素质量不变
微观:___________一定改变宏观:___________一定改变
_________可能改变__________可能改变
应用(省卷5考,兰州5考)
a.确定化学反应中某物质的化学式(依据:化学反应前后各原子种类、数目 不变)b.确定反应中的化学计量数(依据:化学反应前后各原子的数目不变)c.推断物质的元素组成(依据:_________________________)d.解释反应前后物质的质量变化及用质量差确定某一物质的质量(依据: 化学反应前后,反应物和生成物的总质量不变)
质量守恒定律的验证(详见实验突破实验5)
化学反应前后元素种类不变
二、基本反应类型(省卷5考,兰州5考)
注意:a.复分解反应发生的条件是生成物中有_____或_____或____ b.复分解反应中的酸与碱作用生成盐和水的反应又称中和反应,但中和反应不是基 本反应类型
定义:用_______来表示__________的式子
“质”:表示反应物、生成物及反应条件
宏观:表示反应中各物质之间的质量比微观:表示反应中各种粒子之间的数目比
书写(省卷5考,兰州5考)
原则:以________为基础(如化学式、反应条件错误),遵循________定 律(如未配平)
注意:反应前无气体,反应后的气体生成物需标“↑”;溶液中 的反应如果反应前无固体,反应后的固体生成物需标“↓”
会写学过的化学方程式;会判断化学方程式的正误;根据信息写化学方程式;会推断未知物化学式;由微观反应示意图写化学方程式;
四、化学方程式简单计算(省卷5考,兰州5考)
计算依据:质量守恒定律答题模板(以求3.6 g H2O通电分解可以得到O2的质量为例):
判断下列说法的正误,正确的请在括号内打“√”,错误的请打“×”。1. 任何变化都遵守质量守恒定律。( )2. 化学反应前后分子的总数目一定相等。 ( )3. 某化合物在氧气中完全燃烧生成二氧化碳和水,则该化合物中一定含有碳、氢、氧三种元素。( )
4. 分解反应一定有单质生成。( )5. 置换反应中一定有元素化合价的改变。 ( )6. 置换反应有单质生成,但有单质生成的反应不一定是置换反应。( )7. 由两种化合物反应生成另外两种化合物的反应一定是复分解反应。 ( )
1. 验证质量守恒定律的条件和要求(1)必须发生化学反应。(2)反应现象明显(有利于判断反应的发生)。(3)有气体参加或生成的反应,应在密闭容器中进行。
空气中氧气含量的测定(兰州5年5考)
Fe+CuSO4 === FeSO4+Cu
Na2CO3+2HCl === 2NaCl+CO2↑+H2O
3. 实验反思(针对方案一)(1)锥形瓶中要铺一层细沙,其目的是__________________________________________。(2)气球的作用有:调节锥形瓶内压强,起缓冲作用;起______作用,防止实验时锥形瓶内外的物质发生交换。
防止红磷燃烧使锥形瓶底部受热 不均匀而炸裂
(3)实验中气球形状变化的原因:红磷燃烧放出热量,使瓶内气体温度升高,压强增大,所以气球_____,又因为红磷燃烧消耗_____,使瓶内压强_____,故气球变瘪,冷却后变得更瘪。(4)实验中,若红磷用量不足,对实验的结果有无影响,并说明理由______________________________________________________________。
无 影响,装置内发生了化学反应且反应前后物质总质量未发生改变
4. 装置的评价与改进(1)改进原因:方案三装置敞口放置,反应有气体逸出。(2)改进思路(天平装置已省略,只改进左盘)①更换药品:换成不会产生气体的药品。如图1所示,将方案三左盘中的碳酸钠粉末换为硝酸银溶液,反应的现象为_______________。②更换装置:不更换药品,更换为密闭装置,防止气体逸出。如图2所示。
2NaOH+CuSO4 === Cu(OH)2↓+ Na2SO4
(1)实验一将氢氧化钠溶液滴入硫酸铜溶液中观察到的现象是_________________,发生反应的化学方程式为_______________________________________,一段时间后,再把锥形瓶放回天平左盘,最后天平_____(填“平衡”或“不平衡”)。
例 某兴趣小组设计如下实验验证质量守恒定律。
(2)实验二中同学们观察到反应前后天平平衡,但小柯同学认为该实验不能直接用于验证质量守恒定律,请分析原因________________________。(3)(2021铁岭)实验三_____(填“能”或“不能”)用于验证质量守恒定律,在此过程中燃烧掉的蜡烛质量_____(填“大于”“小于”或“等于”)生成的二氧化碳和水蒸气的总质量。
稀硫酸与氯化钠溶液不反应
2024甘肃中考化学一轮复习之中考考点研究 第六单元 碳和碳的氧化物秘(课件): 这是一份2024甘肃中考化学一轮复习之中考考点研究 第六单元 碳和碳的氧化物秘(课件),共60页。PPT课件主要包含了答案B,溶液变红,长颈漏斗,②⑥⑧⑨,检查装置气密性,澄清石灰水变浑浊,可以控制反应速率,BIF,浓硫酸,碳和碳的氧化物等内容,欢迎下载使用。
2024甘肃中考化学一轮复习之中考考点研究 第九单元 溶液(课件): 这是一份2024甘肃中考化学一轮复习之中考考点研究 第九单元 溶液(课件),共44页。PPT课件主要包含了MgSO4,升高温度或加溶剂,不一定,思维导图,溶解与乳化,溶液兰州4考,乳化兰州3考,判断方法,相互转化,降低温度等内容,欢迎下载使用。
2024甘肃中考化学一轮复习之中考考点研究 第二单元 我们周围的空气(课件): 这是一份2024甘肃中考化学一轮复习之中考考点研究 第二单元 我们周围的空气(课件),共60页。PPT课件主要包含了创新考法,③④⑥⑨,锥形瓶,AC或AE,催化作用,化学性质,不易溶于水,排水或向上排空气,我们周围的空气,思维导图等内容,欢迎下载使用。












