


2024福建中考化学一轮复习 微专题6 粗盐提纯(含可溶性杂质的去除)(课件)
展开这是一份2024福建中考化学一轮复习 微专题6 粗盐提纯(含可溶性杂质的去除)(课件),共23页。PPT课件主要包含了玻璃棒,重新过滤,出现较多固体,混合物,Na2CO3溶液,NaOH溶液,BaCl2溶液,2除杂流程,3流程分析,Na2SO4等内容,欢迎下载使用。
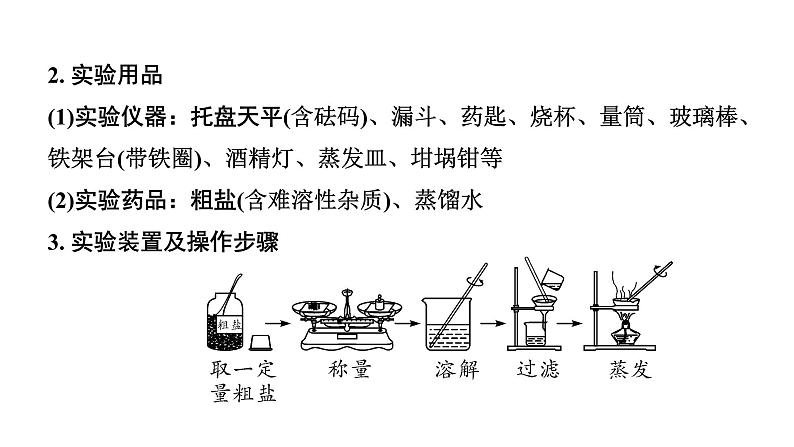
一、粗盐中难溶性杂质的去除 1. 实验原理利用氯化钠和泥沙在水中溶解度的差别使之分离并获得较纯净的氯化钠晶体。
2. 实验用品(1)实验仪器:托盘天平(含砝码)、漏斗、药匙、烧杯、量筒、玻璃棒、铁架台(带铁圈)、酒精灯、蒸发皿、坩埚钳等(2)实验药品:粗盐(含难溶性杂质)、蒸馏水3. 实验装置及操作步骤
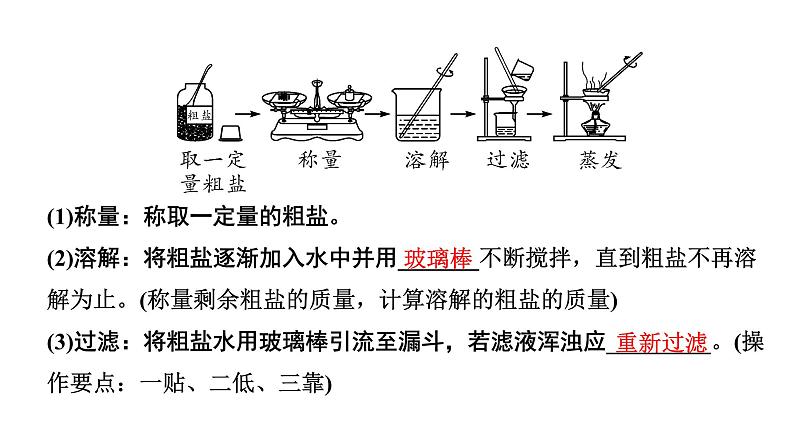
(1)称量:称取一定量的粗盐。 (2)溶解:将粗盐逐渐加入水中并用_______不断搅拌,直到粗盐不再溶解为止。(称量剩余粗盐的质量,计算溶解的粗盐的质量) (3)过滤:将粗盐水用玻璃棒引流至漏斗,若滤液浑浊应_________。(操作要点:一贴、二低、三靠)
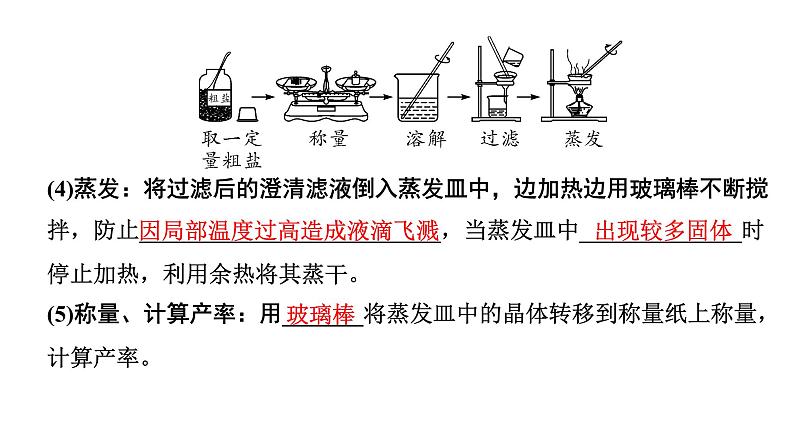
(4)蒸发:将过滤后的澄清滤液倒入蒸发皿中,边加热边用玻璃棒不断搅拌,防止__________________________,当蒸发皿中______________时停止加热,利用余热将其蒸干。(5)称量、计算产率:用_______将蒸发皿中的晶体转移到称量纸上称量,计算产率。
因局部温度过高造成液滴飞溅
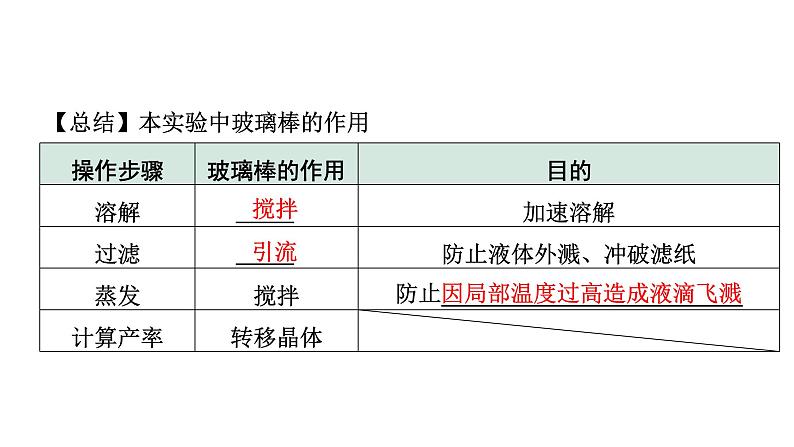
【总结】本实验中玻璃棒的作用
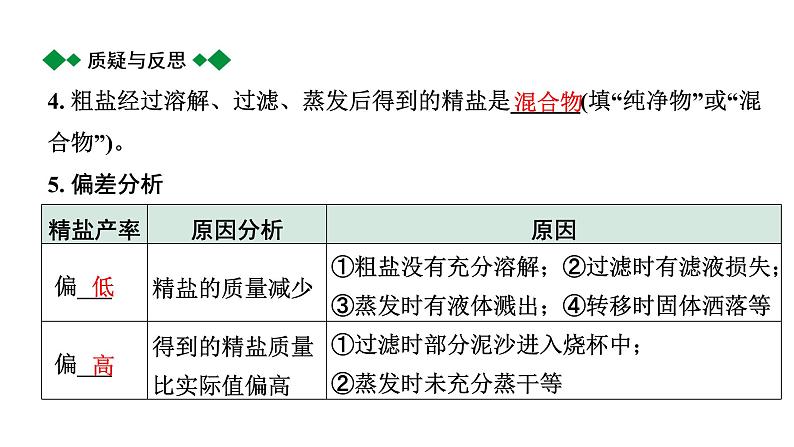
4. 粗盐经过溶解、过滤、蒸发后得到的精盐是______(填“纯净物”或“混合物”)。5. 偏差分析
二、粗盐中可溶性杂质的去除1. 实验目的:粗盐中除了含有不溶性杂质外,也含有CaCl2、MgCl2、Na2SO4等可溶性杂质,为除去粗盐中的___________________(填离子符号),设计方案。
2. 实验步骤(1)除杂试剂的选择①除去CaCl2:____________;②除去MgCl2:___________;③除去Na2SO4:__________。
Na2SO4+BaCl2 === BaSO4↓+2NaCl
NaCl、BaCl2、MgCl2、CaCl2
MgCl2+2NaOH === Mg(OH)2 ↓+2NaCl
NaCl、BaCl2、CaCl2、NaOH
CaCl2和过量的BaCl2
Na2CO3+CaCl2=== 2NaCl+CaCO3↓
BaCl2+Na2CO3=== BaCO3↓+2NaCl
NaCl、NaOH、Na2CO3
过量的Na2CO3和NaOH
HCl+NaOH=== NaCl+H2O
Na2CO3+2HCl=== 2NaCl+CO2↑+H2O
3. 实验反思(1)上述流程中,试剂加入顺序可以调整,但必须保证Na2CO3在BaCl2溶液之后加入,否则过量的_____无法除去,______始终在最后一个加入。(2)如果加入的稀盐酸过量,则对所得到的氯化钠纯度___(填“有”或“无”)影响,原因是_______________________________________________________。
因为盐酸具有挥发性,在蒸发结晶过程中过量的盐酸会被除去
(3)提纯后发现所得的氯化钠的质量大于原粗盐中氯化钠的质量,原因是_______________________。(4)药品的选择与替代①不能用K2CO3溶液代替Na2CO3溶液,原因是_____________。②从原理上分析,在除去粗盐中可溶性杂质时,可用________溶液代替NaOH溶液和BaCl2溶液。
提纯过程中有氯化钠生成
1. 如图是某实验小组进行粗盐中难溶性杂质的去除的实验操作示意图:(1)进行该实验的正确操作顺序为_____________。
(2)操作④的名称是_____,该操作中有一处错误,请指出:_________________,改正后继续完成实验。(3)若操作⑥得到的滤液仍浑浊,可能的一种原因是___________。(4)老师建议在溶解和过滤之间增加“溶液静置”的步骤,其目的是___________________________________________________。
没有用玻璃棒搅拌
使不溶性物质沉降,避免堵住滤纸的小孔,加快过滤速率
(5)在“粗盐中难溶性杂质的去除”实验中,玻璃棒的用途不正确的是____(填字母)。A. 称取粗盐后,把粗盐研磨细B. 溶解时搅拌,加速粗盐溶解C. 称量精盐前,把精盐固体转移到纸上D. 蒸发时搅拌,防止因局部温度过高造成液滴飞溅
(6)实验小组通过计算发现,实验测得的精盐产率比理论值偏低。请分析可能的原因:_________________________________________________________________________________________________________________________。(7)[生活情境]从NaCl的溶解度与温度的关系看,从海水中获得NaCl晶体,不采用冷却热饱和溶液的方法,理由是________________________________。
溶解时所加水量偏少,粗盐未完全溶解(或将烧杯中的溶液转移至蒸发皿中时液体溅出、蒸发结晶操作后未将蒸发皿内的固体全部转移等)
氯化钠的溶解度受温度变化影响较小
(8)[创新设问](2023贵阳)已知:20 ℃氯化钠的溶解度为36 g,水的密度可近似看作1 g/mL。20 ℃时提纯9 g粗盐,若已知粗盐中氯化钠含量约为80%,溶解时应选择哪一种规格的量筒量取所需要的水最为合适(提供的量筒规格有“10 mL”“25 mL”和“100 mL”),请你选择并说明理由_______________________________________________________________________________________________________________________________________________________。
选择25 mL的量筒,根据题目所给条件可算出粗盐中氯化钠的质量约为7.2 g,20 ℃时至少需20 mL水才能将该氯化钠全部溶解,选择规格为25 mL的量筒量取20 mL水误差小
2. (2021重庆A卷)某兴趣小组查阅资料发现除去泥沙等杂质的粗盐,可能还含有CaCl2、MgCl2、Na2SO4等杂质。他们将该粗盐配成溶液,并对粗盐溶液进行探究和除杂。(1)配制溶液时,加速粗盐溶解的玻璃仪器是_______。【探究过程】(2)步骤1:向粗盐溶液中加入过量NaOH溶液,未出现明显现象,说明溶液中无_______________杂质;向溶液中继续滴加过量Na2CO3溶液,产生白色沉淀,过滤。反应的化学方程式为_____________________________________。
MgCl2(或氯化镁)
CaCl2+Na2CO3 === CaCO3↓+2NaCl
(3)步骤2:向步骤1的滤液中滴加过量BaCl2溶液,产生白色沉淀,过滤;向滤液中滴加稀盐酸至溶液呈中性即得NaCl溶液。加稀盐酸除去的物质是_________________。【初步结论】杂质成分已确定,且已完全除去。【反思交流】(4)小东认为Na2SO4还不能确定是否存在,可向步骤2的沉淀中滴加过量稀盐酸,若观察到_________________________的现象,证明粗盐中确实存在Na2SO4。
NaOH(或氢氧化钠)
沉淀部分溶解,有气泡产生
(5)小红认为杂质也未完全除去,可按照步骤1和步骤2重新实验,并对调其中两种试剂的位置就能达到除杂目的,这两种试剂为___(填序号)。A. Na2CO3溶液、BaCl2溶液B. 稀盐酸、BaCl2溶液C. NaOH溶液、Na2CO3溶液
相关课件
这是一份2024贵州中考一轮复习 人教版化学 教材基础复习 实验7 粗盐中难溶性杂质的去除 课件,共13页。PPT课件主要包含了实验清单·必备,蒸发皿,酒精灯,难溶于水,玻璃棒,较多固体,加速溶解,多维设问·练透,托盘天平,BaCl2溶液等内容,欢迎下载使用。
这是一份2024山东中考复习 人教版化学 考点研究 实验8 粗盐中难溶性杂质的去除 课件,共27页。PPT课件主要包含了粗盐不再溶解,玻璃棒,再过滤一次,出现较多固体,坩埚钳,防止因,不是精盐中还含有,CaCl2等,大部分固体析出,搅拌加速溶解等内容,欢迎下载使用。
这是一份2024山东中考复习 人教版化学 基础知识复习 实验8 粗盐中难溶性杂质的去除 课件,共22页。PPT课件主要包含了粗盐不再溶解,玻璃棒,再过滤一次,出现较多固体,坩埚钳,防止因,不是精盐中还含有,CaCl2等,紧贴漏斗内壁,上层清液等内容,欢迎下载使用。












