





模块4 主题3 第2讲 晶体的性质 课件 2025高考化学一轮复习
展开1. 能根据离子化合物的结构特征和晶格能解释离子化合物的物理性质。2. 能用金属键的自由电子理论解释金属的一些物理性质。3. 结合实例说出分子晶体的熔、沸点等物理性质的特点;了解氢键的存在对物质性质的影响。4. 能从共价晶体结构角度认识、比较共价晶体的主要物理性质。5. 知道介于典型晶体之间的过渡晶体及混合型晶体是普遍存在的。
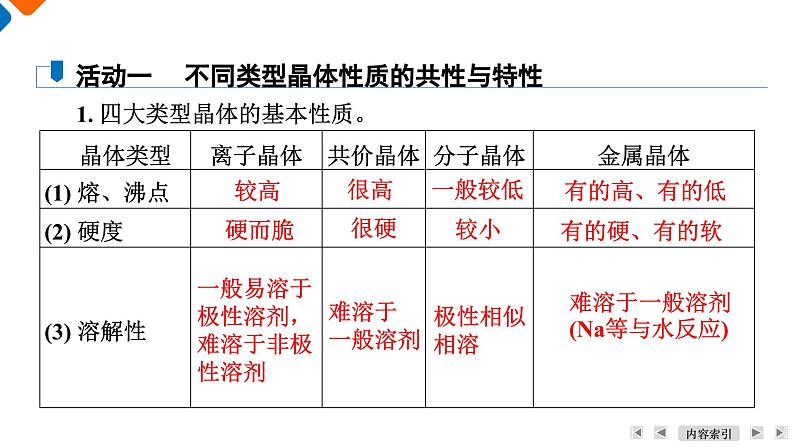
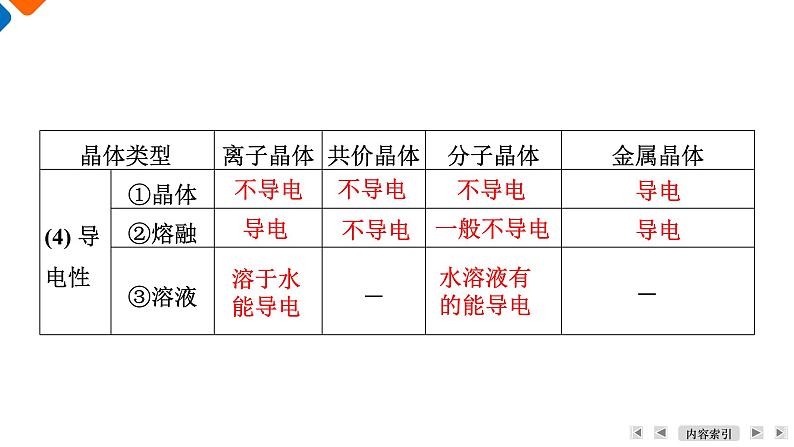
1. 四大类型晶体的基本性质。
活动一 不同类型晶体性质的共性与特性
一般易溶于极性溶剂,难溶于非极性溶剂
难溶于一般溶剂(Na等与水反应)
2. 晶体性质的特殊性。(1) 下列说法是否正确?若说法错误,请举例说明。①共价晶体的熔点一定比离子晶体、金属晶体的高。【答案】 不正确,比如MgO的熔点为2 852℃,Fe的熔点为1 538℃,Si的熔点为1 410℃。②常温、常压下,所有金属单质都是金属晶体。【答案】 不正确,比如Hg的熔点较低,常温下呈液态。③所有离子晶体都能使其在水溶液中和熔融状态下导电。【答案】 不正确,比如不溶于水的离子晶体(如硫酸钡),加热易分解的离子晶体(如氯化铵)。
(2) 根据晶体的性质,说说为何称石墨是混合型晶体。【答案】 石墨能导电,可看作金属晶体;石墨的熔点很高,可看作共价晶体;石墨很软,可看作分子晶体。(3) 离子晶体和共价晶体的过渡标准是化学键中离子键成分的百分数。离子键成分的百分数大,作为离子晶体处理,离子键成分的百分数小,作为共价晶体处理。Na2O、MgO、SiO2、P2O5、SO3、Cl2O7六种氧化物中从左到右,离子键成分的百分数越来越小,其中作为离子晶体处理的是哪些?作为共价晶体处理的是哪些?作为分子晶体处理的是哪些?【答案】 作为离子晶体处理的是Na2O、MgO;作为共价晶体处理的是SiO2;作为分子晶体处理的是P2O5、SO3、Cl2O7。
(4) 关于Al2O3所属晶体类型存在争议,有人认为是离子晶体,有人认为是共价晶体。①如果你是“离子晶体”论的支持者,请你举出你的论据。【答案】 熔融状态下能导电,工业上电解熔融氧化铝生产铝。 ②如果你是“共价晶体”论的支持者,请你举出你的论据。【答案】 硬度大、熔点很高,具有共价晶体的特点。
1. 根据不同类型晶体结构与性质的关系,回顾不同类型晶体熔、沸点的影响因素与变化规律。【答案】 对于金属晶体,金属原子半径越小、价电子数越多,晶体熔点越高。对于离子晶体,阴、阳离子核间距越小,离子的电荷数越大,晶格能越大,晶体熔点也越高。对于分子晶体(结构相似),相对分子质量越大、范德华力越大,晶体熔点越高;若分子间形成氢键时,晶体熔点会更高。对于共价晶体,共价键越短,键能越大,晶体熔点越高。
活动二 不同类型晶体熔、沸点的比较
2. 根据不同类型晶体结构与性质的关系,将下列各组物质按照熔、沸点由高到低的顺序排列。(1) 金属晶体熔、沸点的比较。①Li、Na、K②Na、Mg、Al【答案】 ①Li、Na、K ②Al、Mg、Na
(2) 离子晶体熔、沸点的比较。①NaF、NaCl、NaBr②Na2O、MgO、K2O③MgO、SrO、BaO【答案】 ①NaF、NaCl、NaBr ②MgO、Na2O、K2O ③MgO、SrO、BaO
(3) 分子晶体熔、沸点的比较。①F2、Cl2、Br2②HF、HCl、HBr③CF4、CCl4、CBr4④CH3OH、C2H5OH、C3H7OH【答案】 ①Br2、Cl2、F2 ②HF、HBr、HCl ③CBr4、CCl4、CF4 ④C3H7OH、C2H5OH、CH3OH
(4) 共价晶体熔、沸点的比较。①C、Si、SiC ②B、Si、BN【答案】 ①C、SiC、Si ②BN、B、Si(5) 各类晶体熔、沸点的比较。①SiO2、NaCl、CO2、Na ②CCl4、Si、Al、Ga【答案】 ①SiO2、NaCl、Na、CO2 ②Si、Al、Ga、CCl4
1 (2023山东卷)石墨与F2在450 ℃反应,石墨层间插入F得到层状结构化合物(CF)x,该物质仍具润滑性,其单层局部结构如图所示。下列关于该化合物的说法正确的是( )A. 与石墨相比,(CF)x导电性增强B. 与石墨相比,(CF)x抗氧化性增强C. (CF)x中C—C的键长比C—F的短D. 1 ml (CF)x中含有2x ml共价单键
【解析】 石墨晶体中每个碳原子上未参与杂化的1个2p轨道上电子在层内离域运动,故石墨晶体能导电,而(CF)x中没有未参与杂化的2p轨道上的电子,故与石墨相比,(CF)x导电性减弱,A错误;(CF)x中C原子的所有价键均参与成键,未有未参与成键的孤电子或者不饱和键,故与石墨相比,(CF)x抗氧化性增强,B正确;已知C的原子半径比F的大,故可知(CF)x中C—C的键长比C—F的长,C错误;由题干结构示意图可知,在(CF)x中C与周围的3个碳原子形成共价键,每个C—C键被2个碳原子共用,和1个F原子形成共价键,即1 ml (CF)x中含有2.5x ml共价单键,D错误。
2 (2023辽宁卷)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )B. 图1中O原子的配位数为6C. 图2表示的化学式为LiMg2OClxBr1-xD. Mg2+取代产生的空位有利于Li+传导
3 (2023湖北卷)镧La和H可以形成一系列晶体材料LaHn,在储氢和超导等领域具有重要应用。LaHn属于立方晶系,晶胞结构和参数如图所示。高压下,LaH2中的每个H结合4个H形成类似CH4的结构,即得到晶体LaHx。下列说法错误的是( )
A. LaH2晶体中La的配位数为8B. 晶体中H和H的最短距离:LaH2>LaHxC. 在LaHx晶胞中,H形成一个顶点数为40的闭合多面体笼
4 (组合)(1) (山东卷)OF2的熔、沸点________(填“高于”或“低于”)Cl2O,原因是_____________________________________________ _____________________________________________________________。(2) (全国Ⅱ卷)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是_________________ ____________________________________________________________________________________。
OF2和Cl2O都是分子晶体,结构相似,Cl2O的相对分子质量大,Cl2O分子间的范德华力较大,Cl2O的熔、沸点较高
TiF4为离子晶体,熔点高,其他三种均为分子晶体,随相对分子质量的增大,分子间作用力增大,熔点逐渐升高
(3) (海南卷)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是 。(4) (全国乙卷)卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为________。解释X的熔点比Y高的原因:__________________________________。
自由电子在外加电场中做定向移动
CsCl为离子晶体,ICl为分子晶体
5 (江苏卷)Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu2O。(1) Cu2+基态核外电子排布式为_____________________________。
[Ar]3d9或1s22s22p63s23p63d9
(3) 抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为________;推测抗坏血酸在水中的溶解性:______________(填“难溶于水”或“易溶于水”)。(4) 一个Cu2O晶胞(见图2)中,Cu原子的数目为________。
6 氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。
(1) 基态硼原子的电子排布式为_________。(2) 下列关于这两种晶体的说法中,正确的是________(填字母)。a. 立方相氮化硼含有σ键和π键,所以硬度大b. 六方相氮化硼层间作用力小,所以质地软c. 两种晶体中的B—N键均为共价键d. 两种晶体均为分子晶体
(3) 六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间结构为_____________,其结构与石墨相似却不导电,原因是___________ _______________________。(4) 立方相氮化硼晶体中,硼原子的杂化轨道类型为________。该晶体的天然矿物在青藏高原下约300 km的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是______________。(5) NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 ml NH4BF4含有______ml配位键。
7 (2023组合)(1) (全国甲卷)图1所示的几种碳单质,它们互为________________,其中属于共价晶体的是________________,C60间的作用力是________________。
(2) (湖南卷)Ga(CH3)3的沸点为55.7 ℃,晶体Ga(CH3)3的晶体类型是________。(3) (山东卷)卤素可形成许多结构和性质特殊的化合物。-40 ℃时,F2与冰反应生成HOF利HF。常温常压下,HOF为无色气体,固态HOF的晶体类型为________,HOF水解反应的产物为__________ ________________________________________________(填化学式)。
(4) (全国甲卷)气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如图2所示,二聚体中Al的轨道杂化类型为________。AlF3的熔点为1 090 ℃,远高于AlCl3的192 ℃,由此可以判断铝氟之间的化学键为________键。AlF3结构属立方晶系,晶胞如图3所示,F-的配位数为________。若晶胞参数为a pm,晶体密度ρ=________g·cm-3 (列出计算式,阿伏加德罗常数的值为NA)。
【解析】 (2) Ga(CH3)3的沸点很低,故为分子晶体。(3) 常温常压下,HOF为无色气体,则HOF的沸点较低,因此,固态HOF的晶体类型为分子晶体。HOF分子中F显-1价,其水解时结合H2O电离的H+生成HF,则OH+结合H2O电离的OH-,两者反应生成H2O2,H2O2不稳定,其分解生成O2,因此,HOF水解反应的产物为HF、H2O2和O2。(4) 由Al2Cl6的空间结构结合相关元素的原子结构可知,Al原子价层电子对数是4,其与其周围的4个氯原子形成四面体结构,因此,二聚体中Al的轨道杂化类型为sp3。AlF3的熔点为1 090 ℃,远高于AlCl3的192 ℃,由于F的电负性最大,其吸引电子的能力最强,因此,可以判断铝氟之间
模块3 主题3 第3讲 盐类的水解及应用 课件 2025高考化学一轮复习: 这是一份模块3 主题3 第3讲 盐类的水解及应用 课件 2025高考化学一轮复习,共31页。PPT课件主要包含了学习目标,活动方案,链接真题等内容,欢迎下载使用。
模块3 主题3 第2讲 水的电离平衡及应用 课件 2025高考化学一轮复习: 这是一份模块3 主题3 第2讲 水的电离平衡及应用 课件 2025高考化学一轮复习,共41页。PPT课件主要包含了学习目标,活动方案,链接真题等内容,欢迎下载使用。
模块3 主题2 第3讲 化学平衡的移动 课件 2025高考化学一轮复习: 这是一份模块3 主题2 第3讲 化学平衡的移动 课件 2025高考化学一轮复习,共46页。PPT课件主要包含了学习目标,活动方案,链接真题等内容,欢迎下载使用。












