

2024中考化学压轴题题型3溶解度及其应用
展开1.不同温度下KCl的溶解度如图所示。下列说法正确的是
A.10℃时,100gKCl饱和溶液中溶质质量为31g
B.20℃时,100gKCl饱和溶液的溶质质量分数为34%
C.30℃时,将137gKCl溶液蒸发结晶一定会得到37gKCl
D.40℃时,100g水最多溶解40gKCl
【思路分析】
A选项:溶解度对应的溶剂是100g,溶液溶液不是100g;
B选项:图中,20℃时氯化钾的饱和溶液100g,溶解度为34g,同温度下同种物质在相同溶剂中饱和溶液溶质质量分数相等,与溶液质量无关,则该温度下其饱和溶液的溶质质量分数为34g34g+100g×100%≈25.4%;
C选项:图中,30℃时137g氯化钾的饱和溶液蒸发结晶一定得到37g氯化钾,因为此温度下溶解度为37g,溶液不是饱和无法确定此温度下溶质质量分数,无法确定溶质质量;
D选项:40℃时,氯化钾溶解度为40g,溶解度对应的水是100g,溶液达到饱和,100g水溶解氯化钾最多溶解40g达到饱和。
【方法指导】
①溶液的质量分数=溶质质量溶质质量+溶剂质量×100%
=溶解度溶解度+100g×100%
类型2 两条曲线
2.如图是甲、乙固体的溶解度曲线,下列说法不正确的是
A.图中P点所表示的溶液是t3℃时甲的不饱和溶液
B.分别将t3℃等质量的甲、乙饱和溶液降温至t2℃,所得溶液中溶质质量不相等
C.若甲中含有少量乙,可采用冷却热饱和溶液的方法提纯甲
D.可用t1℃时20%的甲溶液配制10%的甲溶液
【思路分析】
A选项:p点位于甲的溶解度曲线下方,表示t3℃时甲的不饱和溶液;
B选项:分别将t3℃等质量的甲、乙饱和溶液降温至t2℃, t3℃时甲的溶解度大于乙的,则等质量的甲、乙饱和溶液甲的溶剂质量小于乙的,通过溶解度曲线可知降温至t2℃甲乙溶液还是饱和溶液且乙的溶质量分数大于甲的,降温溶剂质量不变,甲的溶剂质量小于乙的,则乙溶液中溶质质量大于甲的;
C选项:甲的溶解度随温度的升高而增大,乙的溶解度随温度的升高而增大不明显,则提纯含有少量乙的甲时,应采用降温结晶的方法;
D选项: t1℃时,甲的溶解度为20g,饱和时最大溶质质量分数为20g20g+100g×100%≈16.7%,达不到20%。
【方法指导】
饱和溶液与不饱和溶液的判断:
①据图判断。
某温度下,溶解度曲线上或曲线上方的点可表示该物质的饱和溶液,溶解度曲线下方的点表示该物质的不饱和溶液;
②数据分析。
如:将溶剂的质量转化为100g:溶质质量等比例转化为ag,若a g≥溶解度,为饱和溶液,若a g<溶解度,为不饱和溶液。
③有晶体析出/固体物质未溶解,则溶液为饱和溶液。
提纯方法的选择:
提纯方法的选择根据目标物的溶解度曲线变化趋势来判断,陡升型曲线降温结晶,缓升型曲线蒸发结晶。
类型3 溶解度曲线与表格结合
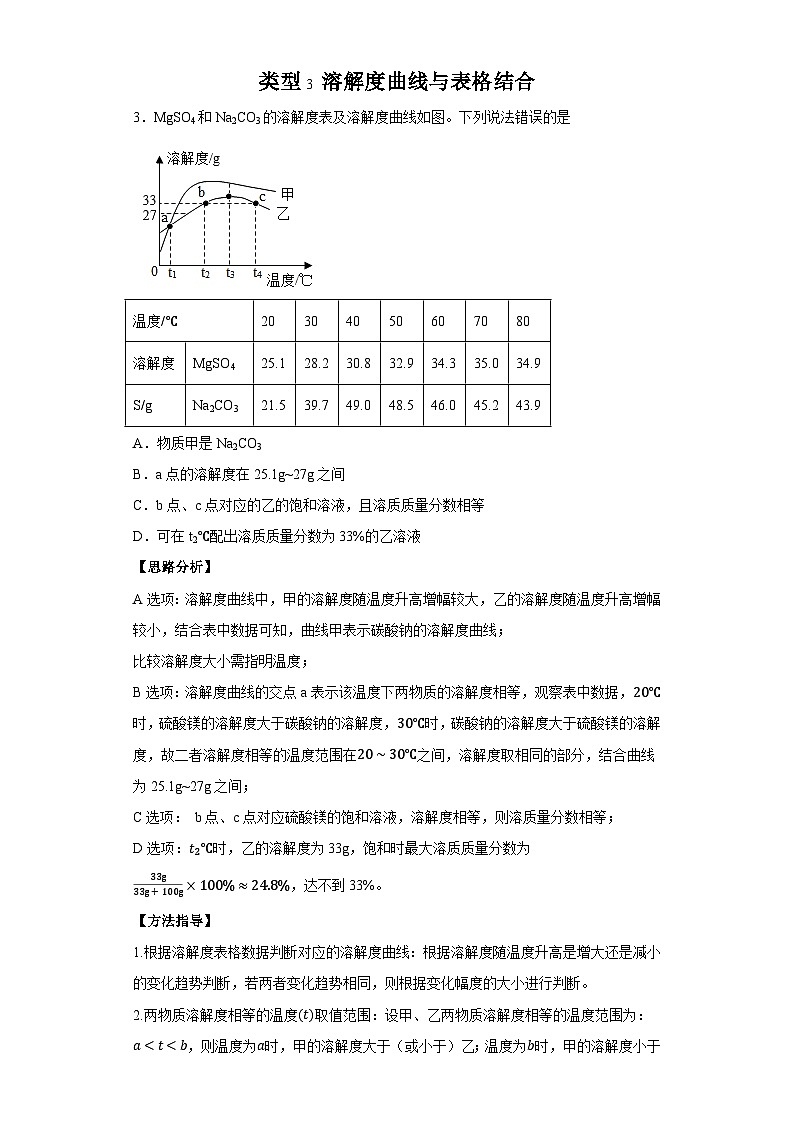
3.MgSO4和Na2CO3的溶解度表及溶解度曲线如图。下列说法错误的是
A.物质甲是Na2CO3
B.a点的溶解度在25.1g~27g之间
C.b点、c点对应的乙的饱和溶液,且溶质质量分数相等
D.可在t2℃配出溶质质量分数为33%的乙溶液
【思路分析】
A选项:溶解度曲线中,甲的溶解度随温度升高增幅较大,乙的溶解度随温度升高增幅较小,结合表中数据可知,曲线甲表示碳酸钠的溶解度曲线;
比较溶解度大小需指明温度;
B选项:溶解度曲线的交点a表示该温度下两物质的溶解度相等,观察表中数据,20℃时,硫酸镁的溶解度大于碳酸钠的溶解度,30℃时,碳酸钠的溶解度大于硫酸镁的溶解度,故二者溶解度相等的温度范围在20∼30℃之间,溶解度取相同的部分,结合曲线为25.1g~27g之间;
C选项: b点、c点对应硫酸镁的饱和溶液,溶解度相等,则溶质量分数相等;
D选项:t2℃时,乙的溶解度为33g,饱和时最大溶质质量分数为33g33g+100g×100%≈24.8%,达不到33%。
【方法指导】
1.根据溶解度表格数据判断对应的溶解度曲线:根据溶解度随温度升高是增大还是减小的变化趋势判断,若两者变化趋势相同,则根据变化幅度的大小进行判断。
2.两物质溶解度相等的温度t取值范围:设甲、乙两物质溶解度相等的温度范围为:a
【拓展】
配制一定温度下的饱和溶液时,相关量的比较:
①溶质的质量一定时,溶解度越大,所需溶剂的质量越小;
②溶剂的质量一定时,溶解度越大,所需溶质的质量越大;
③溶液的质量一定时,溶解度越大,所需溶质的质量越大、溶剂的质量越小。
实战演练
4.天宫课堂上中国宇航员做了一个乙酸钠的“冰球”实验,下图是乙酸钠溶解度曲线,下列说法不正确的是
A.乙酸钠的溶解度随温度升高而增大
B.乙酸钠属于易溶性物质
C.20℃时,乙酸钠溶液的溶质质量分数为31.7%
D.饱和的乙酸钠溶液,若降温结晶可形成“冰球”
5.下图是硝酸钾和氯化钾的溶解度曲线,下列说法不正确的是
A.氯化钾的溶解度随温度的升高而增大
B.t1℃时,硝酸钾和氯化钾的溶解度相等
C.将t1℃时的硝酸钾饱和溶液升温至t2℃,溶质质量不变
D.t2℃时,硝酸钾饱和溶液中溶质与溶剂的质量比为11:21
6.下图为氢氧化钠固体在水中和酒精中的溶解度曲线,下列有关说法不正确的是
A.氢氧化钠易溶于酒精
B.氢氧化钠在水和酒精中的溶解度都随温度的升高而增大
C.20℃时,氢氧化钠水溶液比酒精溶液的溶质质量分数大
D.40℃时,饱和氢氧化钠水溶液降温到20℃会有固体析出
7.压强为101kPa下,硝酸钾和氨气在不同温度下的溶解度如下表。下列说法正确的是
A.两种物质的溶解度均随温度升高而增大
B.20℃时,KNO3饱和溶液中溶质的质量分数为31.6%
C.60℃的KNO3饱和溶液降温至30℃,有晶体析出
D.NH3的溶解度只与温度大小有关
8.NaCl和Ca(OH)2是生活中常见的两种物质,溶解度如下表,下列说法正确的是
A.两种物质的溶解度都是随着温度的升高而增大
B.60℃时,NaCl溶液和Ca(OH)2溶液中溶质质量分数一定不相等
C.升高温度可以将接近饱和的Ca(OH)2溶液变为饱和溶液
D.实验室采用冷却热饱和溶液的方法从NaCl溶液获得NaCl晶体
9.如图是X、Y两种物质的溶解度曲线。下列说法正确的是
A.Y的溶解度随温度升高而增大
B.t1℃时,向10gY中加入40g水形成的溶液中溶质和溶剂的质量比为1:4
C.t2℃时,X、Y的饱和溶液分别降温到t1℃,析出晶体较多的不一定是Y的饱和溶液
D.t2℃时,要使X、Y的饱和溶液中析出等质量的固体,恒温蒸发,蒸发掉较多水的是X的饱和溶液
10.如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是
A.甲物质的溶解度大于乙的溶解度
B.t2℃时,甲、乙两种物质的溶液浓度相等
C.将t3℃时三种物质的饱和溶液都蒸发10g水,析出溶质的质量为甲>乙>丙
D.当甲中混有少量丙时,可采用蒸发结晶的方法提纯
11.如图是A、B两物质的溶解度曲线,叙述正确的是
A.图中阴影部分表示的A、B溶液都是饱和溶液
B.t1℃时,A、B两溶液的溶质质量分数相等
C.t2℃时,100g A的饱和溶液中所含溶质质量小于55g
D.t2℃时,质量相同的A、B配成饱和溶液,A需要水的质量多
12.如图是将80g某固体物质放入盛有50g水的烧杯中充分溶解,测得溶质质量随温度变化的曲线如图所示,下列说法不正确的是
A.t1℃时该物质的溶解度是60g
B.A、B、C三点所对应的溶液中一定是不饱和溶液的为C点处的溶液
C.t2℃时,向烧杯中加水稀释至溶质质量分数为40%,需加水的质量为200g
D.A、B两点均为该温度下的饱和溶液
13.将5g固体M分别投入到盛有不同温度下10g水的烧杯中,充分溶解后,均有固体剩余,数据如下表。下列说法错误的是
A.三个烧杯中的溶液均为饱和状态
B.三个烧杯中,溶质质量分数由大到小为Ⅰ>Ⅱ>Ⅲ
C.20℃时,M的溶解度为20g
D.将Ⅰ、Ⅱ两个烧杯中的溶液,分别升温至40℃,此过程中,析出的固体质量相等
14.向装有等量水的A、B、C烧杯中分别加入10g、25g、25gNaNO3固体,充分溶解后,现象如图一所示,甲乙对应的溶解度曲线如图二所示。下列说法错误的
A.图一烧杯中的溶液一定属于饱和溶液的是B
B.在图二中,能表示NaNO3溶解度曲线的是甲
C.将甲的饱和溶液从t2℃降温到t1℃,乙的饱和溶液从t1℃升温到t2℃,两溶液析出晶体质量可能相等
D.依据图二的分析判断,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的溶质的质量分数:甲=乙
15.已知某物质的溶解度随温度的升高而增大,现将80g的该物质放入50g水中,并改变溶液的温度,得到的溶液质量随温度变化如图所示,下列说法错误的是
A.可推断0℃对应的溶液为饱和溶液
B.A点对应的溶液溶质质量分数为50%
C.由B点可推断该物质在40℃的溶解度为160g
D.C点对应的是不饱和溶液
温度/℃
20
30
40
50
60
70
80
溶解度
MgSO4
25.1
28.2
30.8
32.9
34.3
35.0
34.9
S/g
Na2CO3
21.5
39.7
49.0
48.5
46.0
45.2
43.9
温度℃
10
20
30
60
溶解度/g
KNO3
20.9
31.6
45.8
110
NH3
70
56
44.5
20
温度
溶解度
20℃
40℃
60℃
80℃
100℃
NaCl
36.0g
36.6g
37.3g
38.4g
39.8g
Ca(OH)2
0.16g
0.14g
0.12g
0.095g
0.07g
烧杯编号
Ⅰ
Ⅱ
Ⅲ
未溶解的固体质量(g)
3
4.2
4.6
参考答案:
1.D
【详解】A、10℃时氯化钾溶解度是31g,131gKCl饱和溶液中溶质质量等于31g,选项不正确。
B、20℃时氯化钾溶解度是34g,此时氯化钾饱和溶液中的溶质质量分数都等于:34g34g+100g×100%≈25.4%,小于34%,选项不正确。
C、30℃时氯化钾溶解度是37g,将此时137gKCl饱和溶液蒸发结晶一定会得到37gKCl,但是选项没有给出137gKCl溶液是否属于饱和状态,则最后不一定得到37gKCl,选项不正确。
D、40℃时氯化钾溶解度是40g,100g水最多溶解40gKCl,选项正确。
故选D。
2.D
【详解】A、溶解度曲线下方的点表示不饱和溶液,P点位于溶解度曲线甲的下方,表示甲的不饱和溶液,A正确。
B、甲溶解度降温变化较大,乙溶解度降温变化较小,故等质量的甲、乙饱和溶液降温甲结晶较多,乙结晶较少,所得溶液中溶质质量不相等,B正确。
C、甲溶解度随温度变化较大,若甲中含有少量乙,可采用冷却热饱和溶液的方法提纯甲,C正确。
D、t1℃时甲溶解度20g,饱和溶液溶质质量分数20g100g+20g×100%<20%,无法配置20%甲溶液,D错误。
故选:D。
3.D
【详解】A、由溶解度曲线可知,高于t1℃时,甲物质的溶解度始终大于乙物质的溶解度,所以甲物质是Na2CO3,故正确;
B、由溶解度曲线可知,a点的溶解度在25.1g~27g之间,故正确;
C、b点、c点乙物质的溶解度相等,所以b点、c点对应的乙的饱和溶液,溶质质量分数相等,故正确;
D、t2℃时,乙物质的溶解度为33g,饱和溶液的溶质质量分数为33g100g+33g×100%≈24.8%,故错误;
故选:D。
4.C
【详解】A、通过分析溶解度曲线可知,乙酸钠的溶解度随温度升高而增大,故A正确;
B、20℃时时,乙酸钠的溶解度是46.5g,属于易溶性物质,故B正确;
C、20℃时时,乙酸钠的溶解度是46.5g,乙酸钠溶液的状态不能确定,溶质质量分数也不能确定,故C错误;
D、乙酸钠的溶解度随温度的降低而减小,所以饱和的乙酸钠溶液,若降温结晶可形成“冰球”,故D正确;
故选C。
5.D
【详解】A、由硝酸钾和氯化钾的溶解度曲线图可知,氯化钾的溶解度随温度的升高而增大,故A正确;
B、由硝酸钾和氯化钾的溶解度曲线图可知,t1℃时,硝酸钾和氯化钾的溶解度曲线相交,硝酸钾和氯化钾的溶解度相等,故B正确;
C、硝酸钾的溶解度随温度的升高而增大,将t1℃时的硝酸钾饱和溶液升温至t2℃,溶质质量不变,故C正确;
D、t2℃时,硝酸钾的溶解度为110g,硝酸钾饱和溶液中溶质与溶剂的质量比为110g:100g=11:10,故D不正确。故选D。
6.C
【详解】A、由溶解度曲线图可知,在室温下氢氧化钠的酒精溶液中溶解度大于10g为易溶物质,故A说法正确;B、由于氢氧化钠在水和酒精中的溶解度曲线都是向上的,随着温度的升高而增大;故B说法正确;C、虽然由二者的溶解度曲线可以看出在20℃时,该物质在水中的溶解度比在酒精中的溶解度大,但由于没有说明是不是饱和溶液,也就是没有说明各自形成溶液中溶质与溶剂的质量,故无法比较质量分数的大小;故C说法错误;D、氢氧化钠在水中的溶解度都随温度的升高而增大,40℃时,饱和氢氧化钠水溶液降温到20℃会有固体析出;故D说法正确。故选C。
7.C
【详解】A、由溶解度表可知,硝酸钾的溶解度随温度升高而增大,NH3的溶解度随温度升高而减小,故选项说法错误。
B、20℃时,KNO3饱和溶液中溶质的质量分数为+100g×100%<31.6%,故选项说法错误。
C、硝酸钾的溶解度随温度升高而增大,60℃的KNO3饱和溶液降温至30℃,温度降低,硝酸钾的溶解度减小,有晶体析出,故选项说法正确。
D、NH3的溶解度不是只与温度大小有关,还与压强大小有关,故选项说法错误。
故选:C。
【点睛】本题难度不大,掌握饱和溶液中溶质质量分数=溶解度溶解度+100g×100%、气体溶解度的影响因素等是正确解答本题的关键。
8.C
【详解】A、NaCl的溶解度随温度的升高而增大,Ca(OH)2的溶解度随温度的升高而减小,A项错误;
B、60℃时,NaCl溶液和Ca(OH)2溶液中溶质质量分数可能相等,如果是该温度下的饱和溶液,则一定不相等,B项错误;
C、Ca(OH)2的溶解度随温度的升高而减小,升高温度可以将接近饱和的Ca(OH)2溶液变为饱和溶液,C项正确;
D、实验室采用蒸发溶剂的方法从NaCl溶液获得NaCl晶体,D项错误。
故选C。
9.C
【分析】本题考查溶解度曲线。
【详解】A、Y的溶解度随温度升高先增大后减小,故A不符合题意;
B、向10gY中加入40g水最多只能溶解40g100g×20g=8gY,形成的溶液中溶质和溶剂的质量比为8g:40g=1:5,故B不符合题意;
C、饱和溶液的质量关系未知,所以有可能析出晶体质量X比Y多,故C符合题意;
D、t2℃时,X的溶解度等于Y的溶解度,即等质量的X和Y分别溶于水中形成饱和溶液,需要水的质量X等于Y,因此恒温蒸发水的质量X和Y相等,故D不符合题意;
故选C。
【点睛】结合溶解度概念进行分析即可。
10.C
【详解】A、比较溶解度需要具体的温度才有意义,说法不正确,故A不符合题意;
B、根据溶解度曲线知道,t2 ℃时,甲、乙两种物质的溶解度相等,但没有指明溶液是饱和的,所以无法比较两溶液浓度的大小 ,说法不正确,不符合题意;
C,根据溶解度曲线知道,t3 ℃时三种物质的溶解度大小 关系为甲>乙>丙,所以三种物质的饱和溶液都蒸发10g水,析出溶质的质量为甲>乙>丙,说法正确,符合题意;
D、甲物质的溶解度随温度的降低而降低,降低温度,甲会析出;而丙的溶解度随温度的降低而增大,温度越低,丙的溶解度会越大,因此降温不会使丙析出;所以当甲中混有少量丙时,可采用降温结晶的方法提纯甲,说法不正确,不符合题意。
故选C。
11.C
【详解】A、图中阴影部分在曲线A以上,曲线B以下,表示的是A的饱和溶液,B的不饱和溶液,该选项说法不正确;
B、t1℃时,A、B两溶液的溶质质量分数不一定相等,是因为不知道溶液是否饱和,该选项说法不正确;
C、t2℃时,A的溶解度为55g ,则100gA的饱和溶液中所含溶质质量为100g×55g100g+55g×100%≈35.5g,小于55g,该选项说法正确;
D、t2℃时A的溶解度大于B,质量相同的A、B配成饱和溶液,A需要水的质量小,该选项说法不正确。
故选C。
12.C
【详解】A、t1℃时该物质在50g水中最多溶解30g溶质,则100g水中最多溶解60g,所以t1℃时该物质的溶解度是60g,此选项正确;
B、t2℃时只溶解了30g溶质,属于饱和溶液,t2℃时50g水中刚好溶解完80g溶质,属于饱和溶液,再升温到t3℃时,溶解度变大,变为不饱和溶液,此选项正确;
C、t2℃时,加水的质量为200g,所得溶液的溶质质量分数为:80g80g+50g+200g×100%=24.2%,此选项错误;
D、t2℃时只溶解了30g溶质,属于饱和溶液,t2℃时50g水中刚好溶解完80g溶质,属于饱和溶液,此选项正确。
故选C。
13.D
【详解】A、充分溶解后,均有固体剩余,说明三个烧杯中的溶液均为饱和状态,不符合题意;
B、三个烧杯中,溶剂质量相同,Ⅰ、Ⅱ、Ⅲ溶液中溶质质量依次增大,因此溶质质量分数由大到小为:Ⅰ>Ⅱ>Ⅲ,不符合题意;
C、设20℃时,M的溶解度为x,根据题意有:10g:(5g-3g)=100g:x,x=20g,不符合题意;
D、由于I、Ⅱ两个烧杯中的溶质质量不相等,将I、Ⅱ两个烧杯中的溶液,分别升温至40℃,此过程中,析出的固体质量不相等,Ⅰ析出固体质量大,符合题意。故选D。
【点睛】固体物质的溶解度是指一定温度下,该物质在100g溶剂里达到饱和状态时溶解的质量。
14.D
【详解】A、根据图可以看出,A、B、C三个烧杯中的溶液,B中含有未溶解的固体,故B一定属于饱和溶液,故正确;
B、根据烧杯中物质的溶解性可以看出,甲的溶解度随温度的升高而增大,故图二中能表示NaNO3溶解度曲线的是甲,故正确;
C、甲的溶解度随温度的升高而增大明显,而乙的溶解度随温度的升高而降低,所以甲的饱和溶液降温会有晶体析出,而乙升高温度也会有晶体析出,这两溶液析出晶体质量有可能相等,故正确;
D、由图可知在t2°C时甲溶液的溶质质量分数大于乙溶液中溶质的质量分数,现分别将100g甲、乙的饱和溶液从t2°C降温到t1°C,甲溶液中会结晶析出溶质,t1°C时仍为饱和溶液,而乙降温后溶解度变大,成为不饱和溶液,但是溶液中溶质的质量分数没有改变,所以所得溶液的溶质的质量分数:甲>乙,故错误。
故选:D。
【点睛】本题难度较大,主要考查了固体溶解度曲线所表示的意义,及根据固体溶解度度曲线解决相关问题,从而加深学生对固体溶解度的理解和掌握。
15.C
【详解】A、根据溶液中的水为50g,由图像可知故0℃对应的溶液是80g,其中的溶质质量是:80g-50g=30g,根据题意加入的该物质是80g而溶质是30g,分析得该物质未全部溶解,说明溶液饱和,选项正确;
B、如图A点对应的溶液是100g,根据题意可知溶液中水的质量是50g,故溶质质量分数为100g-50g100g×100%=50%,选项正确;
C、如图,B点表示溶液质量是130g,由题意可知溶剂质量是50g,加入的物质是80g,则说明溶质完全溶解,但题中未再继续加溶质,故不能说明此时的溶液是否为恰好饱和状态,若是饱和的根据50g水最多溶解80g该物质,推出40℃时100g水中最多溶解160g溶质,说明该物质在40℃的溶解度为160g,但如果未饱和则该物质在40℃的溶解度大于160g,故选项错误;
D、根据图像可知该物质的溶解度随温度的升高而变大,而B点时溶液已经饱和,故再升温到60℃时,溶液变为不饱和溶液。
答案为:C。
压轴题03 溶解度及其应用(5大题型+方法总结+创新考法)-2024年中考化学三轮复习(全国通用): 这是一份压轴题03 溶解度及其应用(5大题型+方法总结+创新考法)-2024年中考化学三轮复习(全国通用),文件包含压轴题03溶解度及其应用原卷版docx、压轴题03溶解度及其应用解析版docx等2份试卷配套教学资源,其中试卷共45页, 欢迎下载使用。
中考化学二轮复习压轴题提升练习专题03 溶解度及其应用(含解析): 这是一份中考化学二轮复习压轴题提升练习专题03 溶解度及其应用(含解析),共25页。
压轴题03 溶解度及其应用-中考化学压轴题突破(全国通用): 这是一份压轴题03 溶解度及其应用-中考化学压轴题突破(全国通用),文件包含压轴题03溶解度及其应用-中考化学压轴题突破全国通用解析版docx、压轴题03溶解度及其应用-中考化学压轴题突破全国通用原卷版docx等2份试卷配套教学资源,其中试卷共34页, 欢迎下载使用。












