


重庆市南开中学校2024届高三下学期5月第九次质量检测化学试题(学生版+教师版)
展开1.本试卷满分100分,考试时间75分钟。
2.考生作答时,请将答案答在答题卡上。必须在题号所指示的答题区域作答,超出答题区域书写的答案无效,在试题卷草稿纸上答题无效。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Cl-35. 5 Ge-73
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. “神舟”飞天筑梦未来。下列有关说法正确的是
A. 空间站太阳能电池板的主要材料是晶体硅
B. 飞船推进系统中使用的碳纤维属于有机高分子材料
C. 飞船所用燃料偏二甲肼是非极性分子
D. 飞船表面的纳米硅酸盐涂料熔点较低
【答案】A
【解析】
【详解】A.硅能将太阳能转化为电能,则太阳能电池板的主要材料是晶体硅,A正确;
B.碳纤维是一种含碳量在95%以上的高强度、高模量纤维的新型纤维材料,属于无机非金属材料,B不正确;
C.偏二甲肼分子结构不对称,正负电荷的重心不重合,是极性分子,C不正确;
D.硅酸盐属于离子化合物,阴阳离子间通过离子键相结合,所以纳米硅酸盐涂料熔点较高,D不正确;
故选A。
2. 下列化学用语正确的是
A. 丙炔的键线式:
B. 的电子式:
C. 分子的球棍模型:
D. 某种激发态N原子价层电子轨道表达式:
【答案】C
【解析】
【详解】A.丙炔的三个碳原子在一条线上,键线式为:,A错误;
B.C、O之间是两对共用电子,电子式为:,B错误;
C.H2O分子的空间构型为V形,所以球棍模型为:,C正确;
D.图示是基态N原子的价层电子轨道表达式而不是激发态,D错误;
故选C。
3. 下列操作中,不会影响溶液中、、、、、离子大量共存的是
A. 加入B. 加入粉C. 加入氨水D. 通入
【答案】D
【解析】
【详解】A.与会生成沉淀,不能共存,故A项错误;
B.Cu与发生氧化还原反应,不能共存,故B项错误;
C.加入氨水,、会产生氢氧化物沉淀,不能共存,故C项错误;
D.与溶液中离子不发生任何反应,不会影响溶液中离子的大量共存,故D项正确;
故本题选D。
4. 下列叙述正确的是
A. 在中燃烧得到
B. 使品红溶液和酸性溶液褪色,原理不同
C. C和S分别与热的浓硝酸反应,产物中C和S的价态相同
D. 澄清石灰水分别滴加到溶液和溶液中,现象不同
【答案】B
【解析】
【详解】A.Li在中燃烧得到,故A错误;
B.使品红褪色为漂白性(化合反应),使酸性溶液褪色为还原性,原理不同,故B正确;
C.S与浓硝酸反应,最终生成硫酸,产物中S的化合价为+6价,故C错误;
D.澄清石灰水与和均反应生成,现象相同,故D错误;
故选:B。
5. 用制取的反应为:,已知表示阿伏加德罗常数的值,下列说法正确的是
A. 每生成,得到
B. 10.65g固体中含有0.4个σ键
C. 每生成,转移0.1个电子
D. 的溶液中,数目为
【答案】C
【解析】
【详解】A.未注明标准状况,无法根据体积计算气体的物质的量,故A错误;
B.1个含3个σ键,1065g含0.3个σ键,故B错误;
C.1个变为,转移1个电子,则每生成,转移0.1个电子,故C正确;
D.溶液体积未知,无法计算,故D错误;
故选:C。
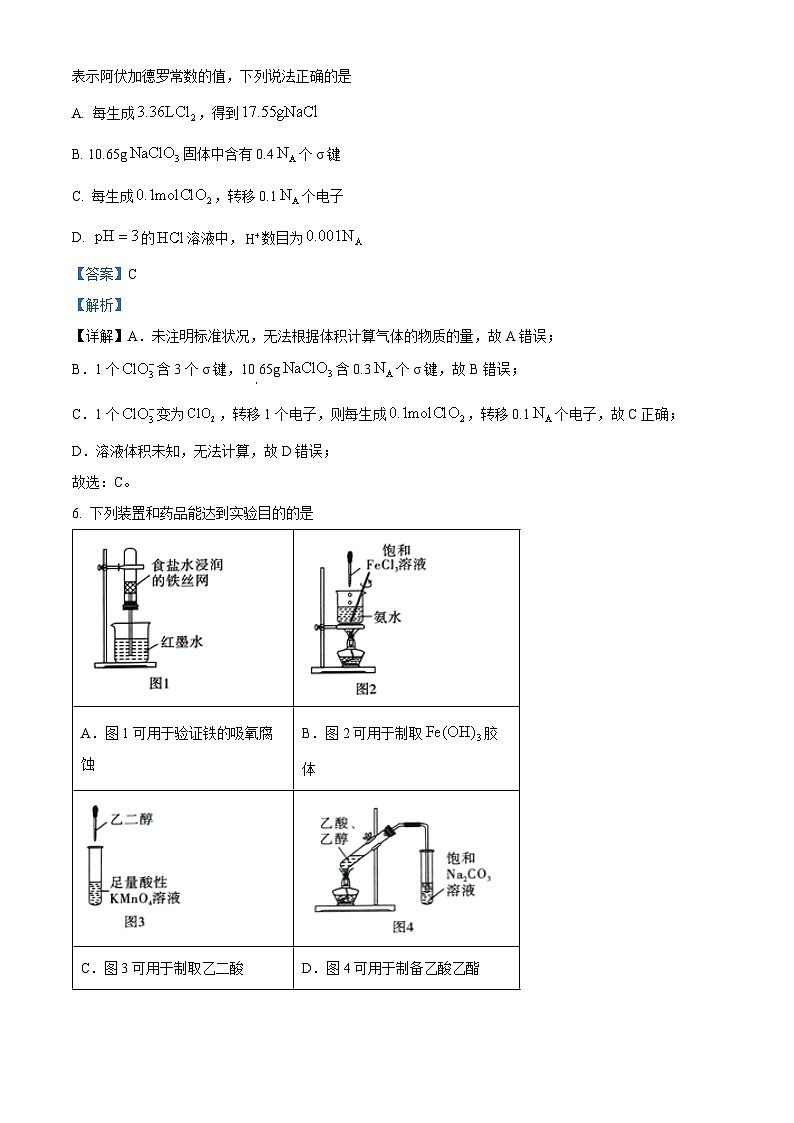
6. 下列装置和药品能达到实验目的的是
A. AB. BC. CD. D
【答案】A
【解析】
【详解】A.食盐水呈中性,在中性条件下,铁丝发生吸氧腐蚀将红墨水吸入上方试管中,图示装置证明铁钉能够发生吸氧腐蚀,A项正确;
B.制取氢氧化铁胶体是向沸水中滴加饱和氯化铁溶液并稍煮沸,且不能用玻璃棒搅拌,否则易引起胶体聚沉,B错误;
C.乙二酸即草酸,酸性会氧化乙二酸,无法制取乙二酸,C错误;
D.制备乙酸乙酯需要浓硫酸作催化剂,且右侧导管不应伸入液面以下,D错误;
本题选A。
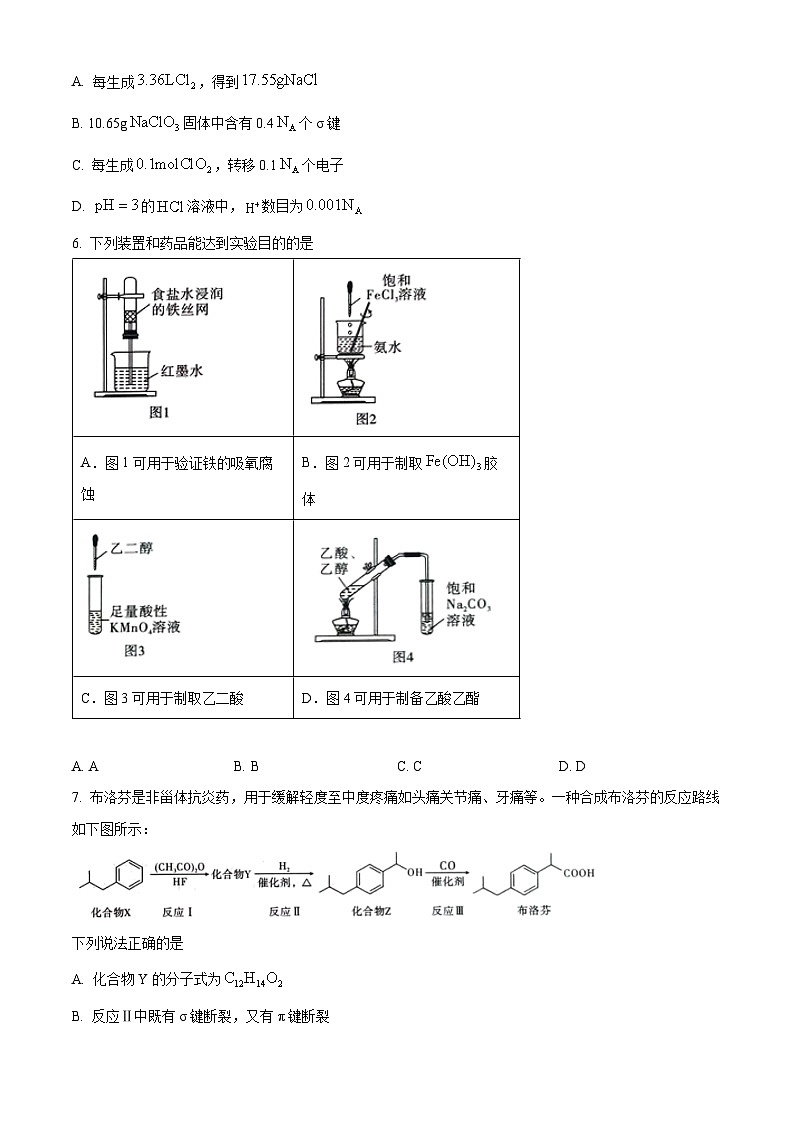
7. 布洛芬是非甾体抗炎药,用于缓解轻度至中度疼痛如头痛关节痛、牙痛等。一种合成布洛芬的反应路线如下图所示:
下列说法正确的是
A. 化合物Y的分子式为
B. 反应Ⅱ中既有σ键断裂,又有π键断裂
C. 化合物Z与酸性溶液反应可生成化合物Y
D. 水中的溶解度:布洛芬>苯甲酸
【答案】B
【解析】
【分析】化合物X与发生取代反应生成化合物Y,化合物Y与H2发生加成反应生成Z,化合物Z发生催化氧化反应生成布洛芬。
【详解】A.根据结构式可知Y的分子式为,A错误;
B.反应Ⅱ中羰基断π键,氢气断σ键,故B正确;
C.与苯环直接相连的碳原子有氢时,该侧链可被酸性溶液氧化为羧基,氧化产物为,故C错误;
D.布洛芬中碳原子数量多,疏水基比苯甲酸的大,水溶性小于苯甲酸,故D错误。
答案选B。
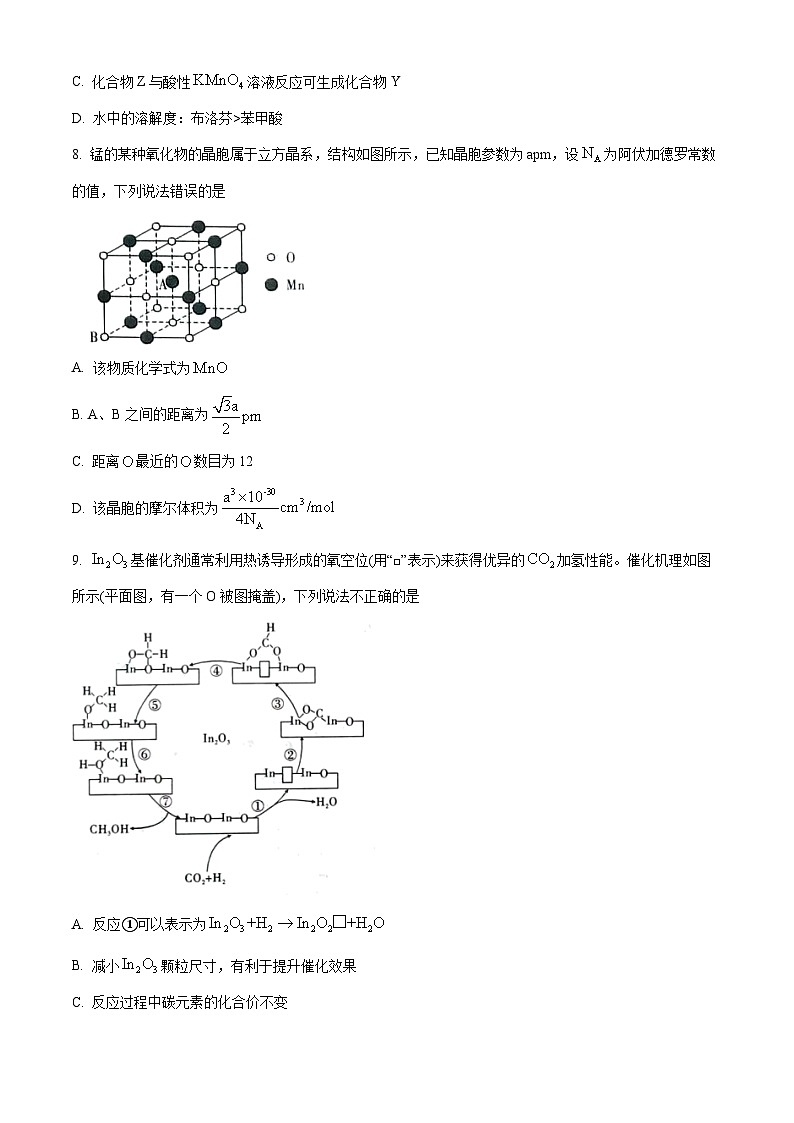
8. 锰的某种氧化物的晶胞属于立方晶系,结构如图所示,已知晶胞参数为apm,设为阿伏加德罗常数的值,下列说法错误的是
A. 该物质化学式为
B. A、B之间的距离为
C. 距离最近的数目为12
D. 该晶胞的摩尔体积为
【答案】D
【解析】
【详解】A.由晶胞结构可知,晶胞中位于顶点和面心的氧原子个数为8×+6×=4,位于棱上和体心的锰原子个数为12×+1=4,则氧化物的化学式为MnO,故A正确;
B.由晶胞结构可知,晶胞中A、B之间的距离为体对角线的,晶胞参数为apm,则A、B之间的距离为,故B正确;
C.由晶胞结构可知,晶胞中位于顶点的氧原子和位于面心的氧原子的距离最近,共有12个,故C正确;
D.由晶胞结构可知,晶胞中位于顶点和面心的氧原子个数为8×+6×=4,位于棱上和体心的锰原子个数为12×+1=4,则晶胞的摩尔体积为=,故D错误;
故选D。
9. 基催化剂通常利用热诱导形成的氧空位(用“□”表示)来获得优异的加氢性能。催化机理如图所示(平面图,有一个O被图掩盖),下列说法不正确的是
A. 反应①可以表示为
B. 减小颗粒尺寸,有利于提升催化效果
C. 反应过程中碳元素的化合价不变
D. 反应⑦的
【答案】C
【解析】
【详解】A.反应①中结合中的O原子生成,过程可表示为:,故A正确;
B.减小颗粒尺寸,可增大催化剂的表面积,有利于反应物与催化剂充分接触,提升催化效果,故B正确;
C.由和生成的总反应来看,C价态要变,故C错误;
D.过程⑦为甲醇的脱附,为吸热过程,故D正确;
故选:C。
10. 下列实验设计或操作能达到实验目的的是
A. AB. BC. CD. D
【答案】A
【解析】
【详解】A.乙醇具有挥发性,挥发出的乙醇不能与溴的四氯化碳溶液反应,不会干扰乙烯的检验,所以将溴乙烷与氢氧化钠的乙醇溶液共热,再将产生的气体通入溴的四氯化碳溶液中,观察溶液颜色变化能证明溴乙烷发生了消去反应,故A正确;
B.除去碱式滴定管尖嘴的气泡时应将滴定管尖嘴斜向上倾斜,挤压橡皮管内玻璃球快速放液将气泡排出,故B错误;
C.硝酸钾的溶解度随温度变化大,氯化钠的溶解度随温度变化小,所以常用蒸发浓缩、冷却结晶、过滤的方法除去硝酸钾固体中少量的氯化钠杂质,故C错误;
D.亚硫酸钠具有还原性,易被空气中的氧气氧化为硫酸钠,使得溶液pH减小,则取适量亚硫酸钠溶液于试管中,测溶液pH,加热一段时间,再次测溶液pH无法证明亚硫酸钠的水解为吸热过程,故D错误;
故选A。
11. 短周期元素R、W、X、Y原子序数依次增大。一种天然矿石广泛用于玻璃行业,1ml含有92ml质子。W的族序数是周期数的3倍,R、W最外层电子数之和与X、Y最外层电子数之和相等,X是地壳中含量最多的金属元素。下列说法错误的是
A. 原子半径:W<Y<X
B. 4种元素在自然界均不能以游离态存在
C. 第一电离能:W>Y>X
D. 化合物中,Y与W杂化方式相同
【答案】B
【解析】
【分析】根据题意可知,W的族序数是周期数的3倍且W为短周期元素,故W应为O元素,X是地壳中含量最多的金属元素,故X是Al。1ml含有92ml质子,减掉W和X的质子,R与2个Y的质子数之和为31,R、O最外层电子数之和与Al、Y最外层电子数相等,可知Y的最外层电子数比R大3,结合R与2个Y的质子数之和为31,可得出Y为Si,R为Li;
【详解】A.同周期元素从左到右原子半径递减,同主族从上到下原子半径递增,原子半径:W<Y<X,A正确;
B.O元素在自然界中既有游离态,又有化合态,B不正确;
C.同周期元素从左到右第一电离能呈增大趋势,同主族从上到下第一电离能递减,第一电离能:W>Y>X,C正确;
D. 化合物即二氧化硅中,只存在Si-O键,每个硅原子形成4个Si-O键、每个氧原子形成2个Si-O键,Y与W杂化方式相同、均为sp3杂化,D正确;
答案选B。
12. 以甲基苯基硫醚()为原料,利用电解法合成甲基苯基亚砜()的原理如图所示,下列说法正确的是
A. M电极的电势低于N电极
B. 电解一段时间后,溶液中变小
C. pH过低不利于甲基苯基亚砜的合成
D. N电极每收集到22.4L(折算为标准状况),理论上可制备2ml甲基苯基亚砜
【答案】C
【解析】
【分析】由图可知,M电极为电解池的阳极,氯离子在阳极失去电子发生氧化反应生成氯自由基,甲基苯基硫醚与氯自由基、水反应生成甲基苯基亚砜、氯离子和氢离子,N电极为阴极,氢离子在阴极得到电子发生还原反应生成氢气,电解的总反应方程式为。
【详解】A.阳极电势比阴极高,由分析可知,M电极为阳极、N电极为阴极,则M电极的电势高于N电极,故A错误;
B.由分析可知,电解的总反应方程式为,反应中氯离子是反应的催化剂,则电解一段时间后,溶液中氯离子浓度不变,故B错误;
C.由图可知,溶液pH过低时,后两步脱去氢离子的反应受到抑制,不利于产物的合成,故C正确;
D.由分析可知,电解的总反应方程式为,则反应生成标准状况下22.4L氢气时,生成甲基苯基亚砜的物质的量为1ml,故D错误;
故选C。
13. 如图所示,无摩擦、有质量的隔板1、2、3将容器分为甲,乙、丙3个部分,同时进行反应:,起始时各物质的物质的量已标在图中。在固定的温度和压强下充分反应后,各部分的体积分别为、、。此时若抽走隔板1,不会引起其他活塞移动。下列说法错误的是
A. 若乙中气体密度不再改变,说明乙中已经达到平衡状态
B. 若,
C. 若将3个隔板全部固定,与未固定相比,丙中放热量减少
D. 若将该容器逆时针旋转90°竖立在桌面上,重新平衡时,乙中C的体积分数减小
【答案】D
【解析】
【详解】A.乙中气体总质量恒定,随反应进行气体分子数减小,因为恒压条件下,容器体积减小,则气体密度逐渐增大,当密度不再改变,说明乙中已经达到平衡状态,故A正确;
B.抽走隔板1后,未造成其他隔板移动,说明甲乙两部分混合后仍处于化学平衡状态,根据等效平衡原理,若将甲中的C全部转化为A、B,则。由此列式:,若,将甲中的C极限转化后,、,与乙完全相同,故,故B正确;
C.隔板固定后,随着反应正向进行,压强逐渐减小,相比于之前正向进行程度更小,放热量减少,故C正确;
D.将容器竖后,隔板的质量造成各部分压强增大,体积减小,因此乙中平衡正移,C的体积分数增大,故D错误;
故选:D。
14. 镀铬工业常用配制电镀液,已知:常温下与第一、二步的络合反应为: 常温下,某小组配制了起始浓度、不同的系列溶液,测得平衡时、、的浓度随的变化曲线如图所示,平衡后其他含铬微粒图中未画出。下列说法正确的是
A. 加水稀释后,溶液中离子的总数减少
B. 溶液中减小,与浓度的比值减小
C. 时,溶液中
D. 某电镀工艺需要,经计算,点所对应的溶液不适合该工艺
【答案】D
【解析】
【详解】A.加水稀释,反应均逆向移动,离子数目增大,故A错误;
B.根据不变,减小,与浓度的比值应该增大,故B错误;
C.读图可知,大小顺序应为:,故C错误;
D.m点与浓度相等,,求得,代入,得,根据物料守恒,,即,解得,因此m点对应的溶液不适合该电镀工艺,故D正确;
故选:D。
二、非选择题:本题共4小题,共58分。
15. 锗是一种战略性金属,用锌浸渣(主要含、,另含少量、以及)提取高纯和的工艺流程如下:
已知:①常温下,。②极易水解,沸点为。
请回答下列问题:
(1)基态的最外层电子排布式为_______,的晶体类型为_______。
(2)“氧化酸浸”后产生的浸渣含有,写出反应的离子方程式_______。
(3)“中和沉淀”中,加化合物A_______(填化学式)调节溶液使和共沉淀,此时滤液中_______。
(4)“中和沉淀”后,用蒸馏水洗涤滤饼,判断滤饼洗净的实验操作和现象是_______。
(5)称取4g高纯样品,加入溶液,用电炉加热溶解。溶解完全后冷却至20℃以下,加入次磷酸钠溶液充分反应,溶液中锗元素以存在。加入适量稀硫酸将溶液调为酸性,以淀粉为指示剂,用标准溶液滴定,消耗溶液的体积为。
已知:a.20℃以下,次磷酸钠不会被和氧化。
b.。
c.样品中的杂质不参与反应。
①滴定终点的现象为_______。
②样品中的纯度为_______(保留2位小数)。
【答案】(1) ①. ②. 分子晶体
(2)
(3) ①. ZnO或者 ②. 1.2
(4)取最后一次洗涤液,加入溶液,未产生白色沉淀,则证明洗净
(5) ①. 当最后半滴标准溶液滴下时,溶液由无色变为蓝色,且30s内不褪色 ②. 98.44
【解析】
【分析】由题给流程可知,向锌浸渣中加入过氧化氢和硫酸的混合溶液,将ZnFe2O4转化为硫酸锌、硫酸铁,硫化锌、二硫化锗转化为硫酸锌、硫酸锗和硫,二氧化硅不反应,过滤得到含有硫酸钙、二氧化硅和硫的滤渣和滤液;向滤液中加入氧化锌或氢氧化锌调节溶液pH,将溶液中的铁离子、锗离子转化为氢氧化铁、氢氧化锗沉淀,过滤得到滤液和滤饼;滤液经蒸发浓缩、趁热过滤、洗涤、干燥得到一水硫酸锌晶体;向滤饼中加入盐酸溶解后,蒸馏得到四氯化锗,四氯化锗一定条件下水解、过滤得到水解液和水合二氧化锗,水合二氧化锗烘干得高纯GeO2。
【小问1详解】
Zn元素原子序数为30,是第四周期过渡金属元素,最外层电子排布式为3d104s2,GeCl4可被蒸馏分离,沸点较低,是分子晶体;
【小问2详解】
“氧化酸浸”中H2O2做氧化剂,二硫化锗转化为硫酸锌、硫酸锗和硫,离子方程式为GeS2+2H2O2+4H+=Ge4++4H2O+2S;
【小问3详解】
“中和沉淀”中,调节溶液pH=4.8,调节pH值不太大且考虑到不引入新杂质,加入的化合物A可以是ZnO或者Zn(OH)2,pH=4.8时,c(H+)=10-4.8ml/L,c(OH-)=10-9.2ml/L,根据Ksp[Ge(OH)4]=c(Ge4+)×c4(OH-)=4×10-46,c(Ge4+)==10-9.2ml/L,同理c(Fe3+)==10-10.4ml/L,故lg[c(Ge4+):c(Fe3+)]=1.2;
【小问4详解】
“中和沉淀”后,用蒸馏水洗涤滤饼,判断滤饼洗净即检验是否残留硫酸根,实验操作和现象是:取最后一次洗涤液,加入BaCl2溶液,未产生白色沉淀,则证明洗净;
【小问5详解】
①根据已知,碘酸根和Ge2+反应生成碘离子,当Ge2+反应完,碘酸根就会和生成的I-反应得到碘单质遇溶液中淀粉变蓝,故滴定终点现象为当最后半滴标准溶液滴下时,溶液由无色变为蓝色,且30s内不褪色;
②根据所给反应,n(GeO2)=n(Ge2+)=3n()=0.5000ml/L×0.025L×3=ml,故样品中GeO2的纯度为98.44%。
16. 用以下装置制备钴(Ⅲ)的配合物并测定该配合物的组成。
Ⅰ.制备钴(Ⅲ)的配合物
实验装置如图所示(省略夹持装置),操作过程如下:
步骤1:关闭活塞K,将盐酸滴入装置A的三颈烧瓶中,发生反应(钻与盐酸的反应类似铁)。反应完全后,将装置A和B中的溶液混合。
步骤2:用恒压滴液漏斗将双氧水缓慢滴入装置B的三颈烧瓶中,滴加结束后再缓慢滴加4ml/L盐酸(在通风橱内进行),在85℃水浴中加热20min。
步骤3:冷却至室温,抽滤,精制,得纯净产品。
(1)仪器a的名称为_______。
(2)判断装置A中反应完全的标志为_______。
(3)实现装置A和B中溶液混合的操作是_______。
(4)双氧水的作用为_______。
(5)水浴温度控制在85℃的原因是_______。
(6)某同学用图装置进行抽滤,该装置存在问题有_______。
Ⅱ.用电导法测定锂离子的电荷数
25℃时,用电导仪测出该配合物稀溶液的电导率为。已知:
①25℃时,稀溶液中,配合物电离出的离子总数与摩尔电导的关系如下:
摩尔电导为配合物的物质的量浓度为配合物的电导率。
②该配合物在水中的电离方程式为。
③该配合物中心离子的配位数为6。
(7)通过计算,_____。写出装置B中制备钴(Ⅲ)的配合物的总的化学方程式_______。
【答案】(1)球形干燥管
(2)注射器活塞的位置不再发生变化(其它合理答案也可)
(3)打开活塞K,向里推动注射器活塞,将装置A中溶液压入装置B中
(4)作氧化剂,将二价钴氧化成三价钴
(5)温度低于85℃,化学反应速率慢;温度高于85℃,盐酸和氨水挥发不利于产品的制备
(6)安全瓶中导管应左短、布氏漏斗下端的斜切面应正对支管
(7) ①. 2 ②.
【解析】
【分析】在装置A恒压滴液漏斗滴加盐酸与钴反应生成CCl2和氢气,反应结束后,打开活塞K,推动注射器,将装置A中反应后的溶液压入装置B,与氯化铵、浓氨水的混合液在搅拌下反应,用恒压滴液漏斗将双氧水缓慢滴入装置B的三颈烧瓶中,滴加结束后再缓慢滴加4ml/L盐酸(在通风橱内进行),在85℃水浴中加热20min,冷却至室温,抽滤,精制,得纯净产品。
【小问1详解】
根据仪器的构造可知,仪器a的名称为球形干燥管;
【小问2详解】
装置A中产生氢气,根据气压变化,当注射器活塞的位置不再发生变化,则可判断装置A中反应完全;
【小问3详解】
实现装置A和B中溶液混合的操作是打开活塞K,向里推动注射器活塞,将装置A中溶液压入装置B中;
【小问4详解】
装置A中反应产生的为二价钴,双氧水的作用为作氧化剂,将二价钴氧化成三价钴;
【小问5详解】
温度低于85℃,化学反应速率慢;温度高于85℃,盐酸和氨水挥发不利于产品的制备,故水浴温度控制在85℃;
【小问6详解】
根据观察进行抽滤的装置可知,该装置存在的问题有安全瓶中导管应左短、布氏漏斗下端的斜切面应正对支管;
【小问7详解】
,代入K和c求得,根据表格,可知离子总数为3,由电离方程式可知离子总数=1+z,故z=2,因配合物中C为+3价,所以内界Cl-有1个,又配合物中心离子配位数为6,所以配合物化学式为,因此,装置B中制备钴(Ⅲ)的配合物的总的化学方程式为。
17. 和在生产生活中均有广泛的应用,其相互转化如下:反应ⅰ:。
(1)下,向反应器中加入和发生反应ⅰ,充分反应后的平衡转化率和该反应的吉布斯自由能变(,忽略随温度的变化)随温度的变化如图所示:
①反应ⅰ的_______0(填“>”或“<”)。
②反应ⅰ可正向自发的温度条件为_______K(保留整数)。
③温度为时,反应ⅰ的压强平衡常数_______。
(2)、温度为时,将和的混合气流通过,实验发现当的体积分数在之间时可避免分解,试解释原因_______。
(3)100℃时,将、和共同置于真空刚性密闭容器中,同时发生反应ⅰ和反应ⅱ,达平衡时三种固体仍大量共存。已知:100℃时,反应ⅰ和反应ⅱ的平衡常数分别为、,平衡时体系的总压强为_______的质量_______(填“>”“<”)或“=”),此时若从容器中移走部分,重新到达平衡后,和原平衡比,的质量_______(填“增加”“减小”或“不变”)。
(4)通过电解法也可实现和的相互转化,其中一种转化的电化学装置如下图所示(A、B代表或)。
①石墨电极2是_______极(填“阳”或“阴”)。
②实现A转化为B的电极方程式为_______。
【答案】(1) ①. > ②. 大于386 ③. 1600
(2)的体积分数控制在20%~80%之间,可使,避免反应正向进行,避免分解
(3) ①. 3100 ②. > ③. 不变
(4) ①. 阴 ②.
【解析】
【小问1详解】
①由图可知,升高温度,碳酸氢钠的转化率增大,说明平衡向正反应方向移动,该反应为焓变大于0的吸热反应,故答案为:>;
②由图可得如下方程式:ΔH—300ΔS=28.8、ΔH—400ΔS=—4.6,解联立方程可得:ΔH=+129kJ/ml、ΔS=0.334kJ l/(L·K),由题意可知,反应ΔG=ΔH—TΔS<0时,反应能自发进行,则反应温度T>=≈386K,故答案为:386;
③由图可知,温度为T1时,碳酸氢钠的转化率为80%,由方程式可知,二氧化碳和水蒸气的物质的量都为1ml×80%×=0.4ml,则反应ⅰ的压强平衡常数Kp=p(CO2)p(H2O)=(×100kPa)×(×100kPa)=1600(kPa)2,故答案为:1600;
【小问2详解】
混合气体中二氧化碳体积分数为80%时,反应的浓度熵Qc= p(CO2)p(H2O)= (80%×100kPa)×(20%×100kPa)= 1600(kPa)2=Kp,则二氧化碳的体积分数在20%~80%之间时,反应的浓度熵Qc大于Kp,反应不能向正反应方向进行,碳酸氢钠不能分解,故答案为:的体积分数控制在20%~80%之间,可使,避免反应正向进行,避免分解;
【小问3详解】
由方程式可知,反应ⅰ和反应ⅱ生成二氧化碳和水蒸气的物质的量相等,则平衡体系中二氧化碳和水蒸气的平衡分压相等,由反应ⅰ的分压常数为2.5×103(kPa)2可知,二氧化碳和水蒸气的分压为=50kPa,由反应ⅱ的分压常数为7.5×106(kPa)3可知,氨气的分压为=3000kPa,则平衡时体系的总压强为3100kPa;二氧化碳和水蒸气的分压小于氨气的分压说明反应ⅱ的二氧化碳和水蒸气使反应ⅰ的平衡向逆反应方向移动,导致二氧化碳和水蒸气的分压减小、碳酸氢钠的质量增大,所以碳酸氢钠的质量大于m1g;温度不变,反应的平衡常数不变,则平衡时从容器中移走部分水蒸气,重新到达平衡后,氨气的分压依然是3000kPa,所以和原平衡比,碳酸氢铵的质量不变,故答案为:3100;>;不变;
【小问4详解】
①由图可知,石墨电极2是电解池的阴极,水在阴极得到电子发生还原反应生成氢气和氢氧根离子,故答案为:阴;
②由图可知,石墨电极1是电解池的阳极,水在阳极失去电子发生氧化反应生成氧气和氢离子,放电生成的氢离子与溶液中的碳酸根离子反应生成碳酸氢根离子,则实现A转化为B的电极方程式为,故答案为:。
18. 在“碳中和”背景下,通过化学反应将转变为高附加值的有机化学产品以及新型材料,既可以缓解温室效应,又可以实现资源的循环利用。下面是一种制备聚碳酸亚丙酯四氯苯酐(PPCPA)的合成路线:
回答下列问题:
(1)A的分子式为_______,其一氯代物有_______种。
(2)B→C的反应类型是_______,C分子中苯环所在平面上共有_______个原子。
(3)B能与乙胺()反应生成含五元环结构的化合物G和,写出化学方程式_______,G中官能团的名称为_______。
(4)满足下列条件的E的同分异构体有_______种(不考虑立体异构)。
①含苯环;1ml物质与足量钠反应可生成1ml;遇不显色;④同一个碳不连两个羟基。
(5)F名为1,2-环氧丙烷。按以上路线制备PPCPA时,参与反应的n(1,2-环氧丙烷)=_______(用含x、y、z的代数式表示);PPCPA在酸性条件下彻底水解的产物中有一种含苯环结构的分子H,写出H的结构简式并标注出分子内氢键_______。
【答案】(1) ①. ②. 2
(2) ①. 取代反应 ②. 15
(3) ①. + ②. 酰胺基
(4)4 (5) ①. ②.
【解析】
【分析】由有机物的转化关系可知,五氧化二钒做催化剂条件下与氧气共热发生氧化反应生成,则B为;催化剂作用下与氯气发生取代反应生成;与氧气发生氧化反应生成,与CH3CH=CH2发生氧化反应生成,一定条件下与二氧化碳、共热发生缩聚反应生成。
【小问1详解】
由结构简式可知,A的分子式为,分子中含有2种等效氢原子,一氯代物有2种,故答案为:;2;
【小问2详解】
由分析可知,B→C的反应为催化剂作用下与氯气发生取代反应生成和氯化氢;分子中苯环和酯基均为平面结构,则分子中苯环所在平面上共有15个原子,故答案为:取代反应;15;
【小问3详解】
由题意可知,与乙胺发生取代反应生成和水,反应的化学方程式为+,分子中含有的官能团为酰胺基,故答案为:+;酰胺基;
【小问4详解】
E的同分异构体含苯环,1ml物质与足量钠反应可生成1ml氢气,遇氯化铁溶液不显色,说明分子中含有2个醇羟基,不含有酚羟基,由同一个碳不连两个羟基可知,同分异构体的结构简式为、、、,共有4种,故答案为:4;
【小问5详解】
由高聚物结构简式可知,发生缩聚反应时,消耗yml二氧化碳的同时消耗(x+y+z)ml1,2-环氧丙烷,则两者的物质的量比为;PPCPA酸性条件下彻底水解生成的产物中含苯环结构的分子H为,分子中含有的羧基能形成如图所示的分子内氢键:,故答案为:;。A.图1可用于验证铁的吸氧腐蚀
B.图2可用于制取胶体
C.图3可用于制取乙二酸
D.图4可用于制备乙酸乙酯
选项
实验目的
实验设计或操作
A
证明溴乙烷发生了消去反应
将溴乙烷与NaOH的乙醇溶液共热,再将产生的气体通入溴的溶液中,观察溶液颜色变化
B
除去碱式滴定管尖嘴的气泡
将滴定管尖嘴垂直向下,挤压橡皮管内玻璃球将气泡排出
C
除去固体中少量的NaCl杂质
将固体溶于水配成溶液,蒸发结晶并趁热过滤
D
证明水解为吸热过程
取适量溶液于试管中,测pH,加热-段时间,再次测pH
离子总数
2
3
4
5
重庆市南开中学2023届高三下学期第九次质量检测 化学答案: 这是一份重庆市南开中学2023届高三下学期第九次质量检测 化学答案,共2页。
重庆市南开中学2023届高三下学期第九次质量检测 化学: 这是一份重庆市南开中学2023届高三下学期第九次质量检测 化学,共8页。
重庆市南开中学校2023届高三第九次质量检测(三诊)化学试题(含解析): 这是一份重庆市南开中学校2023届高三第九次质量检测(三诊)化学试题(含解析),共22页。试卷主要包含了单选题,工业流程题,实验题,原理综合题,有机推断题等内容,欢迎下载使用。












