




必练18 工艺流程和物质结构综合大题-2024年高考化学总复习高频考点必刷1000题(广东专用)
展开第一,用什么资料,怎样使用资料;第二,在那些核心考点上有所突破,准备采取什么样的措施;第三,用时多长,怎样合理分配。
二、怎样查漏。
第一,教师根据一轮复习的基本情况做出预判;第二,通过检测的方式了解学情。
三、怎样补缺。
1、指导学生针对核心考点构建本专题的知识网络;
2、针对学生在检测或考试当中出现的问题,教师要做好系统性讲评;
3、教育学生在对待错题上一定要做到:错题重做,区别对待,就地正法。
4、抓好“四练”。练基本考点,练解题技巧,练解题速度,练答题规范。
【尖子生创造营】2024年高考化学总复习高频考点必刷1000题(广东专用)
必练18 工艺流程和物质结构综合大题
1.(2023·广东高考真题)
Ni、C均是重要的战略性金属。从处理后的矿石硝酸浸取液(含Ni2+、C2+、Al3+、Mg2+)中,利用氨浸工艺可提取Ni、C,并获得高附加值化工产品。工艺流程如下:
己知:氨性溶液由NH3⋅H2O、NH42SO3和NH42CO3配制。常温下,Ni2+、C2+、C3+与NH3形成可溶于水的配离子;lgKbNH3⋅H2O= -4.7;C(OH)2易被空气氧化为C(OH)3;部分氢氧化物的Ksp如下表。
(1)活性MgO可与水反应,化学方程式为___________。
(2)常温下,pH=9.9的氨性溶液中,cNH3⋅H2O________cNH4+(填“>”“<”或“=”)。
(3)“氨浸”时,由C(OH)3转化为CNH362+的离子方程式为___________。
(4)NH42CO3会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了NH4Al(OH)2CO3的明锐衍射峰。
①NH4Al(OH)2CO3属于___________(填“晶体”或“非晶体”)。
②NH42CO3提高了Ni、C的浸取速率,其原因是___________。
(5)①“析晶”过程中通入的酸性气体A为___________。
②由CCl2可制备AlxCOy晶体,其立方晶胞如图。Al与O最小间距大于C与O最小间距,x、y为整数,则C在晶胞中的位置为___________;晶体中一个Al周围与其最近的O的个数为___________。
(6)①“结晶纯化”过程中,没有引入新物质。晶体A含6个结晶水,则所得HNO3溶液中nHNO3与nH2O的比值,理论上最高为___________。
②“热解”对于从矿石提取Ni、C工艺的意义,在于可重复利用HNO3和___________(填化学式)。
2.(2022·广东高考真题)稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
已知:月桂酸熔点为;月桂酸和均难溶于水。该工艺条件下,稀土离子保持价不变;的,开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
(1)“氧化调pH”中,化合价有变化的金属离子是_______。
(2)“过滤1”前,用溶液调pH至_______的范围内,该过程中发生反应的离子方程式为_______。
(3)“过滤2”后,滤饼中检测不到元素,滤液2中浓度为。为尽可能多地提取,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中低于_______(保留两位有效数字)。
(4)①“加热搅拌”有利于加快溶出、提高产率,其原因是_______。
②“操作X”的过程为:先_______,再固液分离。
(5)该工艺中,可再生循环利用的物质有_______(写化学式)。
(6)稀土元素钇(Y)可用于制备高活性的合金类催化剂。
①还原和熔融盐制备时,生成1ml转移_______电子。
②用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化的还原,发生的电极反应为_______。
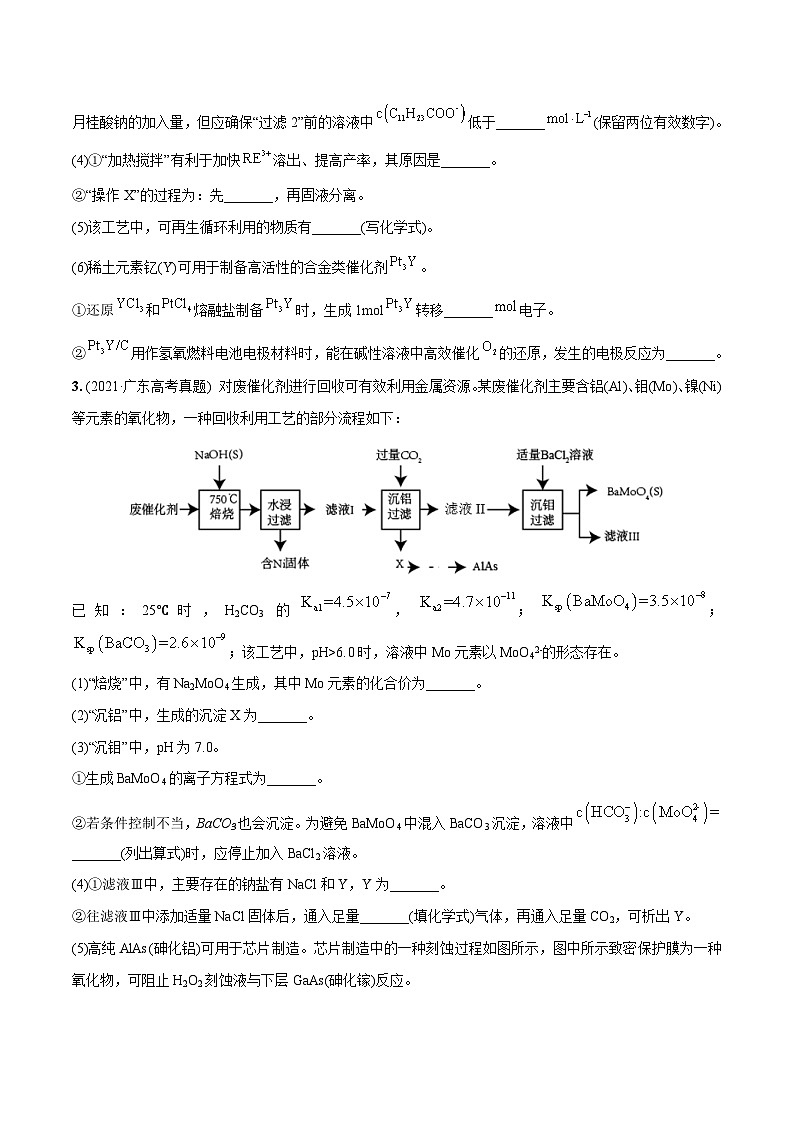
3. (2021·广东高考真题) 对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝(Al)、钼(M)、镍(Ni)等元素的氧化物,一种回收利用工艺的部分流程如下:
已知:25℃时,H2CO3的,;;;该工艺中,pH>6.0时,溶液中M元素以MO42-的形态存在。
(1)“焙烧”中,有Na2MO4生成,其中M元素的化合价为_______。
(2)“沉铝”中,生成的沉淀X为_______。
(3)“沉钼”中,pH为7.0。
①生成BaMO4的离子方程式为_______。
②若条件控制不当,BaCO3也会沉淀。为避免BaMO4中混入BaCO3沉淀,溶液中_______(列出算式)时,应停止加入BaCl2溶液。
(4)①滤液Ⅲ中,主要存在的钠盐有NaCl和Y,Y为_______。
②往滤液Ⅲ中添加适量NaCl固体后,通入足量_______(填化学式)气体,再通入足量CO2,可析出Y。
(5)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。
①该氧化物为_______。
②已知:Ga和Al同族,As和N同族。在H2O2与上层GaAs的反应中,As元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为_______。
4.(2023·大湾区二模)锂离子电池广泛应用于便携式电动设备,某锂离子电池废料含Li、Fe、C等金属及其氧化物,回收利用其废料的一种简化工艺流程如下:
已知:①Fe、C是中等活泼金属,氧化性:C3+>Fe3+;
②常温下KspCOH2=5.9×10−15,KspCOH3=1.6×10−44。
(1)写出一种提高“酸浸”浸出率的途径_______。
(2)写出“酸浸”时金属C与稀H2SO4反应的化学方程式_______;“酸浸”后溶液中的金属阳离子主要有Li+、_______。
(3)“沉铁”反应的离子方程式是_______,“沉钴”时NaClO溶液的作用是_______。
(4)已知Li2CO3是微溶于水的强电解质,其饱和水溶液的浓度与温度关系如图所示,在a点对应条件下进行“沉锂”,若“沉锂”后溶液cCO32−为0.40 ml⋅L−1,求cLi+=_______(写出计算过程,保留两位有效数字)。
(5)“沉钴”产物可用于制备CO,CO的晶胞结构如图所示,与C2+距离最近且相等的C2+有_______个;设C2+与O2−的最近的核间距为r nm,CO晶体的密度为_______g⋅cm−3(列出计算式,NA为阿伏伽德罗常数的值);该晶胞若沿体对角线投影,则O2−的投影图为_______(填字母选项)。
5.(2023·东莞市上学期期末教学质量检查)氮化钼作为锂离子电池负极材料具有很好的发展前景。从废催化剂(主要成分为MS、V2O5和Al2O3)中提取钒和钼工艺流程如下:
已知:①熔砂为对应金属元素的含氧酸盐(MO42−、VO3−等)
②AlOH4−+H+⇌AlOH3+H2O,K=1013.38;KspAlOH3=10−33
③NH4VO3的溶解度(g100g水):0.48(20℃)、1.32(40℃)、2.42(60℃)
(1)MO42−中M元素的化合价为_______,基态钒原子核外电子排布式为_______。
(2)“焙烧”中,将Na2CO3和废催化剂磨成粉末从炉顶投料,空气从炉底鼓入,目的是_______。焙烧生成的SO2、CO2气体经过_______溶液(填“NaHSO3、NaOH或NaHCO3”)处理后可用于“沉铝”工序。
(3)“沉铝”中铝元素恰好沉淀完全时滤液的pH为_______。(通常认为溶液中离子浓度不大于10−5mlL为沉淀完全)
(4)“沉钒”中,下列说法正确的是_______。
A.低温有利于析出晶体
B.增加NH4Cl的浓度能降低NH4VO3的溶解度
C.实际生产中,沉钒时间越长越好
D.温度超过50℃,溶液中逸出的氨气增多
(5)“沉钼”的离子方程式为_______。
(6)“沉钼”得到的四钼酸铵与六亚甲基四胺在一定条件下反应可制取氮化钼,晶胞如图所示。氮化钼的化学式为_______,氮原子周围距离最近的钼原子有_______个。若晶胞边长为anm,则晶体的密度为_______gcm3。
6.(2023·佛山二模)分铜液净化渣主要含铜、碲(Te)、锑(Sb)、砷(As)等元素的化合物,一种回收工艺流程如图所示:
已知:①“碱浸”时,铜、锑转化为难溶氢氧化物或氧化物,碱浸液含有Na2TeO3、Na3AsO4。
②“酸浸”时,锑元素反应生成难溶的Sb2OSO44浸渣。
回答下列问题:
(1)As位于第四周期VA族,基态As的价层电子排布式为___________。
(2)“碱浸”时,TeO2与NaOH反应的离子方程式为___________。
(3)向碱浸液加入盐酸调节pH=4,有TeO2析出,分离出TeO2的操作是___________。滤液中As元素最主要的存在形式为___________(常温下,H3AsO4的各级电离常数为:Ka1=6.3×10−3、Ka2=1.0×10−7、Ka3=3.2×10−12)。
A.H3AsO4 B.H2AsO4− C.HAsO42− D.AsO43−
(4)①Sb2OSO44中,Sb的化合价为___________。
②“氯盐酸浸”时,通入SO2的目的是___________。
(5)“水解”时,生成SbOCl的化学方程式为___________。
(6)TeO2可用作电子元件材料,熔点为733℃,其熔点远高于SO2的原因为___________。TeO2晶胞是长方体结构(如图所示),碲的配位数为___________。已知NA为阿伏加德罗常数的值,则该晶体的密度为___________g⋅cm−3(列出计算表达式)
7.(2023·广州二模)氮化镓(GaN)具有优异的光电性能。一种利用炼锌矿渣[主要含铁酸镓Ga2Fe2O43、铁酸锌ZnFe2O4、SiO2]制备GaN的工艺流程如下:
已知:
①Ga与Al同主族,化学性质相似。
②常温下,KspZnOH2=10−16.6,KspGaOH3=10−35.1,KspFeOH3=10−38.5。
③Ga3+、Fe3+在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
回答下列问题:
(1)“酸浸”时Ga2Fe2O43发生反应的离子方程式为____。“酸溶”所得滤渣的主要成分是________(填化学式)。
(2)“酸浸”所得浸出液中Ga3+、Zn2+浓度分别为0.21g⋅L−1、65g⋅L−1。常温下,为尽可能多地提取Ga3+并确保不混入ZnOH2,“调pH”时需用CaO调pH至_________(假设调pH时溶液体积不变)。
(3)“脱铁”和“反萃取”时,所用盐酸的浓度a=________,b=_______(选填上表中盐酸的浓度)。
(4)“沉镓”时,若加入NaOH的量过多,会导致Ga3+的沉淀率降低,原因是_____________(用离子方程式表示)。
(5)利用CVD(化学气相沉积)技术,将热分解得到的Ga2O3与NH3在高温下反应可制得GaN,同时生成另一种产物,该反应化学方程式为__________________。
(6)①GaN的熔点为1700℃,GaCl3的熔点为77.9℃,它们的晶体类型依次为_________、_________。
②GaN晶体的一种立方晶胞如图所示。该晶体中与Ga原子距离最近且相等的N原子个数为________。该晶体密度为ρ g⋅cm−3,GaN的式量为Mr,则晶胞边长为________nm。(列出计算式,NA为阿伏加德罗常数的值)
8.(2023·广州一模)铋的化合物在电催化和光催化领域都有广泛应用。一种从含铋矿渣(主要成分是CuBi2O4、CuO、Fe2O3、Al2O3、SiO2等)中提取高纯Bi2S3的工艺如下:
已知:
①乙酰胺(CH3CONH2)有臭味、有毒,熔点为82.3℃,沸点为221℃,可溶于水。
②常温下,KspBiOH3=4.0×10−31,BiOCl+H2O⇌Bi3++2OH−+Cl− K=1.6×10−31。
③该工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)CuBi2O4中的Cu的化合价为+2,则Bi的化合价是_______。
(2)“沉铋”时加入NaOH溶液,Bi3+转化为BiOCl沉淀的离子方程式是_______。往“沉铋”所得滤液中加入铁粉可回收其中的_______(填化学式)金属。
(3)“洗涤”时先用水洗,再用稀硫酸洗涤。用稀硫酸洗涤的目的是为了除去滤饼中的_______(填化学式)杂质。
(4)“转化”分两步进行:第一步BiOCl转化为BiOH3,反应的离子方程式为_______;第二步BiOH3受热分解,2BiOH3ΔBi2O3+3H2O。常温下,当BiOCl恰好完全转化成BiOH3时,溶液中Cl−浓度为0.04ml⋅L−1,则此时溶液的pH为_______。
(5)“合成”所得乙酰胺的水溶液经_______。(填操作)可获得乙酰胺固体,以再生硫代乙酰胺(CH3CSNH2)。
(6)钼酸铋(Bi2MO6)可用于光催化水的分解,其晶胞结构(不含氧原子)如图所示,晶胞参数为a nm,a nm,c nm,晶胞棱边夹角均为90°。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。已知原子1的坐标为12,12,0,则原子2的坐标为_______。
②设阿伏加德罗常数的值为NA,Bi2MO6的式量为Mr,Bi2MO6则晶体的密度为_______g⋅cm-3 (列计算式)。
9.(2023·惠州市下学期一模)某湿法炼锌的萃余液中含有Na+、Zn2+、Fe2+、Mn2+及二价钴离子(C2+)、镍离子(Ni2+)、镉离子(Cd2+)和H2SO4等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图:
已知:
(1)“氧化、调pH”时,先加入适量的石灰石调节pH为1.0,加入适量的Na2S2O8,再加入石灰石pH为4.0,
①“沉渣”的主要成分除MnO2外还有_______。
②若加入过量的Na2S2O8,钴元素会被氧化进入“沉渣”中,则溶液中残留C3+的浓度为____ml⋅L−1。
(2)“沉锌”时,在近中性条件下加入Na2CO3可得碱式碳酸锌ZnCO3⋅2ZnOH2⋅H2O固体,同时产生大量的气体,试分析产生大量气体的原因是_____________________________。
(3)由碱式碳酸锌生成氧化锌的化学方程式为______________________________。
(4)沉锌后的滤液经过一系列操作后得到的副产品为________________________(填化学式)。
(5)ZnO的晶胞结构如图,则锌的配位数为___________;已知晶胞参数为acm,该晶体的密度为___________g⋅cm−3(写出计算式,阿佛加德罗常数的值为NA)。
10.(2023·江门一模)(氧化铬(Cr2O3)可用作着色剂、分析试剂、催化剂等。以含铬废料(含FeCr2O4、MgO、SiO2、Al2O3等)为原料制备氧化铬的一种流程如图所示。
已知:烧渣的成分为Na2CrO4、NaAlO2、Na2SiO3、Fe2O3、MgO;25℃时,Ksp[Fe(OH)3]=4×10-38、Ksp[Al(OH)3]=1×l0-33、Ksp[Mg(OH)2]=2×10-11,溶液中离子浓度≤10-5ml·L-1时,认为该离子沉淀完全。回答下列问题:
(1)“研磨”的目的是_________;“焙烧”过程发生的氧化还原反应中,氧化剂与还原剂的物质的量之比是_________。
(2)25℃时,若滤液l中金属离子的浓度均为0.2ml·L-1,则“调pH”的最小值为_________。(保留两位有效数字)。
(3)“除镁”工序不能在陶瓷容器中进行的原因是_________。
(4)“转化”时加入适量H2SO4的作用是_________。
(5)“煅烧”反应生成的气体中含有一种单质,该反应的化学方程式_________。
(6)已知MgO具有NaCl型晶体结构,其结构如图所示。
则每个Mg2+周围距离最近的Mg2+个数为_________。已知MgO晶胞边长为0.4nm,则MgO的密度为_________g/cm3(设NA为阿伏加德罗常数的值,只需列出算式)。
11.(2023·揭阳上学期期末)石油重整是重要的化工过程,其中会大量使用镍钼氧化物催化剂,催化剂报废以后含有多种重金属,属于危险废物。为了保护环境,工业上可采用如图工艺流程回收镍和钼:
已知:废催化剂中主要含有MO3、NiO、Fe2O3、Al2O3、SiO2,其中只有NiO与Fe2O3在高温时不与Na2CO3反应。回答下列问题:
(1)基态Ni原子的简化电子排布式为_____________。
(2)一种NiO晶体的立方晶胞结构(a=b=c,α=β=γ=90°)如图甲所示,已知最近且相邻的Ni原子间距为m纳米,则该晶体的密度为________g·cm−3。
(3)焙烧时,废催化剂与Na2CO3反应形成一系列新的可溶性钠盐,最主要目的是________;其中MO3与Na2CO3焙烧时的反应方程式是________________________。
(4)在焙烧、浸出的过程中,科研人员研究了焙烧时间与浸出液中钼的浸出比例,关系如图乙所示:
在烘焙时间超过1 h以后,钼的浸出比例反而下降,可能的原因是________________。
(5)在制备NiCO3的过程中,假设硫酸酸化浸出渣以后,溶液里面的金属阳离子浓度都为0.01 ml/L,加入NaOH时,pH应控制在_______。
部分氢氧化物沉淀的pH
(6)废催化剂回收利用前,测得其中Ni的质量分数为ω%,假设使用a g废催化剂最终可以得到b g NiCO3固体,则工艺流程中Ni的回收利用率是______(列出表达式即可)。
12.(2023·茂名二模)电镀废水中含有Cr2O72−、Ni2+、Cu2+等离子,工业上利用分级沉淀法处理电镀废水回收利用铜和镍金属化合物,其工艺流程如下:
已知:①KspCuS=6.3×10−36、KspNiS=3.2×10−19、Ka1H2S=1.3×10−7、Ka2H2S=7.0×10−15
②各离子开始沉淀和完全沉淀的pH如下表所示
回答下列问题:
(1)基态铬原子的核外电子排布式为___________。
(2)还原过程常加入适量的稀硫酸,写出“还原”时Cr2O72−与H2C2O4发生的离子反应方程式___________。还原得到的金属阳离子对应的硫酸盐可用作自行车钢圈的电镀液,电镀时自行车钢圈和惰性电极作为两电极,则“钢圈”连接电源的___________极,阳极的电极反应式为___________。
(3)“还原”后,第一次“调节pH”的范围为___________,滤渣1的主要成分是___________。
(4)“沉铜”需将Cu2+浓度降为10−6ml/L,已知H2S溶液浓度超过0.1ml/L会逸出,通过计算分析“沉铜”时是否会产生H2S逸出___________(写出计算过程)。
(5)利用回收的物质可制备某含铜的硫化物,该物质可用作分析试剂,其晶胞如图,晶胞参数α=β=γ=90°,则离Cu原子距离最近且相等的S原子有___________个,若阿伏加德罗常数的值为NA,晶胞边长为a pm,则该晶胞的密度为___________g/cm3(用含a、NA的代数式表示)。
13.(2023·梅州二模)铈(Ce)是人类发现的第二种稀土元素,铈的氧化物在半导体材料、高级颜料及汽车尾气的净化器方面有广泛应用。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的工艺流程如下:
已知:①铈的常见化合价为+3、+4。四价铈不易进入溶液,而三价铈易进入溶液
②Ce4+能与SO42−结合成CeSO42+,Ce4+能被萃取剂(HA)2萃取。
(1)焙烧后铈元素转化成CeO2和CeF4,焙烧氟碳铈矿的目的是_________。
(2)“酸浸II”过程中CeO2转化为Ce3+,且产生黄绿色气体,用稀硫酸和H2O2替换HCl就不会造成环境污染。则稀硫酸、H2O2与CeO2反应的离子方程式为______________。
(3)“操作I”的名称是_________。
(4)“浸出液”中含有少量Ce4+及其他稀土元素的离子,可以通过“萃取”与“反萃取”作进一步分离、富集各离子。“萃取”时Ce4+与萃取剂(HA)2存在反应:Ce4++n(HA)2⇌ CeH2n−4A2n+4H+。用D表示Ce4+分别在有机层中与水层中存在形式的浓度之比:D=cCeH2n−4A2ncCeSO42+,其他条件不变,在浸出液中加入不同量的Na2SO4,以改变水层中的cSO42−,D随浸出液中cSO42−增大而减小的原因是__________。
(5)取5.000g上述流程中得到的Ce(OH)4,加酸溶解后,向其中加入含0.03300mlFeSO4的硫酸亚铁溶液使Ce4+全部被还原成Ce3+,再用0.1000ml⋅L−1的酸性KMnO4标准溶液滴定至终点时,消耗20.00mL标准溶液。则Ce(OH)4的质量分数为_________(已知氧化性:Ce4+>KMnO4;Ce(OH)4的相对分子质量为208)。
(6)科研人员提出CeO2催化CO2合成碳酸二甲酯(DMC),从而实现CO2的综合利用。CeO2晶胞结构如图所示。
①在该晶体中,铈离子的配位数为_________。
②阿伏加德罗常数的值为NA,CeO2相对分子质量为M,晶体密度为ρg⋅cm−3,其晶胞边长的计量表达式为a=__________nm。
14.(2023·梅州一模)磷酸亚铁锂(LiFePO4)是新能源汽车中锂离子电池常用的电极材料。对LiFePO4废旧电极(含LiFePO4、Al箔、石墨粉等)回收并获得高纯Li2CO3的工艺流程如下:
已知:Li2CO3在水中的溶解度不大,且溶解度随温度升高而减小。
(1)回收的废旧锂离子电池需进行预放电、拆分破碎、热处理等预处理,筛分后获得正极片。下列分析不合理的是___________(填标号)。
A.拆分前对废旧电池进行预放电,有利于释放残余能量,消除安全隐患
B.预放电时电池中的锂离子移向正极,有利于提高正极片中锂元素的回收率
C.热处理过程可以除去废旧锂离子电池中的难溶有机物、碳粉等
D.锂离子电池不含汞、镉、铅等有毒重金属,可用普通垃圾处理方法处理
(2)过程Ⅰ为粉碎处理,为加快过程Ⅱ的反应速率,还可以采用的措施有___________(写出其中一种即可),过程Ⅱ中足量NaOH溶液的作用是___________(用离子方程式表示)。
(3)过程Ⅲ采用不同氧化剂分别进行实验,均采用Li含量为3.7%的原料,控制pH为3.5,浸取1.5h后,实验结果如下表所示:
实验2中,NaClO3可与盐酸反应生成黄绿色气体,大大增加了酸和氧化剂的用量。综合考虑Li+的浸出率及环保因素,选择的氧化剂最好为___________。
(4)过程Ⅵ首先需洗涤“粗品”,应该用___________(填“热水”或“冷水”)洗。若滤液2中cLi+=4.0 ml⋅L−1,过程Ⅴ中加入等体积的Na2CO3溶液后,若沉淀中的Li元素占滤液中Li元素总量的95.0%,则加入的碳酸钠溶液浓度为___________ml⋅L−1[已知:KspLi2CO3=1.6×10−3,溶液混合引起的体积变化可忽略]。
(5)工业上用FeCl3、NH4H2PO4、LiCl及苯胺()为原料制取磷酸亚铁锂。LiFePO4中,PO43−的空间结构为___________。LiCl和FeCl3均为金属氯化物,LiCl沸点1350℃,FeCl3沸点315℃,两者沸点差异明显的主要原因是___________。
(6)某锂电池的负极材料晶体是锂原子嵌入石墨烯层间,晶胞结构(底面为平行四边形)如图所示。该晶体的化学式为___________,该晶体中最近的两个碳原子核间距离为142pm,石墨烯层间距离为335pm,则该晶体的密度为___________g⋅cm−3(列出计算式,用NA表示阿伏加德罗常数)。
15.(2023·汕尾模拟)钒钛磁铁矿炼铁后产生大量的含钛高炉渣(主要成分为 TiO2、Al2O3、CaO、SiO2等)。一种“高温碳化-低温选择性氯化”制备 TiCl4工艺如下:
(1)Ti 的价电子排布式为_______。
(2)“研磨混合”的目的是_______。
(3)“高温碳化”的反应温度约为 900℃,碳化后的固体中含有 TiC、硅铁合金(FexSiy)、3CaO·Al2O3。
①碳化过程中生成 TiC 的化学方程式为_______。
②FexSiy 是一种软磁材料,其晶胞结果如图,该晶胞中 Si 所处的位置为晶胞的棱心和_______;该材料的化学式为_______。
(4)将固体加入 NaOH-Na2CO3混合溶液中进行“碱浸”,此过程中 3CaO·Al2O3发生反应的离子方程式为_______。
(5)几种氯化物的物理性质见下表。
①“氯化”时反应温度约为 400℃,而气态氯化物中几乎不含 FeCl3和 SiCl4,可能原因是_______。
②“操作 I”为_______。
(6)为了降低成本,“母液”需循环至“碱浸”步骤中重复利用,则“气体 I”的最佳选择为_______(填化学式)。
16.(2023·韶关二模)铟(In)是制备酞菁铟、磷化铟等半导体的重要基础材料,广泛应用于军工、航天航空、平面显示、光电信息、太阳能电池等领域。从铅锌冶炼烟灰(主要含In2O3、In2S3、ZnO、PbO、Fe2O3)中提取金属铟的流程如图:
已知:氧化酸浸后铟以In3+的形式存在。“萃取”过程中的萃取剂可用H2A2表示,其在酸性溶液中可萃取三价金属离子。
回答下列问题:
(1)“氧化酸浸”过程中In2S3的硫元素被氧化为SO42−,则氧化剂与还原剂的物质的量之比为___________,滤渣除含过量MnO2外,还有___________(填化学式)。
(2)一个配体中有两个配位原子的配体叫双齿配体,C2O42−就是一种双齿配体。“净化”时加入H2C2O4的主要作用是络合Fe3+,Fe3+的配位数是6,则“净化”时的离子方程式是___________。
(3)萃取过程的反应方程式为:In3++3H2A2⇌InHA23+3H+,平衡常数为K。一定温度下萃取率(E%)与cH+的关系如下:lgE%1−E%=lgK−lgc3H+c3H2A2。当pH=2.30时,萃取率为50%;若将萃取率提升到95%,应调节溶液的pH=___________[已知lg19=1.28。忽略萃取剂浓度cH2A2在萃取过程中随pH的变化。结果保留小数点后两位]。
(4)锌可以从___________中进行回收(填字母)。
a.滤渣 b.水相 c.有机相 d.滤液
(5)酞菁铟是有机分子酞菁与铟原子形成的复杂分子,结构简式如图所示,该分子中不存在的化学键为___________(填字母)。
a.σ键 b.π键 c.离子键 d.配位键
(6)磷化铟的晶胞结构如图所示,晶胞参数为a nm,In的配位数为___________;与In原子间距离为22a nm的In原子有___________个。
17.(2023·深圳一模)铋及其化合物广泛应用于电子材料、医药等领域。一种以含铋烧渣(主要成分为Bi2O3、MnSO4,还含有少量MnS、Fe2O3、CuO及SiO2等)制取Bi2O3并回收锰的工艺流程如下:
已知:①氧化性:Cu2+>Bi3+;
②Bi3+易水解成BiOCl沉淀;常温下,BiOCl存在的pH范围约为2.0~11.0;
③常温下,KspFeOH2=4.9×10−17;lg7=0.85。
回答下列问题:
(1)基态锰原子的价电子排布式为__________。
(2)“水浸提锰”时,另加入少量稀硫酸可促进__________(填化学式)溶解,进一步提高锰的浸取率。
(3)“滤渣2”的主要成分有__________(填化学式)、Bi。
(4)常温下,“含Fe2+滤液”中Fe2+的浓度为0.01ml⋅L−1。为保证BiOCl产品的纯度,理论上,“沉铋”时应控制溶液的pH<______(保留一位小数)。
(5)“脱氯”过程中发生主要反应的离子方程式为__________。
(6)BiOCl是一种性能优良的光催化剂,可催化降解有机污染物对硝基苯酚()等。对硝基苯酚的熔点高于邻硝基苯酚()的熔点,其原因是__________。
(7)我国科学家在新型二维半导体芯片材料——硒氧化铋的研究中取得突破性进展。硒氧化铋的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞参数为a pm,a pm,b pm。
①该晶胞沿z轴方向的投影图为______(填标号)。
A.B.C.D.
②该晶体中,每个O2−周围紧邻的Bi3+共有______个。
③该晶体的密度为______g⋅cm−3(列出计算式,NA为阿伏加德罗常数的值)。
18.(2023·深圳二模)金属铑(Rh)是一种高效催化剂,在有机合成中发挥重要作用。一种以高铜铑精矿(主要含Rh,还含有少量的Cu、Fe等杂质)为原料提取的工艺如下:
已知:阳离子交换过程可表示为xRH(s)+Mx+(aq)⇌RxM(s)+xH+(aq)
回答下列问题:
(1)基态Cu原子的价电子排布式为_______。
(2)“氯化溶解”后,Rh元素以RhCl63−的形式存在,其中Rh元素的化合价为_______。
(3)“定向脱铜”时,铜与铑的沉淀率随pH变化如下图所示,该过程需将溶液pH调至2,结合图像说明原因_______。
(4)“阳离子交换”过程中,溶液中被阳离子交换树脂吸附的金属阳离子主要有_______。
(5)“水解”过程中,RhCl63−发生反应的离子方程式为_______。
(6)铑锰催化剂可催化反应:CO2+4H2=CH4+2H2O。下列有关该反应的说法正确的是_______(填标号)。
A.存在极性共价键的断裂与形成
B.所有分子均为非极性分子
C.含碳化合物中心原子杂化轨道类型有sp与sp3
D.H2O的VSEPR模型为V形
E.催化剂可降低该反应的焓变,从而增大反应速率
(7)铑掺杂SrTiO3形成的催化剂,在光催化CO2还原反应中有很高的催化效率。SrTiO3的晶胞结构如图所示。
①其中Sr2+位于晶胞的体心,则Ti4+所处的位置为晶胞的_______(填“顶角”或“棱心”);每个Ti4+周围紧邻的O2−共有_______个。
②当有1%的Ti4+被Rh3+替代后,晶体中会失去部分O2−产生缺陷,此时平均每个晶胞所含O2−数目为_______(保留三位小数)。
19.(2023·湛江一模)镍钴锰酸锂材料是近年来开发的一类新型锂离子电池正极材料,具有容量高、循环稳定性好、成本适中等优点,这类材料可以同时有效克服钴酸锂材料成本过高、磷酸铁锂容量低等问题,工业上可由废旧的钴酸锂、磷酸铁锂、镍酸锂、锰酸锂电池正极材料(还含有铝箔、炭黑、有机黏合剂等),经过一系列工艺流程制备镍钴锰酸锂材料,该材料可用于三元锂电池的制备,实现电池的回收再利用,工艺流程如下图所示:
已知:①粉碎灼烧后主要成分是Li2O、NiO、C2O3、MnO、Fe2O3、Al2O3;
②萃取剂对Fe3+选择性很高,且生成的物质很稳定,有机相中的Fe3+很难被反萃取
请回答下列问题:
(1)正极材料在“灼烧”前先粉碎的目的是___________。
(2)“碱浸”的目的是___________,涉及的化学方程式是___________。
(3)“酸浸”时加入H2O2的作用是___________。
(4)上述工艺流程中采用萃取法净化除去了Fe3+,若采用沉淀法除去铁元素,结合下表,最佳的pH范围是___________。
(5)镍钴锰酸锂材料中根据镍钴锰的比例不同,可有不同的结构,其中一种底面为正六边形结构的晶胞如图所示。
①该物质的化学式为___________,写出基态Mn原子价层电子的轨道表示式___________。
②已知晶胞底面边长是anm,高是bnm,一个晶胞的质量为Mg,计算该晶胞的密度ρ=___________g/cm3(用计算式表示)。
氢氧化物
C(OH)2
C(OH)3
Ni(OH)2
Al(OH)3
Mg(OH)2
Ksp
5.9×10-15
1.6×10-44
5.5×10-16
1.3×10-33
5.6×10-12
离子
开始沉淀时的pH
8.8
1.5
3.6
6.2~7.4
沉淀完全时的pH
/
3.2
4.7
/
盐酸浓度/ml⋅L−1
反萃取率/%
Ga3+
Fe3+
2
86.9
9.4
4
69.1
52.1
6
17.5
71.3
离子
Fe3+
Al3+
Cu2+
开始沉淀的pH
1.5
3.6
4.5
沉淀完全的pH
3.2
4.7
6.7
沉淀物
FeOH3
FeOH2
COH2
COH3
CdOH2
XnOH2
KSP
2.6×10−39
4.9×10−17
5.9×10−15
1.6×10−44
7.2×10−15
6.7×10−17
氢氧化物
开始沉淀时的pH
沉淀完全时的pH(残留离子浓度小于10−5ml/L)
沉淀开始溶解时的pH
沉淀完全溶解时的pH
初始浓度[Mn+]
1 ml/L
0.01 ml/L
FeOH3
1.5
2.3
4.1
14
AlOH3
3.3
4.0
5.2
7.8
10.8
NiOH2
6.7
7.7
9.5
Cu2+
Ni2+
Cr3+
开始沉淀
6.18
8.15
4.73
完全沉淀
7.13
9.67
5.95
序号
酸
氧化剂
浸出液Li+浓度(g/L)
滤渣中Li含量/%
实验1
HCl
H2O2
9.02
0.10
实验2
HCl
NaClO3
9.05
0.08
实验3
HCl
O2
7.05
0.93
物质
FeCl3
SiCl4
TiCl4
熔点/C
306
-70
-25
沸点℃
316
57.6
135
Fe3+
Al3+
Fe2+
C2+
Ni2+
Mn2+
开始沉淀时pH
1.5
3.4
6.3
6.6
6.7
7.8
完全沉淀时pH
3.5
4.7
8.3
9.2
9.5
10.4
必练20 有机化学基础和物质结构综合大题-2024年高考化学总复习高频考点必刷1000题(广东专用): 这是一份必练20 有机化学基础和物质结构综合大题-2024年高考化学总复习高频考点必刷1000题(广东专用),文件包含必练20有机化学基础和物质结构综合大题-高频考点2024年高考化学总复习高频考点必刷1000题广东专用原卷版docx、必练20有机化学基础和物质结构综合大题-高频考点2024年高考化学总复习高频考点必刷1000题广东专用解析版docx等2份试卷配套教学资源,其中试卷共75页, 欢迎下载使用。
必练19 化学反应原理综合大题-2024年高考化学总复习高频考点必刷1000题(广东专用): 这是一份必练19 化学反应原理综合大题-2024年高考化学总复习高频考点必刷1000题(广东专用),文件包含必练19化学反应原理综合大题-高频考点2024年高考化学总复习高频考点必刷1000题广东专用原卷版docx、必练19化学反应原理综合大题-高频考点2024年高考化学总复习高频考点必刷1000题广东专用解析版docx等2份试卷配套教学资源,其中试卷共90页, 欢迎下载使用。
必练17 化学实验综合大题-【高频考点】2024年高考化学总复习高频考点必刷1000题(广东专用): 这是一份必练17 化学实验综合大题-【高频考点】2024年高考化学总复习高频考点必刷1000题(广东专用),文件包含必练17化学实验综合大题-高频考点2024年高考化学总复习高频考点必刷1000题广东专用原卷版docx、必练17化学实验综合大题-高频考点2024年高考化学总复习高频考点必刷1000题广东专用解析版docx等2份试卷配套教学资源,其中试卷共104页, 欢迎下载使用。












