

仁爱版九年级 下册单元2 金属的性质当堂检测题
展开一、选择题(共20分)
1.(本题2分)下列说法正确的是
A.K2MnO4、KMnO4、MnO2三者中Mn元素的化合价逐渐升高
B.金、银、铜金属活动性顺序逐渐减弱
C.NH4NO3、NaCl、CaO三者溶于水后,所得溶液的温度逐渐降低
D.NaOH、NaCl、H2SO4三者溶液的pH逐渐变小
2.(本题2分)除去下列物质中混有的少量杂质(括号内为杂质),所用方法错误的是( )
A.FeCl3溶液(CuCl2溶液):加铁粉
B.CO(CO2):通过足量澄清的石灰水
C.N2(O2):通过灼热的铜网
D.Cu粉(Fe): 加稀硫酸
3.(本题2分)某化学兴趣小组,为了探究Ag、Zn、Cu三种金属活动性顺序,设计了下图所示的4种实验方案,请你判断其中不能达到目的的是
A.B.
C.D.
4.(本题2分)下列实验方案不能达到实验目的的是
A.AB.BC.CD.D
5.(本题2分)下列除杂质(括号内为杂质)的方法错误的是
A.Cu(Fe)用磁铁吸引
B.CaO(CaCO3)加入适量水、过滤
C.FeCl2溶液(CuCl2)加入适量铁粉、过滤
D.KNO3溶液(NaCl)冷却热KNO3的饱和溶液、过滤
6.(本题2分)下列物质中的一种能与其它三种物质都发生反应的是
A.铁B.稀硫酸C.碳酸钠D.氢氧化钠
7.(本题2分)向含有AgNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应后过滤。向滤出的固体中滴加稀盐酸,没有气体生成。下列结论正确的是( )
A.滤出的固体中一定含有AgB.滤出的固体一定是Ag和Cu的混合物
C.滤液中一定有Zn(NO3)2和 Cu(NO3)2D.滤液中一定没有AgNO3和Cu(NO3)2
8.(本题2分)将一定质量的锌粉加入到含硝酸银和硝酸铜的混合溶液中,充分反应。反应过程中固体质量与加入锌粉的质量关系如下图所示。下列说法正确的是
A.d点溶液为蓝色
B.a点固体为Zn、Cu、Ag
C.b点溶液中的溶质有两种
D.c点固体中加入稀盐酸有气泡产生
9.(本题2分)在给定条件下,下列选项所示的物质间转化均能实现的是
A.
B.
C.
D.
10.(本题2分)如图四个图像不能正确反映对应变化关系的是
A.向一定质量硝酸铜和硝酸银的混合溶液中逐渐加入锌粉
B.把NaOH和NH4NO3固体分别溶于水中
C.分别向等质量镁和铁中,逐渐加入溶质质量分数相同的稀硫酸至过量
D.加热一定质量氯酸钾和二氧化锰的固体混合物
二、判断题(共10分)
11.(本题2分)用Ag、Fe和CuSO4溶液可设计实验证明三种金属活动性顺序( )
12.(本题2分)铜的导热性良好,可制做铜火锅( )
13.(本题2分)铁桶不能盛放波尔多液,因为铁能和氢氧化铜发生反应( )
14.(本题2分)铜与硝酸银溶液反应得到银,故铜比银活泼( )
15.(本题2分)镁与足量稀盐酸反应放热,有气泡产生,固体消失( )
三、综合应用题(共30分)
16.(本题10分)化学改变世界,科技改变生活。
(1)我国自主设计建造的港珠澳大桥是目前世界最长的跨海大桥,制造大桥护栏、桥面和桥墩等重要器件的材料都是钢,钢属于 (选填“纯金属”或“合金”)。
(2)我国对石墨烯技术的研究居世界领先地位。石墨烯性能优良,用途独特,可用作太阳能电池的电极,这主要是利用了它的 性。
(3)我国自主研发的复兴号动车组列车,领跑世界,其制造材料有铝合金等。铝制品在空气中有很好的抗腐蚀性能,是因为铝的表面生成了一层致密的氧化铝薄膜,该反应的化学方程式为 。
(4)氢气作为理想能源前景广阔。我国在氢能汽车研发领域取得重大突破,采用了第四代以氢为燃料的电池技术。氢气在空气中燃烧的化学方程式为 ;完全燃烧32g氢气,需要氧气的质量为 g。
17.(本题10分)室温下,足量镁片、铁片(已打磨)分别与50g溶质质量分数为7.3%的稀盐酸反应,用数据采集器测得装置内压强随时间的变化关系图(如下图所示)。
已知:相同温度下,装置内压强与产生气体的体积成正比。
(1)根据图乙可知,金属与酸反应是属于放热反应,曲线BC段下降的原因是 。
(2)计算镁片与稀盐酸反应产生氢气的质量(写出计算过程)。
(3)t4时,消耗铝片的质量为 。
(4)室温下足量的稀盐酸与等质量的如下金属充分反应,生成氢气质量最多的是_______。
A.镁B.铁C.铝D.锌
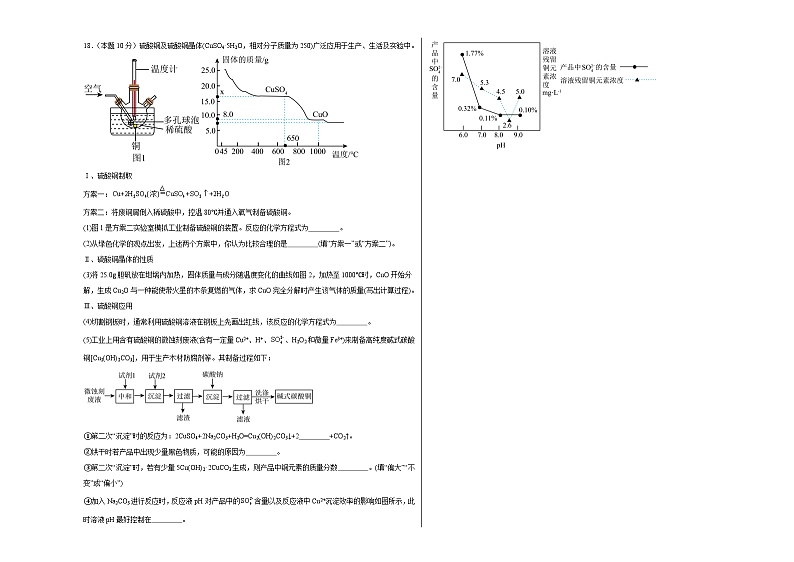
18.(本题10分)硫酸铜及硫酸铜晶体(CuSO4·5H2O,相对分子质量为250)广泛应用于生产、生活及实验中。
Ⅰ、硫酸铜制取
方案一:
方案二:将废铜屑倒入稀硫酸中,控温80℃并通入氧气制备硫酸铜。
(1)图1是方案二实验室模拟工业制备硫酸铜的装置。反应的化学方程式为 。
(2)从绿色化学的观点出发,上述两个方案中,你认为比较合理的是 (填“方案一”或“方案二”)。
Ⅱ、硫酸铜晶体的性质
(3)将25.0g胆矾放在坩埚内加热,固体质量与成分随温度变化的曲线如图2,加热至1000℃时,CuO开始分解,生成Cu2O与一种能使带火星的木条复燃的气体,求CuO完全分解时产生该气体的质量(写出计算过程)。
Ⅲ、硫酸铜应用
(4)切割钢板时,通常利用硫酸铜溶液在钢板上先画出红线,该反应的化学方程式为 。
(5)工业上用含有硫酸铜的微蚀刻废液(含有一定量Cu2+、H+、、H2O2和微量Fe3+)来制备高纯度碱式碳酸铜[Cu2(OH)2CO3],用于生产木材防腐剂等。其制备过程如下:
①第二次“沉淀”时的反应为:2CuSO4+2Na2CO3+H2O=Cu2(OH)2CO3↓+2 +CO2↑。
②烘干时若产品中出现少量黑色物质,可能的原因为 。
③第二次“沉淀”时,若有少量5Cu(OH)2·2CuCO3生成,则产品中铜元素的质量分数 。(填“偏大”“不变”或“偏小”)
④加入Na2CO3进行反应时,反应液pH对产品中的含量以及反应液中Cu2+沉淀效率的影响如图所示,此时溶液pH最好控制在 。
题号
一
二
三
总分
得分
选项
实验目的
实验方案
A
除去硫酸锌溶液中混有的少量硫酸铜
往溶液中加入足量的锌粉,过滤
B
检验氧气
将带火星的木条伸入集气瓶中,看是否复燃
C
鉴别氢气和氮气
闻气体气味,根据气体气味判断
D
鉴别二氧化碳和一氧化碳
点燃,看是否能燃烧
参考答案:
1.D
【详解】A、根据化学式中各元素化合价代数和为零原则和常见元素的化合价,可计算出K2MnO4、KMnO4、MnO2三者中Mn元素的化合价分别为+6价、+7价、+4价,故A错误;
B、根据金属活动性顺序表可知,金、银、铜金属活动性顺序逐渐增强,故B错误;
C、NH4NO3溶于水时吸热,使得溶液温度降低;NaCl溶于水时温度基本不发生变化;CaO和水反应剧烈放热,使得溶液温度升高。则三者溶于水后,所得溶液的温度逐渐升高,故C错误;
D、氢氧化钠溶液呈碱性,pH>7;氯化钠溶液呈中性,pH=7;硫酸溶液呈酸性,pH<7.故三者的溶液pH逐渐变小,故D正确;
故选D。
2.A
【详解】A、铁与氯化铜反应生成氯化亚铁和铜,铁与氯化铁反应生成氯化亚铁,混合溶液中加铁粉会将主要物质除去,生成新的杂质,故A错误;
B、二氧化碳与氢氧化钙反应生成碳酸钙和水,一氧化碳不能与澄清石灰水反应,混合气体通过足量澄清的石灰水,能除去杂质,且不引入新的杂质,故B正确;
C、 氧气与铜加热时生成氧化铜,氮气的化学性质较稳定加热时不能与铜反应,混合气体通过灼热的铜网能除去杂质,且不引入新的杂质,故C正确;
D、在金属活动顺序中,铁排在氢之前,铜排在氢之后,铁能与稀硫酸反应生成可溶性的氯化亚铁和氢气,铜不能与稀硫酸反应,混合物加稀硫酸能除去杂质,且不引入新的杂质,故D正确。故选A。
【点睛】除杂(提纯),是指除去杂质,同时被提纯物质不得改变。加入试剂除杂时至少要满足两个条件:①加入的试剂只能与杂质反应,不能与主要物质反应;②反应后不能引入新的杂质。
3.D
【详解】A项,锌可以置换出硫酸铜中的铜而银不能,故正确;B项,使铜分别与硫酸锌溶液和硝酸银溶液反应,铜不能置换出锌但可以置换出银,故正确;C项,利用稀盐酸可以验证锌比铜活泼,使铜与硝酸银溶液反应可以验证铜比银活泼,故正确;D项,把硝酸银溶液分别加入到盛有锌和铜的试管中,锌和铜表面都有金属银析出,证明锌和铜都比银活泼,但该方案无法验证锌和铜哪一种更活泼.
4.C
【详解】A.足量的锌粉能与硫酸铜溶液反应生成硫酸锌溶液和铜,再过滤,能除去杂质且没有引入新的杂质,选项A正确;
B.因为氧气能使带火星的木条复燃,所以将带火星的木条伸入集气瓶中,看是否复燃,能检验是否是氧气,选项B正确;
C.氢气和氮气均为没有气味的气体,用闻气体气味的方法不能鉴别,选项C错误;
D.一氧化碳具有可燃性能燃烧,而二氧化碳不能燃烧,因此用点燃看是否能燃烧的方法可以鉴别,选项D正确。
故选C。
5.B
【详解】A、铁具有磁性而铜不具有磁性,正确;
B、氧化钙与水发生反应,主要物质被除去,碳酸钙不溶于水,错误;
C、铁将氯化铜中的铜置换出来,同时生成氯化亚铁,过滤除去铜,正确;
D、硝酸钾的溶解度受温度影响变化较大,而氯化钠溶解度受温度影响变化较小,冷却结晶得到硝酸钾晶体,能除去氯化钠,正确;
故选B。
6.B
【分析】根据金属的化学性质、酸的化学性质、碱的化学性质、盐的化学性质进行分析判断。
【详解】A、铁与硫酸发生置换反应生成硫酸亚铁和氢气,与碳酸钠、氢氧化钠不发生反应,故选项错误;
B、稀硫酸和铁发生置换反应生成硫酸亚铁和氢气,和碳酸钠反应发生复分解反应生成硫酸钠、水和二氧化碳;和氢氧化钠发生中和反应生成硫酸钠和水;能与其它三种物质都发生反应,故选项正确;
C、碳酸钠只能与稀硫酸反应生成硫酸钠、水和二氧化碳,与铁、氢氧化钠不反应,故选项错误;
D、氢氧化钠只能和硫酸发生中和反应,和铁、碳酸钠不反应,故选项错误;
故选B。
【点睛】熟练掌握酸、金属、碱、盐的化学性质是正确解答本题的关键。
7.A
【分析】金属活动性:Zn>Cu>Ag,向含有硝酸银、硝酸铜的混合溶液中加入一定量的锌粉,锌先与硝酸银反应生成硝酸锌和银,待硝酸银完全反应后,锌与硝酸铜反应生成硝酸锌和铜,充分反应后过滤。向滤出的固体中滴加稀盐酸,没有气体生成,说明锌已经完全反应。
【详解】A、锌与银的金属活动性差异大,先反应,故滤出的固体中一定含有Ag,正确;
B、锌可能恰好与硝酸银完全反应,或置换了部分硝酸银,故滤出的固体可能只含银,错误;
C、锌可能恰好与硝酸铜完全反应,此时滤液中只含硝酸锌,锌可能置换了部分硝酸银,此时滤液中含硝酸银、硝酸铜、硝酸锌,锌也可能恰好与硝酸银完全反应,此时滤液中含硝酸锌、硝酸铜,错误;
D、由C的分析可知,滤液中可能含硝酸银和硝酸铜,错误。
故选A。
8.C
【分析】锌、银、铜的活动性顺序是:锌>铜>银;锌粉加入到含硝酸银和硝酸铜的混合溶液中,锌先与溶液中硝酸银反应完全后,再与硝酸铜反应;反应过程中析出固体质量是纵坐标,加入锌粉的质量是横坐标;锌和硝酸银反应固体质量增加,锌与硝酸铜反应固体质量减少;所以0b段是锌和硝酸银反应,bc段是锌与硝酸铜反应,cd段是锌粉过量。
【详解】A、 d点是锌粉过量,已经把硝酸银和硝酸铜两者反应完全,溶液中没有了硫酸铜,溶液不为蓝色,不符合题意;
B、a点是锌与硝酸银反应了一部分,所以a点固体只有Ag,不符合题意;
C、b点是锌和硝酸银恰好完全反应,锌与硝酸银反应生成银和硝酸锌,硝酸铜还没反应,所以b点溶液中的溶质是硝酸锌、硝酸铜两种,符合题意;
D、c点是锌与硝酸铜完全反应,析出固体是Ag、Cu,Ag和Cu在金属活动性顺序表中氢的后面,不与稀盐酸反应,不符合题意。故选C。
【点睛】金属和混合盐溶液的反应:1、金属活动性顺序表中,金属间相距越远,就最先反应;2、加入锌粉的量是引起滤渣和滤液成分的关键变量;3、对比金属的相对原子质量,以便知道固体质量是增加还是减少。
9.A
【详解】A、水电解生成氢气和氧气,氧气与铝反应生成氧化铝,转化均能实现;
B、氢气与氧气在点燃条件下反应生成水,反应条件为点燃,水与氧化钙反应生成氢氧化钙,第一步不能实现;
C、碳酸钠与氢氧化钙反应是碳酸钙沉淀和氢氧化钠,氢氧化钠与三氧化硫反应生成硫酸钠,第二步不能实现;
D、铜与稀硫酸不能反应,第一步不能实现;
故选:A。
10.A
【详解】A、向一定质量硝酸铜和硝酸银的混合溶液中逐渐加入锌粉,锌会先于硝酸银反应生成硝酸锌和银,硝酸银完全反应后再与硝酸铜反应生成硝酸锌和铜,根据反应的质量关系是;,可以判断反应后生成银和铜,先是生成银再生成铜,银的相对原子质量大于铜,所以前段曲线上升速率快,后一段上升速率变慢,曲线趋势一致都是上升,如图所示,选项错误;
B、把氢氧化钠和硝酸铵固体分别溶于水中,氢氧化钠溶于水会使水温升高,硝酸铵溶于水会使水温降低,一段时间后均恢复至室温,如图所示,选项正确;
C、分别向等质量镁和铁中,逐渐加入溶质质量分数相同的稀硫酸至过量,如图横坐标是所加酸的质量,根据反应相同质量的酸会生成相等质量的氢气,故反应前曲线起点为0,随之反应发生,氢气质量增加且相重合,但等质量的镁和铁比较;,可以判断最终等质量的镁比等质量的铁生成氢气质量大,则镁的曲线更高,如图所示,选项正确;
D、加热一定质量氯酸钾和二氧化锰的固体混合物,反应前固体中氯元素质量分数不为0,则起点在纵坐标上,随之反应生成发生,氯酸钾分解出氯化钾和氧气,则固体质量减少,而固体中氯元素质量不变,则氯元素在固体中的质量分数变大,最终氯酸钾完全反应后,固体质量不再减少则氯元素质量分数不再增大,平行于横坐标,如图所示,选项正确;
故选:A。
11.正确
【详解】铁和硫酸铜发生反应生成硫酸亚铁和铜,但是银不和硫酸铜反应,故可证明金属活动性顺序为:铁>铜>银,正确。
12.正确
【详解】铜的导热性好,升温快,火焰温度相同时,铜锅的温度会比较高,所以可制做铜火锅,题干说法正确。
13.错误
【详解】铁桶不能盛放波尔多液,因为铁能和波尔多液中硫酸铜发生反应生成铜和硫酸亚铁,错误。
14.正确
【详解】位置在前的金属能将位于其后的金属从其盐溶液中置换出来,铜与硝酸银溶液反应得到银,说明铜比银活泼,故说法正确。
15.正确
【详解】镁是一种金属活动性比较活泼的金属,能够与足量稀盐酸反应放热,有气泡产生,最终固体消失,叙述正确,故填正确。
16. 合金 导电 4Al + 3O2=2Al2O3 2H2 + O22H2O 256
【详解】(1)钢是铁的合金,属于合金。
(2)石墨烯性能优良,用途独特,可用作太阳能电池的电极,这主要是利用了它的导电性。
(3)铝制品在空气中有很好的抗腐蚀性能,是因为铝与氧气在表面生成了一层致密的氧化铝薄膜,该反应的化学方程式为:4Al + 3O2=2Al2O3。
(4)氢气在空气中燃烧生成水,反应的化学方程式为2H2 + O22H2O;
设:完全燃烧32g氢气,需要氧气的质量为x。
解得:x=256g,即需要氧气的质量为256g。
17.(1)热量散失
(2)设反应产生氢气的质量为x,
x=0.1g,
答:反应产生氢气的质量为0.1g。
(3)0.9g
(4)C
【详解】(1)金属与酸反应放热,温度升高,压强增大,随着时间的推移,热量散失,压强减小;
(2)见答案;
(3)t4时刻,镁、铝与盐酸充分反应产生的氢气质量相等,由题(2)可知产生氢气的质量均为0.1g;设消耗铝的质量为y,
y=0.9g;
(4)镁的相对原子质量为24,根据化学方程式Mg + 2HCl = MgCl2 + H2↑可知,24g镁可反应生成2g氢气,即1g镁生成g氢气;
铁的相对原子质量56,根据化学方程式Fe + 2HCl = FeCl2 + H2↑ 可知,56g铁可反应生成2g氢气,即1g铁生成g氢气;
铝的相对原子质量为27,根据化学方程式2Al + 6HCl = 2AlCl3 + 3H2↑ 可知,27g铝可反应生成3g氢气,即1g铝生成g氢气;
锌的相对原子质量为65,根据化学方程式Zn + 2HCl = ZnCl2 + H2↑可知,65g锌可反应生成2g氢气,即1g锌生成g氢气;
因为>>>,所以铝放出的氢气最多;
故选C。
18.(1)
(2)方案二
(3)解:能使带火星的木条复燃的气体为氧气,设若CuO完全分解时产生氧气的质量是x
答:若CuO完全分解时产生该气体的质量是0.8g。
(4)Fe+CuSO4=FeSO4+Cu
(5) Na2SO4 烘干温度高,部分碱式碳酸铜受热分解生成氧化铜 偏大 8.5左右
【详解】(1)80℃时,铜、氧气、稀硫酸反应生成硫酸铜和水,该反应的化学方程式为:2Cu+O2+2H2SO42CuSO4+2H2O,故填:2Cu+O2+2H2SO42CuSO4+2H2O;
(2)方案二比较合理,因为方案二中没有二氧化硫生成,比较环保,故填:方案二;
(3)见答案;
(4)铁与硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为Fe+CuSO4=Cu+FeSO4,故填:Fe+CuSO4=Cu+FeSO4;
(5)①根据质量守恒定律,反应前后原子的种类、数目不变,反应前Cu、S、O、Na、C、H的原子个数分别为2、2、15、4、2、2,反应后Cu、S、O、Na、C、H原子个数分别为2、0、7、0、2、2,还缺少2个硫原子、8个氧原子和4个钠原子,则横线上物质的化学式为Na2SO4,故填:Na2SO4;
②烘干时产品中出现少量黑色物质,可能的原因为烘干温度高,部分碱式碳酸铜受热分解生成氧化铜,故填:烘干温度高,部分碱式碳酸铜受热分解生成氧化铜;
③1个碱式碳酸铜分子中有2个铜原子,而1个3Cu(OH)2•2CuCO3分子中有5个铜原子,所以“沉淀”时若有少量5Cu(OH)2•2CuCO3生成,所以产品中铜元素的质量分数偏大,故填:偏大;
④由图可知,溶液pH为8.5左右时,硫酸根离子含量最低,溶液中铜离子沉淀效率最高,因此第二次沉淀时溶液pH最好控制在8.5左右,故填:8.5左右。
初中化学仁爱版九年级 下册单元2 金属的性质课后复习题: 这是一份初中化学仁爱版九年级 下册<a href="/hx/tb_c4041162_t7/?tag_id=28" target="_blank">单元2 金属的性质课后复习题</a>,共14页。试卷主要包含了选择题,判断题,综合应用题等内容,欢迎下载使用。
仁爱版九年级 下册单元2 金属的性质随堂练习题: 这是一份仁爱版九年级 下册<a href="/hx/tb_c4041162_t7/?tag_id=28" target="_blank">单元2 金属的性质随堂练习题</a>,共13页。试卷主要包含了选择题,判断题,综合应用题等内容,欢迎下载使用。
初中化学单元2 金属的性质课堂检测: 这是一份初中化学<a href="/hx/tb_c4041162_t7/?tag_id=28" target="_blank">单元2 金属的性质课堂检测</a>,共13页。试卷主要包含了选择题,判断题,综合应用题等内容,欢迎下载使用。













