



高教版(2021)化学通用类第二节 常见金属单质及其化合物备课课件ppt
展开主题四 常见无机物及其应用 4.2.1 金属单质
1.了解钠、铝、铁等常见金属单质及其重要化合物的主要性质,学会从物质通性和核心元素价态两个角度研究物质性质的一般方法,深化“结构决定性质”的学科观念。2.知道Fe3+的检验方法,并运用学过的知识设计合理的实验方案、开展实验探究。学会利用焰色反应鉴别金属元素及其离子的方法。3.了解金属单质及其化合物在生产、生活中的广泛应用,能列举出日常生活中常用的铝、铁制品,能针对常见金属回收利用等热点问题开展调研并提出合理建议。
观察元素周期表中金属与非金属元素分布图,有哪些发现?
金属元素占据元素周期表大约五分之四的比例
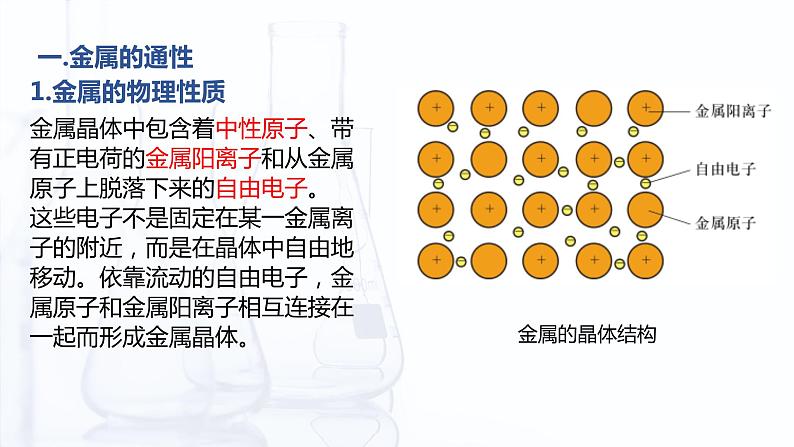
金属晶体中包含着中性原子、带有正电荷的金属阳离子和从金属原子上脱落下来的自由电子。这些电子不是固定在某一金属离子的附近,而是在晶体中自由地移动。依靠流动的自由电子,金属原子和金属阳离子相互连接在一起而形成金属晶体。
(1)金属的颜色和光泽大多数金属呈银白色,少数金属呈其他颜色。例如,金呈黄色,铜呈紫红色。(2)金属的延展性金属具有不同程度的延展性,可以抽成细丝也可以压成薄片,例如,最细的白金丝直径不到0.2 μm;最薄的金箔,厚度只有0.1 μm 。(3)金属的导电性和导热性大多数金属具有良好的导电性和导热性,导电性好的金属通常导热性也好,常见的几种金属按照导电和导热能力由大到小排列如下: 银、铜、金、铝、锌、铁、铂、锡、铅
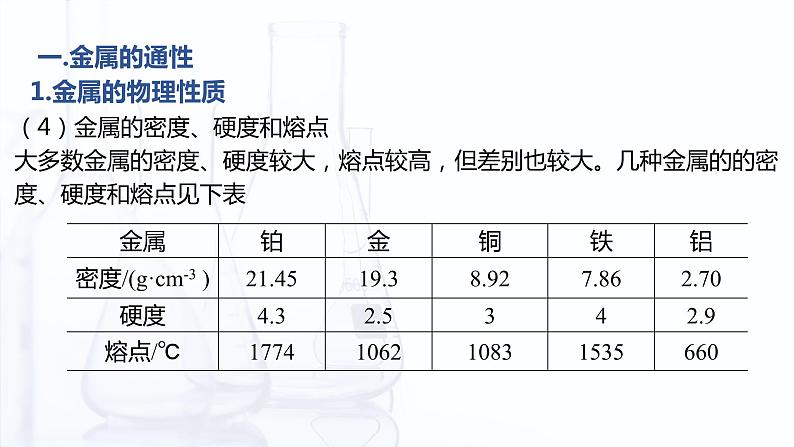
(4)金属的密度、硬度和熔点大多数金属的密度、硬度较大,熔点较高,但差别也较大。几种金属的的密度、硬度和熔点见下表
黑色金属和有色金属:黑色金属通常是指铁、铬 、锰及其合金,主要是铁碳合金;有色金属是指除去铁、铬、锰之外的所有金属重金属和轻金属:密度小于4.5 g/cm3 的叫轻金属(如钾、钠、钙、镁等);密度大于4.5 g/cm3 的叫重金属(如锌、铅、镍等)常见金属和稀有金属:常见金属如铝、铁、铜等。自然界存在量较少的金属叫稀有金属(如锆、铌、钼等)
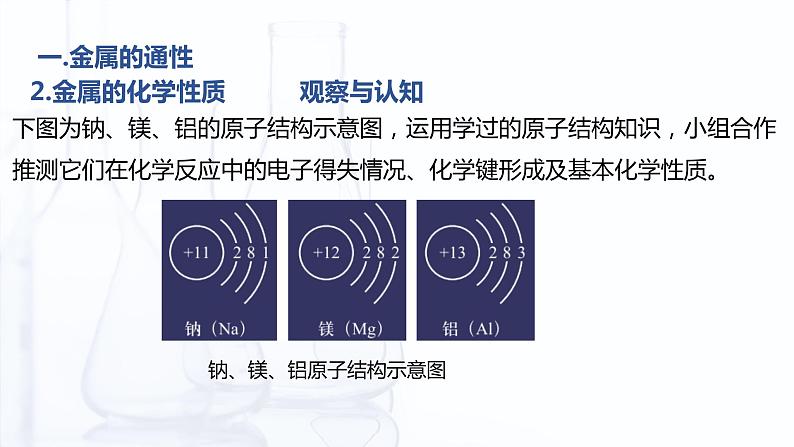
2.金属的化学性质 观察与认知
下图为钠、镁、铝的原子结构示意图,运用学过的原子结构知识,小组合作推测它们在化学反应中的电子得失情况、化学键形成及基本化学性质。
金属原子失去电子形成阳离子的性质称为金属性。多数金属元素在发生化学反应时,较容易失去电子。金属最主要的共同化学性质是都易失去电子变成金属阳离子而表现出还原性。
金属活动性由强到弱的顺序为:K Ca Na Mg Al Mn Zn Cr Fe C Ni Sn Pb(H) Cu Hg Ag Pt Au
由于金属失去电子的难易程度不同,因而其还原性的强弱也不相同,化学活动性因此会有较大差别
二.碱金属元素的代表——钠
观察下图所示钠的取用和保存方法,结合金属单质的通性,小组讨论并总结钠的物理性质。
钠是电和热的良导体,熔、沸点低,质地软,是具有银白色光泽的轻金属
结合钠元素的原子结构示意图,从核外电子排布的角度出发,预测钠单质的化学性质,并小组合作完成实验,验证钠的化学性质。
钠原子在反应中易失去1个电子,具有还原性
实验探究1:钠与氧气的反应
操作1:取一小块金属钠,用滤纸吸干表面的煤油,用小刀切去一端的表层,观察表面的颜色;将其放置在空气中,观察表面颜色的变化。
新切开的金属钠呈光亮的银白色,在空气中放置后表面会迅速变暗,反应方程式为:
4Na+O2 == 2Na2O
实验发现:新切开的金属钠在空气中放置,可发生如下变化:①光亮的银白色表面变暗→②变为液滴→③变为白色固体→④最后变为白色粉末。你能用化学方程式解释这些现象吗?
操作2:将一小块金属钠放在石棉网上加热,观察现象。
钠熔化成银白色小球、并迅速燃烧、火焰呈黄色,最后生成淡黄色固体,反应方程式为:
操作3:向盛有水的烧杯中滴加几滴酚酞试液,然后投入一小块(约绿豆粒般大小)金属钠,观察实验现象。
钠熔化成银白色小球、并浮在水面上迅速游动,同时发出嘶嘶的响声,溶液变为红色,反应方程式为:
2Na + 2H2O == 2NaOH + H2↑
将一小粒钠投入硫酸铜溶液中,是否会置换出铜?以此为导引,小组讨论总结金属钠与酸、碱、盐的水溶液反应的规律。
金属钠先与溶剂水反应生成NaOH,NaOH再与CuSO4反应生成Cu(OH)2蓝色沉淀。
黄光射程远,透雾能力强
Na、K合金为液体且导热性能好
你知道潜水艇和海底深潜运动呼吸面具中O2 的来源吗?试查阅相关资料写出反应方程式。
三.地壳中含量最多的金属元素——铝
铝在地壳中的含量仅次于氧和硅,是地壳中含量最多的金属元素。
结合图片,以小组为单位,列举出生活中常见的铝制品,讨论铝制品广泛使用的原因,总结铝的物理性质。
铝是银白色的轻金属,密度为2.7 g/cm3,熔点为660 ℃。延展性好,可以抽成细丝,也可压成薄片成为铝箔,用来包装胶卷、糖果等。铝的导电、导热性强,在工业上常用铝代替钢作导线、热交换器和散热材料等。铝有一定的耐腐蚀能力,且在粉末状态仍能保持原有的金属光泽,因而可用铝粉与某些油漆混合制成银白色的防锈油漆。铝还可以跟许多元素形成合金。因铝合金质轻而坚韧,它们在汽车、飞机、火箭等制造业以及日常生活中具有广泛的用途。
画出铝的原子结构示意图,并结合金属单质的通性,预测铝单质的化学性质。
铝原子的最外电子层上有3 个电子,在化学反应中很容易失去而形成+3 价的阳离子,因此,铝具有较强的还原性。
实验探究1:铝与氧的反应
操作1:取一小片铝箔,用砂纸磨去表面的氧化膜,观察表面的颜色;在酒精灯点燃该铝箔,观察现象。
磨去表面氧化膜的铝箔呈现银白色金属光泽,点燃时剧烈燃烧,发出耀眼的白光,且铝箔熔化,失去光泽,熔化的铝不滴落。
铝表面的氧化膜致密而坚固,具有抗腐蚀能力,且熔点很高,点燃时包在铝的外面,使液态铝不滴落。
实验探究2:铝与金属氧化物的反应
观看铝热反应视频,记录现象,写出对应的反应方程式。
铝和某些金属氧化物反应时,剧烈放热。放出的热量,能够把还原出来的金属熔化。
通常把用铝从金属氧化物中置换金属的方法称为铝热法。工业上常用铝热法冶炼难熔的金属、焊接钢轨等。
实验探究3:铝与酸和碱的反应
操作2:在2 支试管中分别加入5 mL 2 ml/L HCl 溶液、2 ml/L NaOH 溶液,再分别放入一小片铝片,观察现象;片刻后,将燃着的火柴分别放在2 支试管口,观察现象。
试管中产生气泡,铝片逐渐溶解,点燃的火柴置于试管口时发出爆鸣声
铝既能与酸反应,又能与碱作用,即Al具有两性性质。
思考:在生活中应当如何正确使用铝制品?
铝被誉为“带翼的金属”。作为世界上最大的铝生产国和消费国,我国的航空航天、船舶航母、动车组列车、机械制造以及日常生活等诸多领域中都有铝及其合金的身影。请以小组为单位,调查铝等常见金属回收利用的情况,并根据调研结果,以“资源循环利用的重要性”为主题,制作一期展板,在学校内进行宣传。
四.使用最多的基础金属材料——铁
结合图片,以小组为单位,列举出生活中常见的铁制品,讨论铁制品广泛使用的原因,总结铁的物理性质。
纯铁是具有银白色金属光泽的金属,密度为7.86 g/cm3,熔点l 535 ℃。铁有良好的导电性、导热性和延展性。铁能被磁铁吸引,具有铁磁性,是制造发电机和电动机必不可少的材料。
画出铁元素原子的原子结构示意图,指出它在元素周期表中的位置,并结合金属的通性,预测铁单质的化学性质。
铁在元素周期表中位于第四周期Ⅷ族,在化学反应中不仅容易失去最外电子层上的2 个电子形成+2 价的阳离子,还容易再失去次外电子层上的1个电子而形成+3 价的阳离子,因此,铁具有较强的还原性。
注意:铁与水反应是有条件的,即铁不与冷、热水反应,铁只能在高温下与水蒸气反应。
1.铝在人体内积累会使人慢性中毒。铝在下列使用场合中,应加以控制的是A.制造电缆B.制防锈油漆C.制饮料罐D.炼铝厂制造铝锭【答案】C
2.纯净铁的物理性质有①光亮的银白色 ②黑色 ③在潮湿的空气中易被腐蚀 ④有延展性 ⑤能导电导热 ⑥硬而脆 ⑦能被磁铁吸引,易被磁化A.①③④⑤⑦B.①④⑤⑦C.①③⑤⑦D.全部【答案】B
3.少量钠应保存在A.水中B.密闭容器中C.四氯化碳中D.煤油中【答案】D
4.下列有关金属的描述正确的是A.根据金属与酸反应置换出氢的难易程度,可比较金属的活泼性B.含金属元素的离子一定都是阳离子C.金属都是银白色、都有金属光泽、能导电、导热、有延展性D.常温下所有的金属都是固态【答案】A
5.金属单质四兄弟W、X、Y、Z不小心掉入稀盐酸池中,表现如下图所示,由此可知它们的活动性由强到弱的是 A.W>X>Y>ZB.Z>Y>X>WC.Z>X>W>YD.Z>Y>W>X【答案】C
高教版(2021)化学通用类第一节 糖类精品ppt课件: 这是一份高教版(2021)化学通用类<a href="/hx/tb_c4034938_t3/?tag_id=26" target="_blank">第一节 糖类精品ppt课件</a>,共31页。PPT课件主要包含了学习目标,情境与问题,一糖类的组成和分类,观察与认知,葡萄糖的结构,葡萄糖的性质,产生砖红色沉淀,实践活动,拓展延伸,重要的双糖等内容,欢迎下载使用。
中职化学高教版(2021)化学通用类第二节 烃优质ppt课件: 这是一份中职化学高教版(2021)化学通用类<a href="/hx/tb_c4034934_t3/?tag_id=26" target="_blank">第二节 烃优质ppt课件</a>,共59页。PPT课件主要包含了情境与问题,拓展延伸,甲烷的性质,甲烷的用途,二烷烃,观察与认知,烷烃的命名,烷烃的命名例题,乙烯的性质,乙烯的用途等内容,欢迎下载使用。
化学化学通用类第三节 化学平衡完美版ppt课件: 这是一份化学化学通用类<a href="/hx/tb_c4034919_t3/?tag_id=26" target="_blank">第三节 化学平衡完美版ppt课件</a>,共40页。PPT课件主要包含了观察与认知,实验与探究,化学反应,二化学平衡,可逆反应,化学平衡,化学平衡的移动,跟踪检测,作业布置等内容,欢迎下载使用。












