





中职化学主题一 原子结构与化学键第二节 元素周期律获奖ppt课件
展开主题一 原子结构与化学键 1.1 原子结构
1.认识元素性质呈周期性变化的规律及其变化的根本原因;2.了解元素周期表的结构和元素在元素周期表中的位置。3.了解同周期和同主族元素性质的递变规律,认识元素周期律(表)在学习元素、化合物及科学研究中的重要作用。
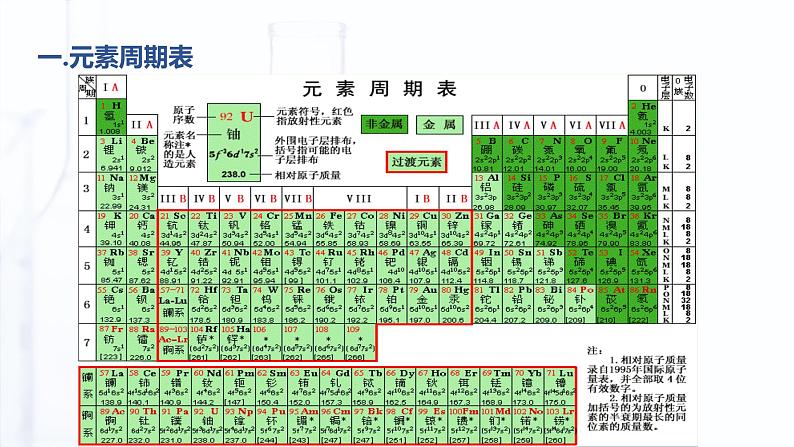
2019年,恰逢国际纯粹与应用化学联合会(IUPAC)成立100周年,也是门捷列夫发现元素周期律150周年,联合国教科文组织将这一年命名为"化学元素周期表国际年"。为了庆祝这场化学盛事,一张别具特色的元素周期表——"青年化学家元素周期表"应运而生。
原子序数与元素的原子结构之间存在什么关系?
原子序数=质子数=核电荷数=核外电子数
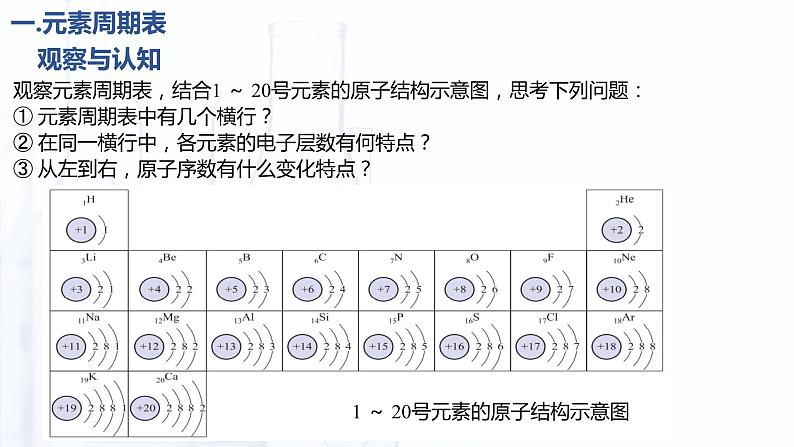
观察元素周期表,结合1 ~ 20号元素的原子结构示意图,思考下列问题:① 元素周期表中有几个横行?② 在同一横行中,各元素的电子层数有何特点?③ 从左到右,原子序数有什么变化特点?
③ 从左到右,原子序数依次递增。
① 元素周期表中有七个横行——周期。
② 在同一横行中,各元素的电子层数相同。
1、2、3周期为短周期4、5、6、7周期为长周期。
元素的周期序数 = 元素原子的电子层数
观察元素周期表,结合1 ~ 20号元素的原子结构示意图,思考下列问题:①元素周期表中有几个纵行?②在同一纵行中,最外层的电子数有何特点?③由上而下,电子层数有什么变化特点?
元素周期表中共有 18 个纵列,16 个族。分为主族(记作A族)、副族(记作B族)、Ⅷ族(包括第8、9、10三个纵列)和0族(稀有气体元素)。
①元素周期表中有18个纵行——族。
②在同一纵行中,最外层电子数相同。
③由上而下,电子层数依次递增。
1.周期:元素周期表共有七个横行,每一横行称为一个周期, 故元素周期表共有七个周期①周期序数与电子层数的关系:周期序数=核外电子层数 ②周期的分类 元素周期表中,我们把1、2、3周期称为短周期, 4、5、6、7 周期称为长周期。③周期数=核外电子层数 ; 各周期元素从左向右都是原子序数依次递增;
2.族:元素周期表共有18个纵行,除了8、9、10三个纵行称为Ⅷ外,其余的每一个纵行称为一个族,故元素周期表共有16个族。①族的分类 元素周期表中,我们把18个纵行共分为16个族,其中7个主族,7个副族,一个VIII族,一个0族。a.主族:由短周期元素和长周期元素共同构成的族,用A表示:ⅠA、 IIA 、 IIIA 、 IVA 、 VA 、 VIA 、VIIA b.副族:完全由长周期元素构成的族,用B表示:ⅠB、 IIB 、 IIIB 、 IVB 、 VB 、 VIB 、VIIB c.第Ⅷ族:8、9、10 三个纵行 d.零族:第18 纵行,即稀有气体元素
②主族序数与最外层电子数的关系: 主族序数=最外层电子数 各主族元素从上向下都是原子序数依次增大; ③族的别称ⅠA(除H外)称为碱金属元素 ⅡA称为碱土金属元素 ⅣA称为碳族元素 ⅤA称为氮族元素 ⅥA称为氧族元素 ⅦA称为卤族元素 副族和第Ⅷ族全部是金属元素;又称为过渡金属元素
根据原子核外的电子层数及最外层的电子数,可以确定元素在元素周期表中的位置。
Ca原子四个电子层,因此在第四周期;最外层电子数为 2,因此属于ⅡA族。
分析表1-2-1(1),思考并讨论以下问题:① 从表中你可以获取那些信息?② 在同一周期,从左到右,元素的原子半径呈现什么变化?③ 在同一主族,由上而下,元素的原子半径呈现什么变化?
随着元素原子序数的递增,元素的原子半径呈现周期性变化。
①通过比较同一周期元素原子的半径,可以看出电子层数相同的原子,最外层电子数目越多,原子半径越小。
②通过比较同一主族元素原子的半径,可以看出最外层电子排布相同的原子,电子层数越多,原子半径越大。
分析表1-2-1(2),思考并讨论以下问题:①从表中你可以获取那些信息?②在同一周期,从左到右,元素的原子主要化合价呈现什么变化?
① 元素的主要化合价有最高正化合价和最低负化合价。② 从各元素主要化合价的数据来看,从3Li到9F,再从11Na到17Cl,元素的最高正化合价均从+1价依次递变到+7价(氧、氟例外),非金属元素的最低负化合价均从-4价依次递变到-1价。
①最高正化合价 = 原子最外层电子数 = 主族的族序数
②最低负化合价 = 原子最外层电子数- 8
分析表1-2-1(3),思考并讨论以下问题:①从表中你可以获取那些信息?②在同一周期,从左到右,元素的金属性和非金属性呈现什么变化?
从元素主要化学性质的数据来看,从3Li到9F,再从11Na到17Cl,随着原子序数的递增,元素的金属性逐渐减弱,非金属性逐渐增强。
三.元素周期表中元素性质的递变规律
钠、镁、铝的性质比较:
硅、磷、硫、氯的性质比较
同一周期元素从左到右,随着原子序数的递增,原子半径减小,原子核对电子的吸引力增大,得到电子的能力增强,则元素的金属性逐渐减弱,非金属性逐渐增强。
同一周期金属元素的最高价氧化物的水化物的碱性逐渐减弱;同一周期非金属元素的最高价氧化物的水化物的酸性逐渐增强。
同周期中主族元素性质的递变规律
观察表1-2-6列出的碱金属(第ⅠA)元素的性质,思考并讨论:(1)从表中可以获取哪些信息?(2)对于同一主族的金属元素,随着原子序数的递增,金属性有何变化?
表1-2-6 碱金属元素性质的比较
同主族元素性质的递变规律
阶梯线左下方均为金属元素
阶梯线右上方均为非金属元素
阶梯线附近为既表现出某些金属性又表现出某些非金属性的两性元素
1.下列元素中,不属于碱金属元素的是A.锂B.铝C.钠D.钾【答案】B
2.下列排列顺序不正确的是A.还原性:F->Cl->Br-B.酸性:HClO4>H2SO4>H2SiO3C.热稳定性:HF>HCl>PH3D.碱性:KOH>Ca(OH)2>Mg(OH)2【答案】A
3.下列关于元素周期表的说法错误的是A.第四周期ⅡA族与ⅢA族元素的原子序数相差11B.第三、第四周期同主族元素的原子序数可能相差8或18C.所含元素种类最多的族为ⅢB族D.过渡元素位于金属元素与非金属元素分界线附近【答案】D
4.短周期主族元素W、X、Y、Z、R的原子半径与最外层电子数之间的关系如图所示。下列判断正确的是 A.R元素的最高正价为 价B.由W、Y组成的最简单化合物能使酸性高锰酸钾褪色C.R和Z的简单氢化物的沸点: D.由X和Z组成的化合物既能和强酸反应又能和强碱反应【答案】C
5.X、Y、Z、W均为短周期元素,在元素周期表中的位置如图所示,若X原子最外层有5个电子,则下列叙述中合理的是A.W的单质可以从H2Z溶液中置换出ZB.W与Z的氧化物对应的水化物的酸性强弱:W>ZC.Y在形成的氢化物中的化合价一定为-2价D.四种元素的原子半径由小到大的顺序为r(X)
P21,实践活动思考与应用1、2
高教版(2021)化学通用类第二节 化学反应速率优秀ppt课件: 这是一份高教版(2021)化学通用类<a href="/hx/tb_c4034918_t3/?tag_id=26" target="_blank">第二节 化学反应速率优秀ppt课件</a>,共28页。PPT课件主要包含了情境与问题,一化学反应速率,观察与认知,实验与探究,拓展延伸,跟踪检测,作业布置等内容,欢迎下载使用。
中职化学高教版(2021)化学通用类第一节 氧化还原反应获奖ppt课件: 这是一份中职化学高教版(2021)化学通用类<a href="/hx/tb_c4034917_t3/?tag_id=26" target="_blank">第一节 氧化还原反应获奖ppt课件</a>,共29页。PPT课件主要包含了学习目标,情境与问题,一氧化还原反应,观察与认知,化合价升高,化合价降低,二氧化剂和还原剂,记忆口诀,交流与讨论,跟踪检测等内容,欢迎下载使用。
高教版(2021)化学通用类第三节 化学键完美版课件ppt: 这是一份高教版(2021)化学通用类<a href="/hx/tb_c4034914_t3/?tag_id=26" target="_blank">第三节 化学键完美版课件ppt</a>,共35页。PPT课件主要包含了学习目标,情境与问题,一离子键,观察与认知,达到8电子稳定结构,离子键的形成,离子化合物,活泼的金属元素,活泼的非金属元素,概念要点等内容,欢迎下载使用。












