




人教版 (2019)选择性必修1第二节 电解池课文配套课件ppt
展开1.了解电解原理在工业生产中的应用。2.认识电解在实现物质转化和储存能量中的具体应用。
1.通过对氯碱工业、电镀、电解精炼铜、电冶金等原理的分析,培养变化观念与平衡思想。2.建立电解应用问题的分析思维模型,培养证据推理与模型认知的能力。
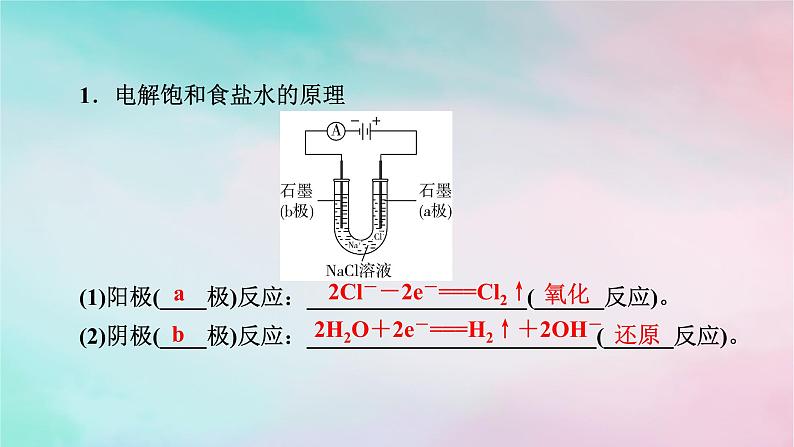
烧碱、氯气都是重要的化工原料,习惯上把电解饱和食盐水的工业生产叫做__________。
1.电解饱和食盐水的原理
(1)阳极(____极)反应:___________________(______反应)。(2)阴极(____极)反应:_________________________(______反应)。
2Cl--2e-===Cl2↑
2H2O+2e-===H2↑+2OH-
(3)总反应:化学方程式:______________________________________;离子方程式:______________________________________。
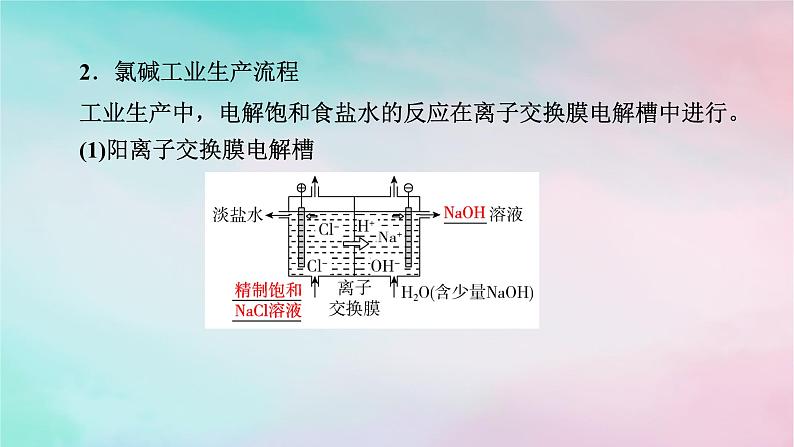
2.氯碱工业生产流程工业生产中,电解饱和食盐水的反应在离子交换膜电解槽中进行。(1)阳离子交换膜电解槽
(2)阳离子交换膜的作用:只允许Na+等阳离子通过,不允许Cl-、OH-等阴离子及气体分子通过,可以防止阴极产生的______与阳极产生的______混合发生爆炸,也能避免______与阴极产生的__________反应而影响氢氧化钠的产量。
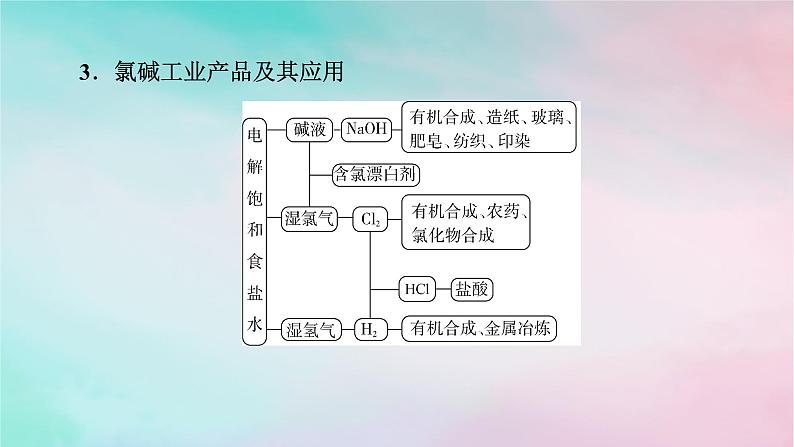
3.氯碱工业产品及其应用
正|误|判|断(1)电解饱和食盐水时,阴极发生氧化反应:2Cl--2e-===Cl2↑。( )(2)氯碱工业电解槽中滴入酚酞溶液,变红色的区域为阳极区。( )(3)电解饱和食盐水时,阳极和阴极都可以选择金属材料(如铁)。( )(4)电解饱和NaCl溶液可以制取金属钠。( )
深|度|思|考“84”消毒液是环境消毒液之一。某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置。c、d都为石墨电极。完成下列填空:
(1)a为电源的____(填“正”“负”“阴”或“阳”,下同)极,c为电解池的____极。(2)d电极的电极反应式:________________________________,电解产生消毒液的总化学方程式为_______________________________。
2H2O+2e-===H2↑+2OH-
应|用|体|验1.关于用惰性电极电解NaCl水溶液,下列叙述正确的是( )A.若在阴极附近的溶液中滴入石蕊试液,溶液呈无色B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色C.电解时在阳极得到氯气,在阴极得到金属钠D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
2.高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示,回答下列问题:
(1)若离子交换膜为阴离子交换膜,则OH-自____(填“左”或“右”,下同)向____移动。(2)电解一段时间后,撤去离子交换膜,混合后的溶液与原溶液比较,pH______(填“增大”或“减小”)。
归纳总结:离子交换膜是“具有选择透过性能的网状立体结构的高分子功能膜或分离膜”,常运用于膜电解和电渗析等离子交换膜法技术中。它具有选择透过性、分离效率高、能耗低、污染少等特点,在水处理、环保、化工、冶金等领域都有广泛应用。离子交换膜的种类有阳离子交换膜、阴离子交换膜、质子交换膜等。离子交换膜的作用:①隔离某些物质,防止阴极与阳极产物之间或产物与电解质溶液发生反应;②用于制备某些物质:通过离子定向移动使得阴极区或阳极区得到所制备的新物质;③对物质进行分离、提纯等。
二、电镀 电冶金1.电镀(1)电镀:利用______原理在某些金属表面镀上一薄层其他______或______的加工工艺。(2)目的:使金属增强抗腐蚀能力,增加表面硬度和美观。
(3)电镀池的构成(在铁制钥匙上面镀铜)
阳极材料:镀层金属______,电极反应:___________________;阴极材料:镀件__________,电极反应:___________________。电解质溶液:Cu2+浓度__________。
Cu-2e-===Cu2+
Cu2++2e-===Cu
2.电解精炼(粗铜含锌、银、金等杂质)
阳极材料:______,电极反应:Zn-2e-===Zn2+、Cu-2e-===Cu2+;阴极材料:______,电极反应:Cu2++2e-===Cu;电解质溶液:Cu2+浓度______,金、银等金属沉积形成阳极泥。
3.电冶金(1)金属冶炼就是使矿石中的__________获得电子变成__________的过程:Mn++ne-===M。(2)电解法用于冶炼较活泼的金属(如钠、钙、镁、铝等),但不能电解其盐溶液,应电解其熔融态。
(3)①冶炼金属钠阳极:________________________;阴极:_____________________;总反应:___________________________________。②冶炼金属镁阳极:______________________;阴极:_______________________;总反应:______________________________。
2Na++2e-===2Na
2Cl--2e-===Cl2↑
Mg2++2e-===Mg
③冶炼金属铝阳极:______________________;阴极:______________________;总反应:___________________________________。
6O2--12e-===3O2↑
4Al3++12e-===4Al
正|误|判|断(1)在Fe上电镀Zn,应用Zn作阳极,用ZnSO4溶液作电镀液。( )(2)电解精炼铜时,粗铜作阳极,活泼性比Cu弱的杂质金属成为阳极泥沉在阳极区。( )(3)电镀铜和电解精炼铜时,电解质溶液中c(Cu2+)均保持不变。( )(4)工业冶炼金属镁时,电解熔融态MgO。( )
深|度|思|考1.工业生产金属镁和金属铝均采用电解法,制取Mg时电解的是熔融的MgCl2,而制取Al时却电解的是熔融的氧化铝,不是AlCl3,这是为什么?提示:MgCl2是离子化合物,在熔融状态时导电,而AlCl3是共价化合物,在熔融状态下不导电,故制取金属铝用的是熔融的氧化铝。
2.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,思考回答下列问题:(1)阳极发生______反应,其电极反应式:_________________________________________________________。(2)电解过程中,阳极质量的减少与阴极质量的增加________(填“相等”或“不相等”)。提示:电解过程中阳极失电子的有Fe、Zn、Ni,阴极析出的是镍,依据得失电子守恒,阳极质量的减少与阴极质量的增加不相等。
Ni-2e-===Ni2+,
Fe-2e-===Fe2+;Zn-2e-===Zn2+
(3)电解后,溶液中存在的金属阳离子有____________________、Ni2+等。(4)电解后,电解槽底部含有____________等金属。提示:粗镍作阳极,Fe、Zn在电极上失去电子形成阳离子进入溶液中,但Cu和Pt沉降到电解槽底部。
归纳总结:(1)电解精炼过程中的“两不等”:电解质溶液浓度在电解前后不相等;阴极增加的质量和阳极减少的质量不相等。(2)电镀过程中的“一多,一少,一不变”:“一多”指阴极上有镀层金属沉积;“一少”指阳极上有镀层金属溶解;“一不变”指电镀液(电解质溶液)的浓度不变。
应|用|体|验1.关于镀铜和电解精炼铜,下列说法中正确的是( )A.都用粗铜作阳极、纯铜作阴极B.电解液的成分都保持不变C.阳极反应都只有Cu-2e-===Cu2+D.阴极反应都只有Cu2++2e-===Cu解析:A项,电镀时镀件作阴极;B项,电解精炼铜时电解液成分改变;C项,电解精炼铜时,杂质若有比铜活泼的金属(如锌),则阳极还会发生Zn-2e-===Zn2+的反应。
2.中学阶段介绍的应用电解法制备的金属主要有钠、镁、铝。下列关于这三种金属工业制备方法的说法正确的是( )A.电解法制金属钠的阳极反应式:Na++e-===NaB.工业上电解氯化铝生产铝,阴极反应式:Al3++3e-===AlC.工业上电解氯化镁溶液生产镁,阳极反应式:2Cl--2e-===Cl2↑D.金属钠的冶炼和氯碱工业都用到了NaCl,在电解时它们的阳极都是Cl-失电子
解析:电解法制金属钠时,阳极反应式为2Cl--2e-===Cl2↑,阴极反应式为Na++e-===Na,A项错误;工业上电解熔融Al2O3生产铝,B项错误;工业上电解熔融氯化镁生产镁,C项错误。
1.如图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法正确的是( )
解析:右边是阴极区,发生2H++2e-===H2↑,所以从E口逸出的气体是H2,故A错误;每生成22.4 L Cl2,没有指明温度和压强,故B错误;阴极生成OH-,且Na+向阴极移动,阴极区生成NaOH,为增强导电性,则从B口加入稀NaOH(增强导电性)的水溶液,故C正确;粗盐提纯所加试剂的顺序Na2CO3必须放在BaCl2的后面,故D错误。
2.下列叙述正确的是( )A.电镀时,通常把待镀的金属制品作阳极B.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e-===2H2OC.氯碱工业是电解熔融的NaCl,在阳极能得到Cl2D.电解熔融的氧化铝制取金属铝,用铁作阳极
解析:电镀时,通常把待镀的金属制品作阴极,镀层金属作阳极,故A错误;氢氧燃料电池(酸性电解质)中O2通入正极,由于是酸性环境,故电极反应为O2+4H++4e-===2H2O,故B正确;氯碱工业是电解饱和NaCl溶液,在阳极能得到Cl2,阴极得到氢气和氢氧化钠,故C错误;铁作阳极时,铁将放电生成Fe2+,开始时阴极还能析出少量铝,后来就变成电镀铁了,同时用铁作阳极,阳极放电的是金属铁,电极被损耗,不符合生产实际,应用石墨作阳极,故D错误。
4.(1)利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为________溶液(填化学式),阳极电极反应式为___________________,电解过程中Li+向____电极迁移(填“A”或“B”)。
H++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强
解析:(1)由图可知,B极区生成H2,同时会生成LiOH,则B极区电解液为LiOH溶液;电极A为阳极,在阳极区LiCl溶液中Cl-放电,电极反应式为2Cl--2e-===Cl2↑;在电解过程中Li+(阳离子)向B电极(阴极区)迁移。
化学选择性必修1第二节 电解池集体备课课件ppt: 这是一份化学选择性必修1第二节 电解池集体备课课件ppt,共4页。PPT课件主要包含了第二节电解池,新课情景呈现,课前素能奠基,饱和氯化钠溶液,氢气和氯气,抗腐蚀,CuSO4,硫酸铜溶液,金属离子,活泼金属等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 电解池课文内容课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第二节 电解池课文内容课件ppt,共4页。PPT课件主要包含了第二节电解池,第1课时电解原理,新课情景呈现,课前素能奠基,红色物质,析出金属铜,产生了氯气,OH-,氧化还原,化学能等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 电解池课文课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第二节 电解池课文课件ppt,共59页。PPT课件主要包含了课前·基础认知,课堂·重难突破,随堂训练,放出气体溶液变红,试纸变蓝等内容,欢迎下载使用。













