


河南省开封市2024届高三三模理综-化学试题(原卷版+解析版)
展开一、选择题:本题共13个小题,每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 生活中处处有化学。下列说法正确的是
A. 食醋属于纯净物B. 豆浆煮沸后蛋白质转化为氨基酸
C. 氧化钙干燥食品过程中只发生物理变化D. “胃得乐”(主要成分为碳酸镁)是一种抗酸药
【答案】D
【解析】
【详解】A.食醋为含醋酸的水溶液,为混合物,A错误;
B.豆浆煮沸是蛋白质发生了变性,而没有水解生成氨基酸,B错误;
C.氧化钙和水生成氢氧化钙发生化学变化,可以作为干燥剂,C错误;
D.碳酸镁能和胃酸盐酸反应,是一种抗酸药,D正确;
故选D。
2. PBS是一种新型的全生物降解塑料,其结构如图所示。下列说法错误的是
A. PBS中存在2个键
B. PBS重复单元中只有一种官能团
C. PBS膜应避免与碱性物质(如NaOH)长期接触
D. 通过质谱法测定PBS的平均相对分子质量,可计算其聚合度
【答案】A
【解析】
【详解】A.双键中含有1个σ键1个π键,由结构可知,PBS中存在2n个π键,A错误;
B.PBS重复单元中只有酯基一种官能团,B正确;
C.PET是聚酯,在碱性条件下容易发生水解反应,所以PET膜使用应避免与碱性物质(如NaOH)长期接触,C正确;
D.质谱法可以测物质的平均相对分子质量,由于物质的链节是什么、式量为多少都可以确定,因而就可以计算出物质的聚合度,D正确;
故选A。
3. DNA的部分结构如下图所示,其中A为腺嘌呤、G为鸟嘌呤,嘌呤()为平面结构。下列说法正确的是
A. 基态原子电负性:B. 基态原子的价层空轨道数:
C. 嘌呤中N原子的杂化轨道类型只有一种D. 图中碱基互补配对时存在氢键
【答案】C
【解析】
【详解】A.基态原子电负性:,A错误;
B.P原子价层电子排布式为3s23p3,p轨道半充满没有空轨道,C原子价层电子排布式为2s22p2,p轨道有一个空轨道,基态原子的价层空轨道数:,B错误;
C.嘌呤为平面结构,N原子为sp2杂化,C正确;
D.上图中碱基互补配对时存在、氢键,不存在氢键,Dc错误;
故选C。
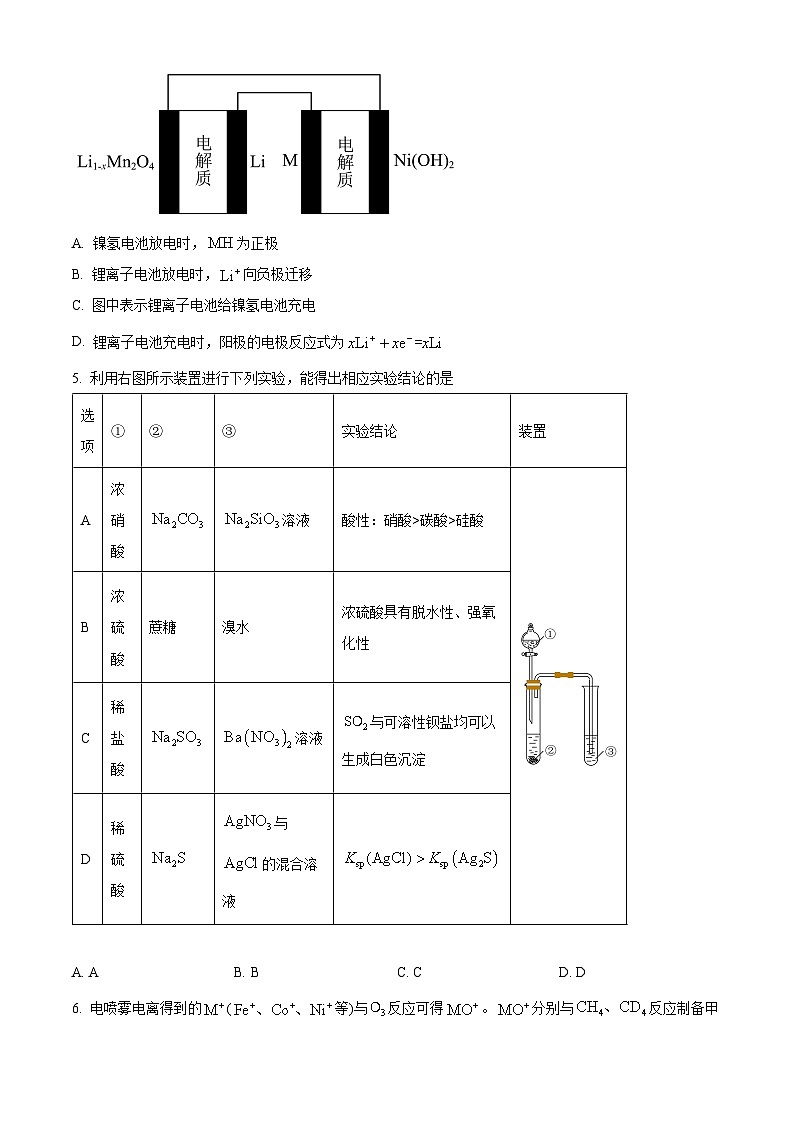
4. 某充电宝锂离子电池的总反应为,某手机镍氢电池总反应为为储氢金属或合金)。有关上述两种电池的说法正确的是
A. 镍氢电池放电时,为正极
B. 锂离子电池放电时,向负极迁移
C. 图中表示锂离子电池给镍氢电池充电
D. 锂离子电池充电时,阳极的电极反应式为
【答案】C
【解析】
【分析】锂离子电池放电时负极电极反应式为,正极电极反应式为,充电时,阳极电极反应式为,阴极电极反应式为;镍氢电池放电时负极电极反应式为,正极电极反应式为,充电时阳极的电极反应式为,阴极的电极反应式为,据此回答。
【详解】A.镍氢电池放电时,为负极,A错误;
B.锂离子电池放电时,向正极迁移,参与正极反应,B错误;
C.图中表示锂离子电池给镍氢电池充电,C正确;
D.锂离子电池充电时,阳极的电极反应式为,D错误;
故选C。
5. 利用右图所示装置进行下列实验,能得出相应实验结论的是
A. AB. BC. CD. D
【答案】B
【解析】
【详解】A.强酸与弱酸盐反应生成弱酸,根据强酸制取弱酸判断酸性强弱,浓硝酸和碳酸钠反应生成二氧化碳,二氧化碳、水和硅酸钠反应生成难溶性硅酸,但硝酸具有挥发性,生成的CO2中含有硝酸,硝酸也与硅酸钠反应产生硅酸沉淀,不能实现实验目的,A错误;
B.浓硫酸将蔗糖炭化,进而氧化,生成CO2、SO2和H2O,SO2能使溴水褪色,B正确;
C.二氧化硫溶液呈酸性,酸性条件下,硝酸根离子具有强氧化性,可氧化二氧化硫生成硫酸根离子,可生成沉淀,但二氧化硫通入氯化钡溶液中则没有沉淀生成,C错误;
D.稀硫酸与硫化钠反应生成硫化氢气体,由于③中含有硝酸银,通入H2S一定生成硫化银沉淀,不能比较溶度积大小,D错误;
故选B。
6. 电喷雾电离得到的(等)与反应可得。分别与反应制备甲醇,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以示例)。已知:直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢。下列说法正确的是
A. 步骤Ⅰ和Ⅱ中均涉及氢原子成键变化
B. 与反应的能量变化为图中曲线
C. 与反应,生成的氘代甲醇有三种
D. 与反应,生成的氘代甲醇:
【答案】D
【解析】
【详解】A.由图可知,步骤Ⅰ涉及碳氢键的断裂和氢氧键的形成,步骤Ⅱ中涉及碳氧键形成,所以涉及氢原子成键变化的是步骤Ⅰ,A错误;
B.直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,说明正反应活化能会增大,则与反应的能量变化应为图中曲线c,B错误;
C.根据反应机理可知,若与反应,生成的氘代甲醇可能为CHD2OD或CD3OH,共2种,C错误;
D.直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则氧更容易和H而不是和D生成羟基,故氘代甲醇的产量,D正确;
故选D。
7. 将溶液与氨水等体积混合,测得和铜氨各级配离子的物质的量分数与平衡体系中的关系如下图所示。下列说法中错误的是
A. a点的纵坐标约为0.43
B. 平衡体系中越大越有利于配位数大的铜氨配合物的形成
C. 反应的平衡常数为
D. p在时,混合溶液中含铜微粒浓度最大的是
【答案】C
【解析】
【详解】A.由图像可以看出,a点时和Cu2+物质的量分数相同, b点数值为0.14,则和Cu2+的物质的量分数约为(1-0.14)÷2=0.43,即a点的纵坐标约为0.43,A正确;
B.由图可知,随着增大,逐渐转化为、、,故平衡体系中越大越有利于配位数大的铜氨配合物的形成,B正确;
C.由点(3.5、0.4)可知,此时、=10-3.5,则反应的平衡常数为,C错误;
D.由图可知,p在时,混合溶液中含铜微粒浓度最大的是,D正确;
故选C。
三、非选择题:共174分。
8. 2-硝基-1,3-苯二酚是重要的医药中间体。实验室常用间苯二酚为原料,经磺化、硝化、去磺酸基三步合成,原理如下。
部分物质相关性质如下表:
制备过程如下:
第一步:磺化。称取77.0g间苯二酚,碾成粉末后加入到图1所示的三颈烧瓶中,缓慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内,搅拌15min。
第二步:硝化。待磺化反应结束后,将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度,继续搅拌。
第三步:去磺酸基。将硝化反应后稀释液转移至圆底烧瓶B中,然后用如图2所示装置进行水蒸气蒸馏(水蒸气蒸馏可使待提纯的有机化合物在低于的情况下随水蒸气一起被蒸出来,从而达到分离提纯的目的),收集馏出物,得到2-硝基-1,3-苯二酚粗品。
回答下列问题:
(1)仪器的名称是___________。
(2)“硝化”步骤中,控制温度最合适的范围是___________(填标号);引入磺酸基的目的是___________。
A. B. C. D.
(3)烧瓶A中长玻璃管的作用是___________。
(4)水蒸气蒸馏是分离和提纯有机化合物的方法之一,被提纯物质必须具备的性质有___________(填字母)。
A. 难溶于水B. 难挥发C. 较低的熔点D. 与水不发生化学反应
(5)图2中,反应一段时间后,停止蒸馏的操作是:先___________,再___________,最后停止通冷凝水。
(6)蒸馏所得2-硝基-1,3-苯二酚中仍含少量杂质,可用少量乙醇水混合剂洗涤。设计简单实验证明2-硝基-1,3-苯二酚已经洗涤干净:___________。
(7)本实验最终获得橘红色晶体,则2-硝基-1,3-苯二酚的产率约为___________(保留3位有效数字)。
【答案】(1)三颈烧瓶
(2) ①. A ②. 防止硝基取代两个酚羟基对位上的氢原子,降低2-硝基-1,3-苯二酚的产率
(3)平衡烧瓶内外压强 (4)AD
(5) ①. 打开活塞 ②. 停止在A处加热
(6)取最后一次洗涤液少量,滴加氯化钡溶液,若无沉淀产生,证明已经洗涤干净,反之则没有洗涤干净
(7)14.3%
【解析】
【小问1详解】
分析图中装置可知,仪器a为三颈烧瓶;
小问2详解】
根据题干信息可判断硝化反应温度需要低于30℃,一般控制在25~30℃左右,故选A;第一步磺化引入磺酸基基团,可防止硝基取代两个酚羟基对位上的氢原子,降低2-硝基-1,3-苯二酚的产率,故答案为:防止硝基取代两个酚羟基对位上的氢原子,降低2-硝基-1,3-苯二酚的产率;
【小问3详解】
烧瓶A中长玻璃管的作用是平衡烧瓶内外压强,防止压强过大引起事故和压强过小引起倒吸;
【小问4详解】
能用水蒸气蒸馏来分离和提纯的物质,则被提纯的物质必须不溶或难溶于水,便于最后分离,在沸腾下不与水发生化学反应,具有一定的挥发性,故选AD;
【小问5详解】
反应一段时间后,停止蒸馏的操作是:应先打开活塞,再停止在A处加热,最后停止通冷凝水。
【小问6详解】
步骤③所得2-硝基-1,3-苯二酚中仍含少量杂质,其中含有硫酸根离子,证明2-硝基-1,3-苯二酚已经洗涤干净的操作为取少量洗涤液,滴加BaCl2溶液,若无沉淀产生,证明已经洗涤干净;
【小问7详解】
77.0g间苯二酚的物质的量为0.7ml,根据元素守恒可知,生成的2-硝基-1,3-苯二酚的质量为0.7ml×155g/ml=108.5g,产率=。
9. 氧化钪可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。以钛白工业废酸(含、等离子)为原料制备氧化钪的一种流程如下图。
回答下列问题:
(1)基态钪原子的价层电子排布式为___________。
(2)“萃取”时,钛白工业废酸中加入可降低钛的萃取率,可能是生成了难萃取的,其中钛的化合价为___________;的作用是___________(填标号)。
A.作氧化剂 B.作还原剂 C.提供配体
(3)“洗涤”时,洗涤剂是用和三种试剂按一定比例混合而成。实验室中混合三种试剂的操作是:将试剂沿烧杯内壁缓慢注入试剂中,并用玻璃棒不断搅拌,冷却后再将所得混合液缓慢注入试剂中,并不断搅拌,则A、C分别对应上述试剂中的___________、___________。
(4)萃取剂萃取的原理为(代表萃取剂)。在“反萃取”中,加入溶液后生成等物质,其中生成含化合物的化学方程式为___________。时,经“反萃取”后所得滤液的,则残留的浓度为___________(已知:时,。
(5)“沉钪”时用到草酸。已知草酸的,则在时,的草酸溶液中___________。
(6)在空气中焙烧只生成一种碳氧化物的化学方程式为___________。
【答案】(1)
(2) ①. ②. C
(3) ①. ②.
(4) ①. ②.
(5)8.4 (6)
【解析】
【分析】向钛白工业废酸(、等离子)加入萃取剂,进行萃取,进入油相,分液后洗涤,再加入氢氧化钠反萃取,分别生成,过滤后加入酸进行酸溶,溶解生成,再加入草酸进行沉钪生成,在空气中焙烧,发生,生成,据此回答。
【小问1详解】
钪位于元素周期表中第四周期第ⅢB族,故基态钪原子价层电子排布式为;
【小问2详解】
中O的化合价为价,故钛的化合价为价;加入,形成,故的作用是提供配体,故选C;
【小问3详解】
由于浓H2SO4密度比水大,溶于水放出大量的热量,为了防止产生液体飞溅引起实验事故,且由于加热会挥发,故实验室中混合三种试剂的操作是:将浓沿烧杯内壁缓慢注入中,并用玻璃棒不断搅拌,冷却后再将所得混合液缓慢注入试剂中,并不断搅拌,故则A、C分别为、;
小问4详解】
在“反萃取”中,加入溶液后生成,其中生成含化合物的化学方程式为;时,经“反萃取”后所得滤液的,即,则残留的浓度为;
【小问5详解】
在时,的草酸溶液中
【小问6详解】
在空气中焙烧只生成一种碳氧化物,草酸根中碳的化合价是+3价,在灼烧草酸抗时会被氧化为CO2,氧气是氧化剂,还生成了Sc2O3,化学方程式为。
10. 含硫化合物是实验室和工业上的常用化学品。
回答下列问题:
(1)实验室可用铜与浓硫酸反应制备少量:
,判断该反应的自发性,并说明理由___________。
(2)在一个固定容积为的密闭容器中,充入和,半分钟后达到平衡,测得容器中含,则___________。若继续通入和,则平衡___________移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡时,______________________。
(3)接触法制硫酸工艺中,其主反应在并有催化剂存在条件下进行:
①该热化学反应方程式的含义是___________。
②为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如图所示。下列说法正确的是___________(填标号)。
a.温度越高,反应速率越大
b.的曲线代表平衡转化率
c.越大,反应速率最大值对应温度越低
d.可根据不同对应的最大反应速率,选择最佳生产温度
③设的平衡分压为的平衡转化率为,用含和的代数式表示上述催化氧化反应的___________(用平衡分压代替平衡浓度)。
④为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如下图所示,催化性能最佳的是___________(填标号)。
【答案】(1)该反应、,则始终成立,说明该反应再任何条件下都能自发进行
(2) ①. 0.036 ②. 向正反应方向 ③. 0.36 ④. 0.40
(3) ①. 在时,与完全反应生成时放出的热量为 ②. cd ③. ④. d
【解析】
【小问1详解】
实验室可用铜与浓硫酸反应制备少量:
,由于该反应、,则始终成立,说明该反应再任何条件下都能自发进行;
【小问2详解】
当生成时,设参加反应的氧气的物质的量为x,由三段式得,,则,;继续通入和,容器内压强增大,平衡向着分子数减小得方向移动,即向正反应方向移动;用极限法求出的取值范围,假设平衡不移动,此时,假设完全生成,则根据反应方程式可得,,所以再次达到平衡时,;
【小问3详解】
①该热化学反应方程式的含义为在时,与完全反应生成时放出的热量为;
②a.由图可知,温度高于一定值时,身高温度,反应速率减小,a错误;
b.相同温度下,存在转化率大于0.88的情况,故的曲线不能代表平衡转化率,b错误;
c.有体图可知,越大,反应速率最大值对应温度越低,c正确;
d.可根据不同下的最大反应速率,选择最佳生产温度,d正确;
答案选cd;
③设起始时的分压为,由三段式,则;④由题图可知,在相同温度下d催化剂对应的二氧化硫的转化率最高,催化性能最佳。
11. 我国科学家研发的氯霉素(H)合成路线之一如下图所示:
已知:
回答下列问题:
(1)的名称为___________;氯霉素(H)中的官能团有羟基、硝基和___________、___________。
(2)由B生成C的反应条件是___________。
(3)D的结构简式为___________。
(4)的同分异构体中,符合下列条件的有___________种。
①苯环上有两个取代基且其中一个为氨基 ②能发生水解反应和银镜反应
其中核磁共振氢谱有五组峰,且峰面积之比为1:2:2:2:6的同分异构体的结构简式为___________。
(5)的化学方程式为___________。
【答案】(1) ①. 苯乙烯 ②. 碳氯键 ③. 酰胺键
(2)浓硫酸、加热 (3)
(4) ① 15 ②.
(5)+HNO3+H2O
【解析】
【分析】A 与溴和水发生反应生成B,B发生消去反应生成C,C与甲醛发生题给信息反应生成D;D高压条件下与氨分子发生取代反应生成E,E 酸性条件下发生信息反应后、碱化得到F,在浓硫酸作用下F与浓硝酸发生硝化反应后、碱化得到G,G与Cl2CHCOOCH3发生取代反应生成H。
【小问1详解】
由结构可知,A为苯乙烯;由结构简式可知,的官能团为硝基、羟基、碳氯键和酰胺基,故答案为:苯乙烯;碳氯键和酰胺键;
【小问2详解】
结合B和C的结构简式可知,B生成C是醇的消去反应,需要的条件是:浓硫酸、加热;
【小问3详解】
由分析可知,D的结构简式为;
【小问4详解】
①苯环上有两个取代基且其中一个为氨基; ②能发生水解反应和银镜反应,说明含有-OOCH;两个取代基可能是-NH2、-CH2CH2CH2OOCH或-NH2、-CH(CH3)CH2OOCH或-NH2、-CH2CH(CH3)OOCH或-NH2、-C(CH3)2OOCH或-NH2、-CH(CH2CH3)OOCH,两个取代基在苯环上的位置有3种结构,符合条件的的同分异构体有15种;其中核磁共振氢谱有五组峰,且峰面积之比为的结构简式为;
【小问5详解】
由分析可知,在浓硫酸作用下F与浓硝酸发生硝化反应后、碱化得到G,则的化学方程式为:+HNO3+H2O。选项
①
②
③
实验结论
装置
A
浓硝酸
溶液
酸性:硝酸>碳酸>硅酸
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、强氧化性
C
稀盐酸
溶液
与可溶性钡盐均可以生成白色沉淀
D
稀硫酸
与的混合溶液
名称
相对分子质量
性状
熔点/℃
水溶性(常温)
间苯二酚
110
白色针状晶体
110.7
易溶
2-硝基-1,3-苯二酚
155
橘红色针状晶体
87.8
难溶
山西省运城市2024届高三二模理综-化学试题(原卷版+解析版): 这是一份山西省运城市2024届高三二模理综-化学试题(原卷版+解析版),文件包含山西省运城市2024届高三二模理综-化学试题原卷版docx、山西省运城市2024届高三二模理综-化学试题解析版docx等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。
2024届青海省百所名校高三下学期二模理综化学试题(原卷版+解析版): 这是一份2024届青海省百所名校高三下学期二模理综化学试题(原卷版+解析版),文件包含2024届青海省百所名校高三下学期二模理科综合试题-高中化学原卷版docx、2024届青海省百所名校高三下学期二模理科综合试题-高中化学解析版docx等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。
河南省周口市2024届高三二模理综-化学试题(含解析): 这是一份河南省周口市2024届高三二模理综-化学试题(含解析),共20页。试卷主要包含了单选题,解答题等内容,欢迎下载使用。












