


所属成套资源:全套中考化学复习考点课件
中考化学复习物质的性质与应用考点3碳和碳的氧化物课件
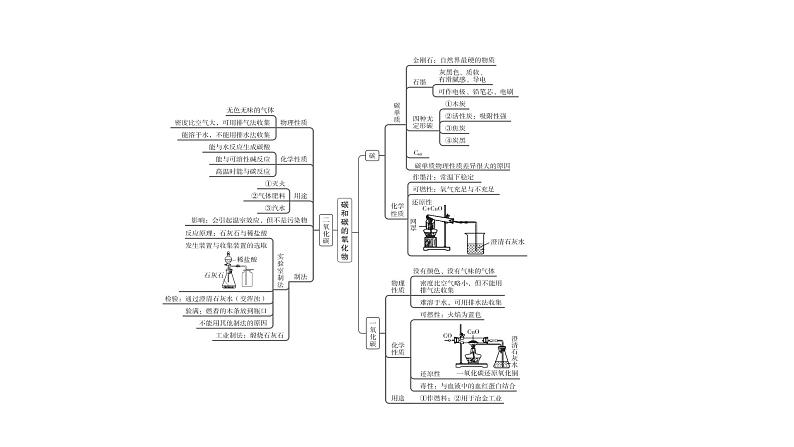
展开这是一份中考化学复习物质的性质与应用考点3碳和碳的氧化物课件,共38页。PPT课件主要包含了碳单质,硬度大,有滑腻感,碳原子排列方式不同,不活泼,冶金工业,一氧化碳,血红蛋白,二氧化碳,能溶于水等内容,欢迎下载使用。
1.碳的单质(1)金刚石:具有 的性质,可用来裁玻璃等。 (2)石墨:具有 的性质,可用于制铅笔芯;还具有优良的 性能,可以作电极材料。 (3)C60:应用于超导材料。(4)碳单质物理性质差异很大的原因是 ;化学性质相似的原因是它们都是由 元素组成的单质。 (5)木炭和活性炭:具有 性,可用于吸附色素、异味和毒气,这属于 (选填“物理”或“化学”)性质。
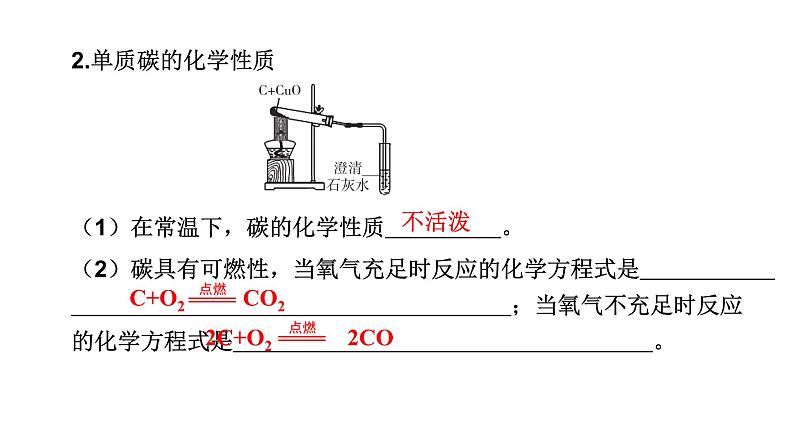
2.单质碳的化学性质(1)在常温下,碳的化学性质 。 (2)碳具有可燃性,当氧气充足时反应的化学方程式是 ;当氧气不充足时反应的化学方程式是 。
C+O2 CO2
2C+O2 2CO
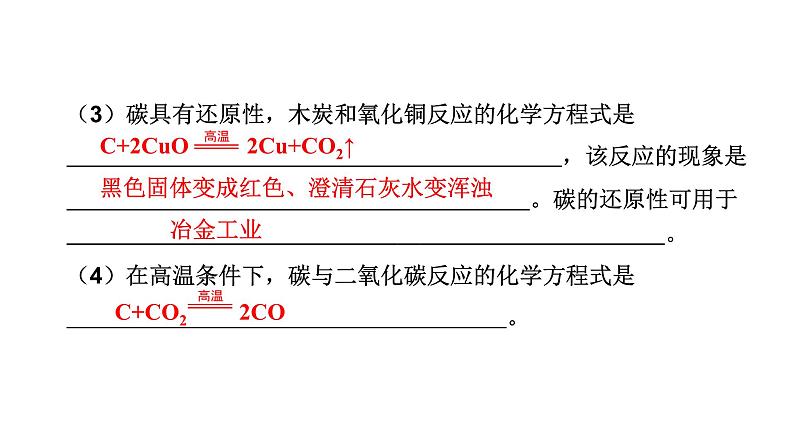
(3)碳具有还原性,木炭和氧化铜反应的化学方程式是 ,该反应的现象是 。碳的还原性可用于 。 (4)在高温条件下,碳与二氧化碳反应的化学方程式是 。
C+2CuO 2Cu+CO2↑
黑色固体变成红色、澄清石灰水变浑浊
C+CO2 2CO
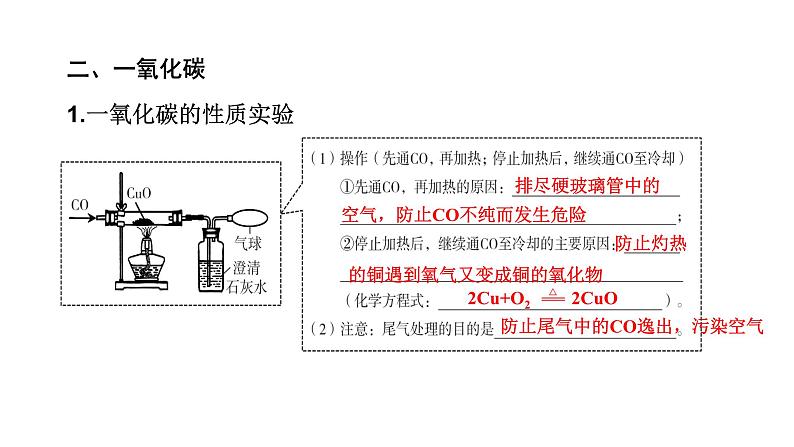
1.一氧化碳的性质实验
排尽硬玻璃管中的空气,防止CO不纯而发生危险
防止灼热的铜遇到氧气又变成铜的氧化物
2Cu+O2 2CuO
防止尾气中的CO逸出,污染空气
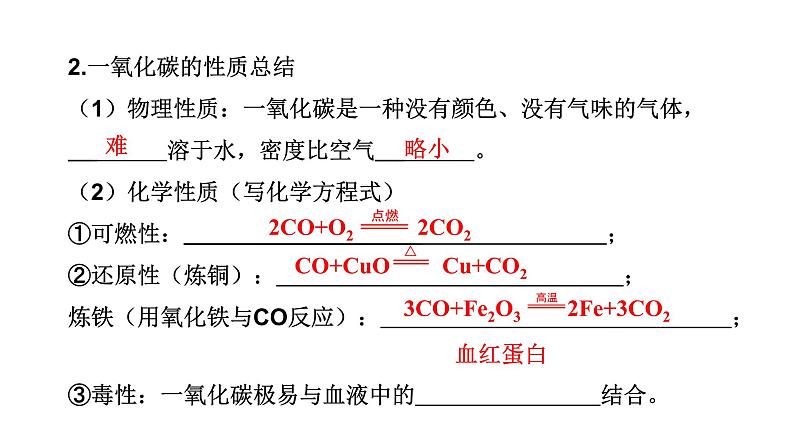
2.一氧化碳的性质总结(1)物理性质:一氧化碳是一种没有颜色、没有气味的气体, 溶于水,密度比空气 。 (2)化学性质(写化学方程式)①可燃性: ; ②还原性(炼铜): ; 炼铁(用氧化铁与CO反应): ; ③毒性:一氧化碳极易与血液中的 结合。
2CO+O2 2CO2
CO+CuO Cu+CO2
3CO+Fe2O3 2Fe+3CO2
3.CO的用途(1)利用可燃性可作 。 (2)利用还原性可用于 。
1.二氧化碳的性质实验
密度比空气大、不能燃烧、不支持燃烧
实验C中①证明 能使紫色石蕊溶液变红;②证明 不能使紫色石蕊溶液变色;③证明 不能使紫色石蕊溶液变色;④证明 能使紫色石蕊溶液变成红色。2.二氧化碳的性质总结(1)物理性质:在通常状况下,一氧化碳是一种 色、 味的气体, 溶于水;在一定条件下,二氧化碳气体会变成液体或固体。固态二氧化碳叫做“ ”。
二氧化碳与水反应生成碳酸,碳酸
(2)化学性质①“三不”:不能燃烧,不支持燃烧,不能供给呼吸;②二氧化碳与水反应:CO2+H2O (碳酸能使紫色石蕊溶液变成 色), H2CO3 (当烘干时,红色石蕊溶液又变成 色);
③二氧化碳与碱溶液反应检验CO2:___________________________ (写化学方程式); 除去CO2: (写化学方程式)。
Ca(OH)2+CO2 CaCO3↓+H2O
2NaOH+CO2 Na2CO3+H2O(答案合理即可)
3.CO2的用途(1)干冰可作制冷剂,广泛用于食品的冷藏保鲜和冷藏运输、医疗上血液制品的储存和运输等方面,还可用于 。 (2)CO2可用作灭火剂,利用了CO2的三点性质:______________ 。(3)CO2可作气体肥料等。4.CO2的影响:大气中CO2含量增加,造成 。 控制二氧化碳的排放量的措施:①减少使用_________________等化石燃料,更多地利用 等清洁能源;②大力植树造林;③采用物理或化学方法,人工吸收二氧化碳;等等。
不支持燃烧、密度比空气大
四、有关二氧化碳的知识网络图(写化学方程式)① ; ② ; ③ ; ④ ;⑤ ;
C+O2 CO2(答案合理即可)
C+2CuO 2Cu+CO2↑(答案合理即可)
2C+O2 2CO
2CO+O2 2CO2(答案合理即可)
CO+CuO Cu+CO2(答案合理即可)
⑥ ; ⑦ ; ⑧ ; ⑨ ; ⑩ ; ⑪ 。
CO2+C 2CO
CaCO3 CaO+CO2↑(答案合理即可)
CaCO3+2HCl CaCl2+H2O+CO2↑(答案合理即可)
CO2+Ca(OH)2 CaCO3↓+H2O
CO2+H2O H2CO3
H2CO3 H2O+CO2↑
【例题1】实验是进行科学探究的重要方式。某化学兴趣小组设计了如表所示实验探究二氧化碳的性质,请你参与探究并填空。【实验记录与分析】
蜡烛火焰由下到上依次熄灭
【反思与拓展】(1)根据实验一的结论,写出二氧化碳的一条重要用途:_______。(2)由实验二的结论分析得出,实验室中保存氢氧化钠时要注意______________________。(3)在设计上述三组对比实验时,都只改变一个影响因素,保持其他因素不变,这是运用了科学探究中 的方法。
【变式1】用如图所示实验验证CO2的性质。
(1)实验室制取CO2的化学方程式为_________________________ 。 (2)观察到短蜡烛熄灭后,关闭弹簧夹,片刻后长蜡烛熄灭,由此得到的结论是 。(3)观察到纸花变红,由此并不能得出“CO2能与水发生化学反应”的结论,理由是_____________________________________________ 。
CaCl2+CO2↑+H2O
二氧化碳密度比空气大,不能燃烧也不支持燃烧
没有排除二氧化碳使纸花变红的可能,没有
【例题2】某兴趣小组在学习碳(C)的化学性质时,了解到高温下C与CuO反应生成CO2,C还能使CO2转变成CO。于是他们对过量木炭还原CuO的气体产物中是否含有CO进行了探究。【猜想与假设】C还原CuO时产生的CO2与C进一步反应生成CO,该反应的化学方程式是 。 【查阅资料】CO不与NaOH、Ca(OH)2及H2SO4反应。【实验方案】取研细和干燥后的木炭(0.3 g)和CuO(2.0 g),混合均匀并装入试管,连接装置,高温反应,检验气体。
CO2+C 2CO
【实验过程】(1)由如图所示装置③中粉末的颜色变化可检验CO,除此之外,还可通过几种装置的组合,由另一种明显的现象来进一步确定CO的存在,则装置连接的最佳顺序为 (选填字母)→尾气处理。 A.①→②→③→④ B.④→①→②→③→①C.①→④→①→③→② D.③→④→①→②
(2)上述进一步确定CO存在的现象是_______________________ (装置③中粉末的颜色变化除外)。 (3)装置③中发生反应的化学方程式是 。(4)写出CO尾气处理的方法:_____________________________ (写一种)。【实验结论】高温下,过量木炭还原CuO的气体产物中有CO。【延伸应用】冬天,室内用炭火取暖时,应注意 。
经过③之后的气体使澄清
CO+CuO Cu+CO2
【变式2】碳和氧化铜的混合物在一定条件下反应,质量变化情况如图所示。下列判断错误的是( )A.M点对应的固体物质只有两种B.N点对应的固体中可能还含有黑色物质C.反应后产生气体的总质量为(a-b)gD.O~t min内,固体中铜元素的质量分数不断增大
1.(2023·广西)党的二十大报告指出:“推动形成绿色低碳的生产方式和生活方式”。下列做法与这一要求不相符的是( )A.乘公交车出行B.回收废旧电池C.大量焚烧秸秆D.推广风力发电
2.(2023·郴州)下列有关碳及其化合物的说法正确的是( )A.一氧化碳有还原性,没有毒性B.二氧化碳是一种污染性气体C.含碳酸根或碳酸氢根离子的盐都能与盐酸反应生成二氧化碳气体D.活性炭具有吸附性,木炭没有吸附性
3.(2023·广东模拟)如图所示实验中①④为用紫色石蕊溶液润湿的棉球,②③为用石蕊溶液染成紫色的干燥棉球。下列能说明CO2密度大于空气且能与水反应的现象是( )A.①变红,③不变红B.④变红,③不变红C.①④变红,②③不变红D.④比①先变红,②③不变红
4.(2021·呼和浩特)碳及其部分化合物的转化关系如图所示,其中X、Y表示相应转化中的其他反应物。下列说法错误的是( )A. X可以是单质或氧化物B.反应物Y可以用来检验CO2C.反应①不属于置换反应D.打开碳酸饮料瓶盖时发生反应②
5.(2023·河南节选)碳是形成化合物种类最多的元素,含碳物质是化学研究的重要内容。(1)如图1所示是碳原子的结构示意图,图中x的数值为 。
(2)碳元素可组成多种单质。下列说法不正确的是 (选填字母)。 a.金刚石的硬度很大b.每个C60分子是由60个碳原子构成的c.石墨的导电性良好d.金刚石、石墨和C60的碳原子排列方式相同
(3)CO和CO2均属于碳的氧化物。如图2所示,A是CO还原Fe2O3的部分实验装置,B是探究CO2性质的趣味实验装置。
①写出装置A中CO还原Fe2O3的化学方程式: ;从环保角度考虑,写出一种尾气处理的方法: 。 ②装置B中,注入浓NaOH溶液后,可观察到气球逐渐胀大,分析原因:______________________________________________________ 。
3CO+Fe2O3 2Fe+3CO2
氢氧化钠能与二氧化碳反应生成碳酸钠和水,使瓶内的气体被消耗,压强变小,气球变大
6.(2023·广东模拟改编)CO2捕捉是减少碳排放的措施之一。 (1)一种利用NaOH溶液捕捉回收CO2的过程如图1所示。
①“捕集室”中发生反应的化学方程式是________________________ ,“捕集室”中采用喷淋方式加入NaOH溶液,其优点是 ; ②“反应、分离”环节发生的复分解反应是_______________________ (写化学方程式); ③“反应、分离”环节分离物质采用的方法是 ; ④CO2用途广泛,写出一种用途:______________________________ ;
Na2CO3+H2O
增大反应物的接触面积,使反应更快、更充分
Na2CO3+Ca (OH)2
CaCO3↓+2NaOH
灭火(或气体肥料或制备碳
⑤整个设计流程中,可以循环利用的物质是_______________(写化学式)。
(2)CaO固体也可以捕捉回收CO2。研究表明CaC2O4·H2O热分解制得的CaO疏松多孔,具有良好的CO2捕捉性能。取1.46 g CaC2O4·H2O进行加热,固体质量随温度变化如图2所示。①写出400~600 ℃范围内分解反应的化学方程式_________________ ;
(提示:CaC2O4·H2O的相对分子质量为146)
②据图分析,CaO捕捉CO2的反应温度应 (选填“高于”或“低于”)800 ℃。 (3)CO2的利用。①在高温高压下,CO2和NH3可以合成尿素[CO(NH2)2],同时生成水,该反应中参加反应的CO2与NH3的分子个数比是 。
相关课件
这是一份中考化学复习物质的性质与应用考点4金属材料与金属材料的利用和保护课件,共31页。PPT课件主要包含了纯金属,钛和钛合金,Fe2O3,Fe3O4,红棕色,变浑浊,通入一氧化碳一段时间,点燃酒精喷灯,熄灭酒精喷灯,继续通入一氧化碳等内容,欢迎下载使用。
这是一份中考化学复习物质的性质与应用考点2自然界的水课件,共28页。PPT课件主要包含了水的组成,氧气或O2,氢气或H2,氢元素,氧元素,可再分,不可再分,玻璃棒,不溶性,漏斗内壁等内容,欢迎下载使用。
这是一份中考化学复习物质的性质与应用考点1我们周围的空气课件,共37页。PPT课件主要包含了五氧化二磷,消耗的氧气,影响实验结果,空气污染,供给呼吸,支持燃烧,保护气,电光源,二氧化硫,一氧化碳等内容,欢迎下载使用。












