








第一篇 主题十 热点题空19 化工流程中试剂用量及温度控制分析-2024年高考化学二轮复习课件
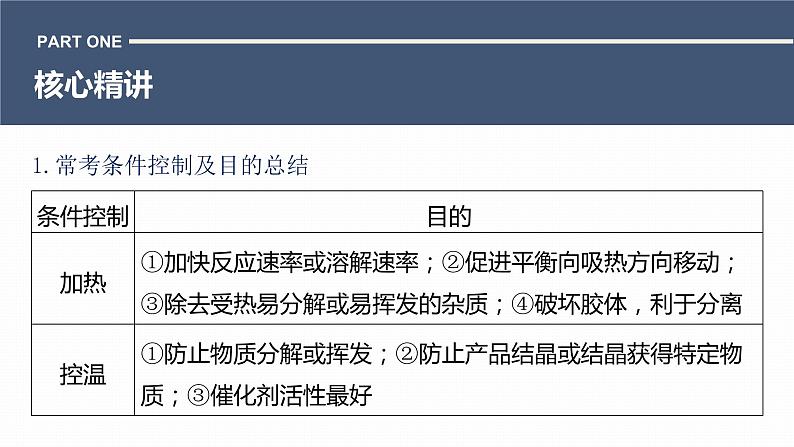
展开1.常考条件控制及目的总结
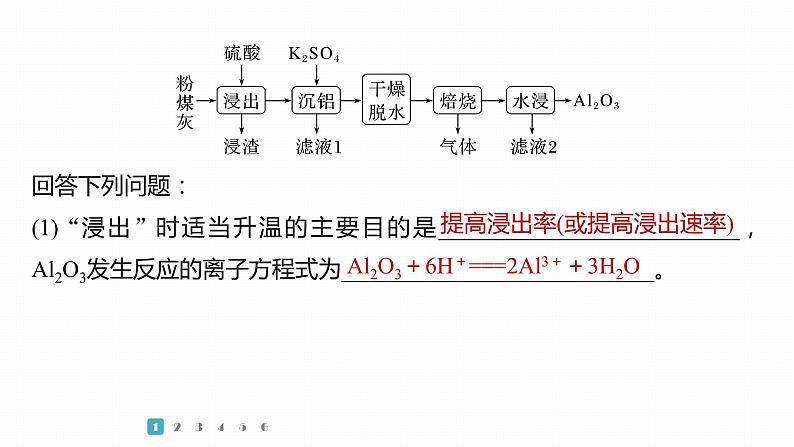
1.(2022·福建,11)粉煤灰是火电厂的大宗固废。以某电厂的粉煤灰为原料(主要含SiO2、Al2O3和CaO等)提铝的工艺流程如下:
回答下列问题:(1)“浸出”时适当升温的主要目的是__________________________,Al2O3发生反应的离子方程式为___________________________。
提高浸出率(或提高浸出速率)
Al2O3+6H+===2Al3++3H2O
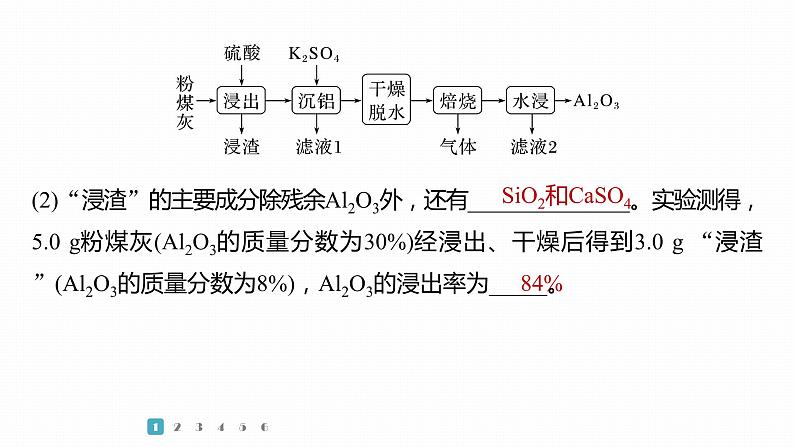
(2)“浸渣”的主要成分除残余Al2O3外,还有______________。实验测得,5.0 g粉煤灰(Al2O3的质量分数为30%)经浸出、干燥后得到3.0 g “浸渣”(Al2O3的质量分数为8%),Al2O3的浸出率为_____。
粉煤灰(主要含SiO2、Al2O3和CaO等)加入硫酸,浸渣为二氧化硅、硫酸钙,加入硫酸钾,产生复盐明矾沉铝,干燥脱水,焙烧产生氧化铝、硫酸钾和SO2、O2(或SO3)气体,水浸除去硫酸钾,过滤得到氧化铝。5.0 g粉煤灰中Al2O3的质量为5.0 g×30%=1.5 g,3.0 g “浸渣”中Al2O3的质量为3.0 g×8%=0.24 g,则Al2O3的浸出率为 ×100%=84%。
(3)“沉铝”时,体系中三种物质的溶解度曲线如下图所示,加入K2SO4沉铝的目的是__________________________________________________,“沉铝”的最佳方案为____________________。
使更多的铝元素转化为晶体析出,同时保证晶体纯度
根据沉铝体系中KAl(SO4)2·12H2O溶解度最小,更容易析出,加入K2SO4沉铝的目的是使更多的铝元素转化为晶体KAl(SO4)2·12H2O析出,同时保证晶体纯度;KAl(SO4)2·12H2O溶解度受温度影响较大,“沉铝”的最佳方案为高温溶解再冷却结晶。
(4)“焙烧”时,主要反应的化学方程式为_________________________________________________________________________________________。
2KAl(SO4)2 K2SO4+
Al2O3+3SO3↑[或4KAl(SO4)2 2K2SO4+2Al2O3+6SO2↑+3O2↑]
“焙烧”时,KAl(SO4)2分解为K2SO4、Al2O3和SO3或K2SO4、Al2O3、SO2和O2,反应的化学方程式为2KAl(SO4)2 K2SO4+Al2O3+3SO3↑或4KAl(SO4)2 2K2SO4+2Al2O3+6SO2↑+3O2↑。
(5)“水浸”后得到的“滤液2”可返回_____工序循环使用。
“水浸”后得到的“滤液2”成分为K2SO4,可在沉铝工序循环使用。
2.碱式硫酸铝[(1-x)Al2(SO4)3·xAl(OH)3]溶液可用于烟气脱硫。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝溶液,实验流程如下:
已知“调pH”的反应为(2-x)Al2(SO4)3+3xCaCO3+3xH2O===2[(1-x)Al2(SO4)3·xAl(OH)3]+3xCaSO4+3xCO2↑。
(1)“酸浸”时适当增大H2SO4溶液浓度的目的是_______________________________。能达到相同目的的方法还有_____(任写一种)。
加快酸浸时的反应速率,
(2)“酸浸”时应控制H2SO4溶液的用量,H2SO4溶液用量不能太多的原因是___________________________________________。
多余的硫酸会增加后续调pH步骤CaCO3的消耗量
3.(1)由折线图分析产生三硫化钼沉淀的过程中应选择的最优温度和时间是______________。
40 ℃,30 min
(2)利用化学平衡移动原理分析低于或高于最优温度时,MS3的产率均下降的原因(流程如图):_________________________________________________________________________________。
温度太低不利于H2S逸出;温度太高,盐酸挥发,溶液中c(H+)下降,都不利于反应正向进行
(NH4)2 MS4与盐酸反应的离子方程式为 +2H+===MS3↓+H2S↑,如果温度太低不利于H2S逸出,如果温度太高,盐酸挥发,使溶液中c(H+)下降,都不利于反应正向进行。
4.某工厂利用黄铁矿(FeS2)和电解金属锰后的阳极渣(主要成分为MnO2,杂质为Pb、Fe、Cu元素的化合物)为原料制备高性能磁性材料MnCO3的工艺流程如下:
回答下列问题:(1)FeS2中硫元素化合价为____,滤渣Ⅰ的成分除了S还有_______。
(2)写出任意两种加快酸浸速率的措施:____________________________________________________________。“除铁、铜”过程中加入H2O2的目的是___________________________。
粉碎阳极渣和黄铁矿、适当增大硫酸的浓度、适当升温等(任写两种) 将Fe2+氧化成Fe3+,以便除去
加快酸浸速率的措施:粉碎阳极渣和黄铁矿、适当增大硫酸的浓度和适当升温等;“除铁、铜”过程中加入H2O2的目的是将Fe2+氧化成Fe3+,以便生成Fe(OH)3而除去。
(3)请结合平衡移动原理解释“除钙”时溶液酸度不宜过高,否则溶液中Ca2+沉淀不完全的原因:__________________________________________________________________________。
酸度过高,F-与H+结合形成弱电解质HF,CaF2(s) Ca2+(aq)+2F- (aq)平衡右移
酸度过高,F-与H+结合形成弱电解质HF,CaF2(s) Ca2+(aq)+2F- (aq)平衡右移,故“除钙”时溶液酸度不宜过高,否则溶液中Ca2+沉淀不完全。
5.(2023·银川一模)六氟锑酸钠(NaSbF6)可作为新型钠离子电池的离子导体。一种由锑白(主要含Sb2O3、Sb2S3和少量Sb2O5、Fe2O3、CuS等)合成六氟锑酸钠的工艺流程如图所示:
①Sb的氧化物及氢氧化物的性质与Al的类似,Sb2S3可溶于NaOH溶液; ②NaSbO3·3H2O晶体难溶于水。
请回答下列问题:(1)“碱浸渣”的主要成分是_____________(填化学式)。
根据流程图,加入氢氧化钠、Na2S2O3,过滤出Fe2O3、CuS固体,得NaSbO2、Na2S等的混合液。
(2)“碱浸、还原”时,Sb2O3发生的离子方程式为__________________________;若Na2S2O3与Sb2O5反应时的氧化产物为Na2SO4,则Na2S2O3与Sb2O5计量关系比为_____。
Sb2O3的性质与Al2O3类似,“碱浸、还原”时,Sb2O3和氢氧化钠反应生成NaSbO2和水,发生反应的离子方程式为Sb2O3+2OH-=== +H2O;Sb由+5价降低为+3价,S元素化合价由+2升高为+6,氧化产物为 ,根据得失电子守恒可知,Na2S2O3与Sb2O5计量关系比为1∶2。
(3)“转化”时控温约50 ℃的原因是________________________________________________。
温度过低反应速率太慢,温度过高H2O2易分解损失
6.六氟铝酸钠俗称冰晶石,广泛应用于冶铝工业。以磷肥副产物氟硅酸铵为原料制备六氟铝酸钠的简易流程如图所示:
请回答下列问题:(1)写出反应①的化学方程式:_____________________________________________,适当加热可以提高反应①的化学反应速率,但是温度不宜过高,其原因有两点:一是避免氨水挥发,降低反应物浓度;二是____________________________。
(NH4)2SiF6+4NH3·H2O===6NH4F+H2SiO3↓+H2O
避免NH4F水解程度增大而损失
氟硅酸铵与氨水反应,可以看成是氟硅酸铵先水解生成氟化氢、硅酸和氨水,然后氨水和氟化氢反应生成氟化铵。温度高,氨水挥发加快,NH4F水解程度增大。
(2)反应③得到Na3AlF6和滤液,滤液用于反应____(填“①”或“②”)循环利用。NH4F溶液不能用玻璃容器盛装,其原因是_____________________________。
NH4F水解生成HF,
反应③为NaAlO2+2H2O+6NH4F+2NaOH===Na3AlF6↓+6NH3·H2O,滤液中氨水可以用作反应①的反应物。NH4F发生水解生成HF,HF能与玻璃中二氧化硅反应生成四氟化硅和水。
(3)通过实验得出Na3AlF6的产率与外界条件关系如图所示(提示:温度、时间针对反应③)。
根据题述实验结果,可知最佳条件:反应温度、反应时间、氢氧化钠与氢氧化铝的物质的量之比依次是__________________。
第一篇 主题十 热点题空18 应用平衡常数分析化工流程中酸碱性调控-2024年高考化学二轮复习课件: 这是一份第一篇 主题十 热点题空18 应用平衡常数分析化工流程中酸碱性调控-2024年高考化学二轮复习课件,文件包含第一篇主题十热点题空18应用平衡常数分析化工流程中酸碱性调控pptx、第一篇主题十热点题空18应用平衡常数分析化工流程中酸碱性调控docx、第一篇主题十热点题空18应用平衡常数分析化工流程中酸碱性调控学生版docx等3份课件配套教学资源,其中PPT共34页, 欢迎下载使用。
第一篇 主题六 热点题空9 化工流程中物质的转化与跟踪分析-2024年高考化学二轮复习课件: 这是一份第一篇 主题六 热点题空9 化工流程中物质的转化与跟踪分析-2024年高考化学二轮复习课件,文件包含第一篇主题六热点题空9化工流程中物质的转化与跟踪分析pptx、第一篇主题六热点题空9化工流程中物质的转化与跟踪分析docx、第一篇主题六热点题空9化工流程中物质的转化与跟踪分析学生版docx等3份课件配套教学资源,其中PPT共42页, 欢迎下载使用。
第一篇 主题五 热点题空7 实验结论(结果)及分析-2024年高考化学二轮复习课件: 这是一份第一篇 主题五 热点题空7 实验结论(结果)及分析-2024年高考化学二轮复习课件,文件包含第一篇主题五热点题空7实验结论结果及分析pptx、第一篇主题五热点题空7实验结论结果及分析docx、第一篇主题五热点题空7实验结论结果及分析学生版docx等3份课件配套教学资源,其中PPT共28页, 欢迎下载使用。












