



所属成套资源:2024届中考化学一轮复习进阶
专题八 构成物质的微粒 认识化学元素——2024届中考化学一轮复习进阶课件【人教版】
展开这是一份专题八 构成物质的微粒 认识化学元素——2024届中考化学一轮复习进阶课件【人教版】,共54页。PPT课件主要包含了考情分析,考法二分子,考法三原子,考法四离子,考法六元素,考法八元素周期表,构成物质的基本微粒,易错提示,3应用,②意义等内容,欢迎下载使用。
构成物质的微粒为中考的常考内容,一般多以选择题形式考查为主,少量填空题形式考查为辅的方式出现,整体难度较低。构成物质的粒子包括分子、原子、离子,牢记原子构成、原子结构示意图、纯净物成分、粒子之间的转化关系是关键。化学元素属于化学学习的最基础部分,是处理元素周期表相关题目的基础,在中考选择题和填空题中均有出现,整体难度中等。牢记元素定义、元素周期表中的示例、元素周期表的结构是解决此类问题的关键。
考法一构成物质的基本微粒
考法五 分子、原子、离子的比较
考法七元素与原子的比较
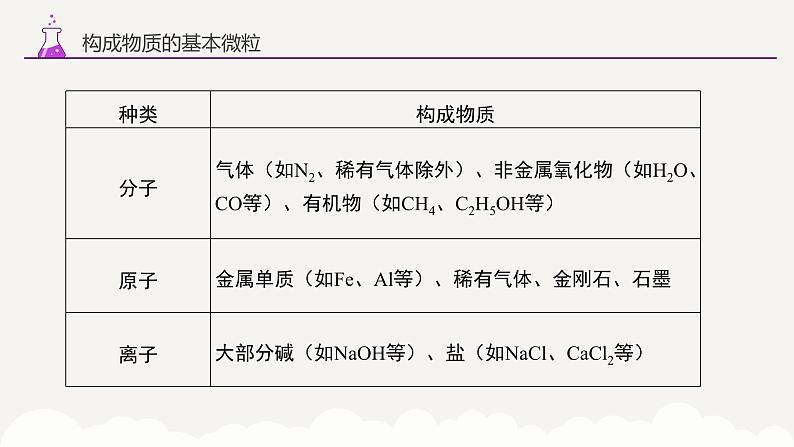
1、定义:由分子构成的物质,分子是保持物质化学性质的最小粒子。2、性质:(1)分子的质量和体积都很小。(2)分子总是在不断运动着,温度越高,运动速率越快。(3)分子之间有间隔。且温度越高,间隔越大;压强越大,间隔越小。(4)同种分子构成的物质化学性质相同,不同种分子构成的物质化学性质不同。
物体的热胀冷缩现象,是物质微粒间的间隔受热时增大,遇冷时缩小的缘故,粒子的大小不会发生改变。
3、分子运动的实验(1)现象:烧杯a中的溶液逐渐由无色变为红色(2)结论:分子在不断运动;浓氨水能使酚酞溶液变红。
1、定义:化学变化中的最小粒子(一定条件下可再分,如核裂变)。2、原子的结构(1)构成
(2)表示(原子结构示意图) 用原子结构示意图可以简明、方便地表示原子核外电子的分层排布,现以钠原子的结构示意图为例说明:
a.原子核内一定有质子,但不一定有中子(如:有一种氢原子核内只有1个质子)b.原子核内质子数不一定等于中子数c.不同种类原子的原子核内质子数不同
3、相对原子质量(1) ,其单位为“一”,符号为“1”,常省略不写。(2)相对原子质量≈质子数+中子数。(3)相对原子质量不等于原子的实际质量,是比值;原子的实际质量越大,其相对原子质量就越大。(4)原子的质量主要集中在原子核上,电子的质量很小可以忽略不计。
1、定义:带电的原子或原子团。2、分类:阳离子为带正电的原子或原子团。阴离子为带负电的原子或原子团。3、常见阳离子、阴离子(1)阳离子氢离子 H+ ;锂离子 Li+ ; 钠离子 Na+ ;镁离子 Mg2+ ; 铝离子 Al3+ ;钾离子K+ ;钙离子Ca2+ ;铵根离子NH4+(2)阴离子氧离子O2- ;氟离子F- ;硫离子 S2- ; 氯离子Cl- ; 氢氧根离子OH- ;硫酸根离子SO42- ;碳酸根离子CO32- ;硝酸根离子NO3-
4、表示:在元素符号的右上角用“+”、“-”号表示离子的电性,用数字表示离子所带的电荷数,先写数字,后写正负号,当数字为“1"时,省略不写。5、离子符号的意义表示一个离子;表示一个离子所带电荷数。如Al3+表示一个铝离子,也表示一个铝离子带3个单位正电荷。
分子、原子、离子的比较
(1)定义:质子数(即核电荷数)相同的一类原子的总称。元素属于宏观概念,只讲种类不讲个数。(2)分类
(3)在自然界中的分布(按质量分数)①地壳中含量居前四位的元素是氧、硅、铝、铁②生物体内含量最多的元素是氧;人体中含量最高的金属元素是钙③空气中含量最多的元素是氮④农作物生长必需的化学元素——氮、磷、钾
(4)元素与原子结构的关系:元素的种类由原子中的质子数决定,元素的化学性质和原子的最外层电子数密切相关(5)元素符号①写法:由一个字母表示的元素符号要大写;由两个字母表示的元素符号,第一个字母大写,第二个字母小写,即“一大二小”。
1、根据元素原子的结构与性质,按原子序数(数值上等于核电荷数)将元素进行排列。即原子序数=核电荷数=质子数=原子最外层电子数2、元素周期表结构(1)组成及规律①横行(周期) 每一个横行叫做一个周期,共7个周期;同周期元素原子的电子层数相同,最外层电子数从左至右逐渐增加。
②纵行(族)每一个纵行叫做一个族,共18个纵行,16个族(8,9,10三个纵行共同组成一个族);同族元素原子的最外层电子数相同(化学性质相似)电子层数逐渐增加。(2)单元格以氢元素为例
【例1】如图为海南某品牌矿泉水标签的部分内容。下列说法正确的是A.“钾”指的是元素B.该矿泉水显酸性C.“钠”指的是分子D.该矿泉水是纯净物
解析:A、“钾”指的是钾元素,A正确。B、该矿泉水显酸性pH值7~8,溶液显碱性,B错误。C、“钠”指的是钠元素,C错误。D、该矿泉水含有多种成分,不是纯净物,D错误。故选:A。
【例2】下列物质,由原子直接构成的是A.水 B.铜 C.氢气 D.氯化钠
解析:A、水是由非金属元素组成的化合物,是由水分子构成的,故选项错误;B、铜属于金属单质,是由铜原子直接构成的,故选项正确;C、氢气属于气态非金属单质,是由氢分子构成的,故选项错误;D、氯化钠是含有金属元素和非金属元素的化合物,氯化钠是由钠离子和氯离子构成的,故选项错误。
【例3】嫦娥五号完成我国首次月球采样任务,带回1731g月壤,月壤中含有丰富的氦3.已知氦3的质子数为2,中子数为1.氦3的核外电子数为A.1 B.2 C.3 D.4
解析:原子中,核电荷数=核外电子数=质子数,氦3的质子数为2,故核外电子数为2,故选:B。
【例4】按图所示进行实验。当观察到热水大面积变成红色时,冷水中只有品红周围变成红色。对该现象的微观解释合理的是A.温度越高,分子质量越小B.温度越高,分子体积越大C.温度越高,分子间隔越小D.温度越高,分子运动越快
解析:分子是不断运动的,分子的运动与温度有关,温度越高,分子运动越快。
【例5】生活中的下列现象,用分子的相关知识解释正确的是A.水沸腾时会掀起壶盖,是因为分子的体积变大B.篮球久置会变瘪,是因为分子的体积变小C.水在0℃时结冰不能流动,是因为分子不再运动D.40L的钢瓶可充入6000L氧气,是因为分子之间有间隔
解析:A、水沸腾时会掀起壶盖,是因为分子间的间隔变大,错误。B、篮球久置会变瘪,是因为分子在不断运动篮球内的气体分子数减少引起的,错误。C、0℃时水分子依然在运动,错误。D、因为分子间有间隔,可以被压缩。所以40L的钢瓶可充入6000L氧气。正确。故选D。
【例6】下列关于宏观事实的微观解释中,正确的是A.将二氧化碳气体制成干冰体积变小——分子体积变小B.氢气在氧气中燃烧生成水——化学反应中分子和原子都可以再分C.自然界中水的天然循环——水分子不断运动且分子间的间隔发生改变D.食物变质——食物中的分子种类不变,但分子的性质发生了变化
解析:A、二氧化碳气体制成干冰体积变小,是因为分子间隔变小的缘故,故选项解释不正确;B、氢气在氧气中燃烧生成水,是因为化学反应中分子可以再分,但原子在化学变化中不能再分,故选项解释错误;C、自然界中水的天然循环,是因为水分子是在不断的运动的,且分子间的间隔发生改变,故选项解释正确;D、食物变质属于化学变化,食物中的分子种类改变,故选项解释不正确。故选C。
【例7】下列有关分子、原子、离子、元素的说法中,正确的是A.原子都是由质子、中子、核外电子构成的B.同种元素的原子核内质子数和中子数一定相等C.氯化钠由氯离子和钠离子构成D.保持水的化学性质的最小粒子是氢原子和氧原子
解析:A.氢原子的原子核中没有中子,故错误;B.同种元素的原子核内质子数和中子数不一定相等,如氢原子核中有1个质子,没有中子,故错误;C.氯化钠由氯离子和钠离子构成,故正确;D.水由水分子构成,保持水化学性质的最小粒子是水分子,故错误。故选:C。
【例8】下列粒子结构示意图中,表示阴离子的是A. B. C. D.
解析:A、质子数(9)<电子数(2+8=10),是阴离子。B、质子数(10)=电子数(2+8=10),是原子。C、质子数(11)>电子数(2+8=10),是阳离子。D、质子数(13)>电子数(2+8=10),是阳离子。故选A。
【例9】硅元素在元素周期表中的信息如图,下列说法正确的是A.硅属于金属元素B.硅原子核内有14个质子C.硅元素的相对原子质量为28.09gD.硅元素是地壳中含量最高的元素
解析:元素周期表信息图中,元素名称的左上角的数字为元素的原子序数,右上角为元素符号,中间的汉字表示元素名称,下边是元素的相对原子质量。A、由汉字结构可知,硅元素属于非金属元素,错误;B、原子中质子数=原子序数,硅原子核内有14个质子,正确;C、硅的相对原子质量为28.1,错误;D、硅元素在地壳中含量居第二位,错误。故选B。
【例10】4月16日,我国自主研发出超流氦大型低温制冷装备,打破了发达国家的技术垄断,液氦是制造超低温的“神器”。根据图中信息判断,下列关于氦的说法正确的是A.氦属于金属元素B.氦的元素符号是HeC.氦的相对原子质量是4.003gD.氦原子容易得到电子
解析:元素周期表信息图中,元素名称的左上角的数字为元素的原子序数,右上角为元素符号,中间的汉字表示元素名称,下边是元素的相对原子质量。A、由汉字结构可知,含有“气”字旁,氦元素属于非金属元素,错误;B、氦的元素符号是He,正确;C、氦的相对原子质量是4.003,单位是“1”,不是“g”,错误;D、氦原子核外只有1个电子层,最多填2个电子,故已经达到较为稳定的结构,不容易得失电子,错误。故选B。
【例11】氮化镓是生产5G芯片的关健材料之一、氮的原子结构示意图和镓在元素周期表中的信息如图所示,下列说法错误的是A.镓是金属元素B.氮原子的核内质子数为7C.镓元素的相对原子质量是69.72gD.氮化镓中氮元素的化合价为-3价
解析:A、镓元素带“钅”字旁,属于金属元素,选项说法正确;B、由氮的原子结构示意图可知,圆圈内的数字表示质子数,所以氮原子的核内质子数为7,选项说法正确;C、根据元素周期表中一格的信息可知,元素名称下方数字表示相对原子质量,镓元素的相对原子质量是69.72,单位是“1”,不是“g”,选项说法不正确;D、由氮的原子结构示意图可知,氮原子的最外层电子数为5,大于4,在化学反应中易得到电子,而形成带3个单位负电荷的阴离子,在化合物中氮元素的化合价为-3价,选项说法正确。
【例12】制作景泰蓝的釉料中常含钴元素。钴元素在元素周期表中的信息如下图。回答问题。(1)下列有关钴元素的说法不正确的是A.原子序数是27B.属于非金属元素C.元素符号是CD.相对原子质量为58.93(2)钴原子的核外电子数是A.27B.32C.59D.86
解析:(1)A、周期表小方格左上方数字表示原子序数,A正确。B、钴带“钅”属于金属元素,B错误。C、周期表小方格右上方表示元素符号,C正确。D、小方格下方数字表示相对原子质量,D正确。故选:B。(2)原子中,原子序数=核外电子数,故选:A。
【例13】2021 年江西省自主设计的“人造太阳”首次成功放电。“人造太阳”合理利用了可控核聚变,氘、氚是核聚变的热核材料。①氘和氚属于______(选填“同种”或“不同种”)元素的原子,上表中x=______。②贮存氘气的钢瓶禁止靠近明火,据此推测氘气具有的化学性质是__________________。
解析:①氘和氚质子数均为1,属于同种元素的原子,原子中,质子数=核外电子数,上表中x=1。②贮存氘气的钢瓶禁止靠近明火,据此推测氘气具有的化学性质是易燃性(可燃性)。
【例14】请根据如图回答下列问题。(1)图中a=______。(2)碳的相对原子质量为______。(3)硅原子核外有______个电子层。(4)碳元素和硅元素的化学性质______。(填“相似”或“不相似”)
解析:(1)元素周期表中的一格可知:左上角的数字表示原子序数,即质子数,碳的质子数是6,图中a=6; (2)元素周期表中的一格可知:汉字下面的数字表示相对原子质量。碳原子的相对原子质量是12.01;(3)根据核外电子排布图,硅原子有三个电子层;(4)元素的化学性质由原子最外层电子数决定,碳原子和硅原子最外层都是4个电子,因此碳元素和硅元素化学性质相似。
相关课件
这是一份2024福建中考化学二轮中考题型研究 专题八 构成物质的微粒 认识化学元素(课件),共43页。PPT课件主要包含了福建近年真题及拓展,分子种类,分子在不断地运动,钠原子的质子数为11,Na+,S2-,金属元素,质子数或核电荷数,最外层电子数,Cl2等内容,欢迎下载使用。
这是一份构成物质的微粒-中考化学一轮专题复习课件PPT,共36页。PPT课件主要包含了考点梳理,例题精讲,实验探究,聚焦中考等内容,欢迎下载使用。
这是一份2023年中考化学一轮复习课件构成物质的微粒 认识化学元素,共21页。PPT课件主要包含了MgBr2,巩固练习,Rb2SO4等内容,欢迎下载使用。












