
所属成套资源:全套2024届高考化学复习第一章~第六章课时讲义含答案
- 2024届高考化学复习讲义第一章物质及其变化第四讲氧化还原反应的基本概念和规律考点二氧化还原反应规律含答案 学案 0 次下载
- 2024届高考化学复习讲义第一章物质及其变化第五讲氧化还原反应的配平与书写含答案 学案 0 次下载
- 2024届高考化学复习讲义第二章物质的量及计算第一讲物质的量考点二物质的量浓度含答案 学案 0 次下载
- 2024届高考化学复习讲义第二章物质的量及计算第二讲化学中的常用计算方法考点一依据化学方程式中的定量关系进行相关计算含答案 学案 0 次下载
- 2024届高考化学复习讲义第二章物质的量及计算第二讲化学中的常用计算方法考点二利用关系式法解答连续反应类计算题含答案 试卷 0 次下载
2024届高考化学复习讲义第二章物质的量及计算第一讲物质的量考点一物质的量含答案
展开
这是一份2024届高考化学复习讲义第二章物质的量及计算第一讲物质的量考点一物质的量含答案,共7页。
1.思维视角——物质组成和转化
2.思维观点
考点1 物质的量
1.物质的量(n)及相关物理量
注意 (1)物质的量是一种物理量,通过它可以把物质的质量、体积等[5] 宏观量 与原子、分子、离子等[6] 微观粒子 的数量联系起来。
(2)当粒子的摩尔质量以[7] g·ml-1 为单位时,在数值上等于该粒子的相对分子(或原子)质量。
2.以物质的量为核心的相互计算关系
拓展 求摩尔质量的方法
(1)根据物质的质量(m)和物质的量(n):M=mn。
(2)根据标准状况下气体的密度(ρ g·L-1):M=22.4ρ g·ml-1。
(3)根据气体的相对密度(D=ρ1ρ2):M1M2=D。
(4)根据一定质量(m)的物质中微粒数目(N)和阿伏加德罗常数(NA):M=NA·mN。
(5)混合气体的平均摩尔质量:M=m总n总=M1a%+M2b%+M3c%+……,其中a%、b%、c%……指混合气体中各成分的物质的量分数(或体积分数)。
3.阿伏加德罗定律及其推论
(1)阿伏加德罗定律:在同温同压下,相同体积的任何气体都含有[8] 相同数目 的分子。
(2)阿伏加德罗定律的推论
1.下列叙述正确的是 ③⑥⑦ (填序号)。
①1 ml任何微粒都含有约6.02×1023个原子
②气体摩尔体积是22.4 L·ml-1
③0.012 kg 12C中含有约6.02×1023个碳原子
④氯化钠的摩尔质量是58.5
⑤1 ml O2的质量与它的相对分子质量相等
⑥在相同条件下,相同物质的量的CO、N2的混合气体与O2的分子数相同,原子数也相同
⑦同温同体积条件下,等质量的SO2和O2的压强之比为1∶2
2.易错辨析(设NA表示阿伏加德罗常数的值,下同)。
(1)体积均为22.4 L的O2、N2、H2、CH4的分子数均为NA。( ✕ )
(2)标准状况下体积均为22.4 L的H2O、乙醇、苯、SO3的分子数均为NA。( ✕ )
(3)相同条件下,2.24 L SO2中所含原子数是2.24 L N2中所含原子数的2倍。( ✕ )
(4)相同条件下,1 ml SO2的密度是2 ml O2密度的2倍。( √ )
提示 (1)没有指明标准状况;(2)在标准状况下,H2O、乙醇、苯均为液体,SO3为固体。
3.易错辨析。
(1)[2023上海改编]28 g 28Si和28 g 14N中所含中子数相同。( √ )
(2)[全国Ⅲ高考]12 g石墨烯和12 g金刚石均含有NA个碳原子。( √ )
(3)[2021广东]11.2 L NO与11.2 L O2混合后的分子数目为NA。( ✕ )
4.[摩尔质量的计算](1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为 64 。
(2)在25 ℃、101 kPa的条件下,相同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为 30 g·ml-1 。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为 44 g·ml-1 。
(4)相同条件下,体积比为a∶b和质量比为a∶b的H2和O2的混合气体,其平均摩尔质量分别是 2a+32ba+b g·ml-1 和 32(a+b)16a+b g·ml-1 。
研透高考 明确方向
命题点1 阿伏加德罗定律及其推论的应用
1.下列说法正确的是( A )
A.[海南高考]等质量的乙烯和丙烯中含有的共用电子对数相同
B.[海南高考]同温、同压、同体积的CO和NO含有的质子数相同
C.[北京高考]同温同压下,O2和CO2的密度相同
D.[北京高考]质量相同的H2O和D2O(重水)所含的原子数相同
解析 烯烃CnH2n的共用电子对数为4n+2n2=3n,设乙烯、丙烯的质量均为m g,则共用电子对数分别为m28×6×NA=3m14NA、m42×9×NA=3m14NA,A项正确。1个CO和1个NO中的质子数分别为14和15,同温、同压、同体积的CO和NO的物质的量相等,但质子数不相等,B项错误。同温同压下气体的密度之比等于相对分子质量之比,故O2和CO2的密度不同,C项错误。H2O、D2O的摩尔质量分别为18 g·ml-1、20 g·ml-1,质量相同的H2O、D2O的物质的量不相同,因此所含原子数不相同,D项错误。
2.[2023上海杨浦区模拟]某温度下,向图中所示a、b、c、d中通入等质量的CH4、CO2、O2、SO2四种气体中的一种(已知密封隔板Ⅰ、Ⅱ、Ⅲ、Ⅳ可自由滑动,且与容器内壁摩擦不计)。下列说法错误的是( B )
A.d中通入的气体是CH4
B.a和b中原子个数之比为16∶11
C.a和c容器体积之比为1∶2
D.c和d中气体密度之比为2∶1
解析 设四种气体的质量均为m g,则CH4、CO2、O2、SO2的物质的量分别表示为m16 ml、m44 ml、m32 ml、m64 ml,同温同压下,气体体积之比=物质的量之比,物质的量越大,气体体积越大,则a、b、c、d中分别为SO2、CO2、O2、CH4。由分析可知d中通入的气体是CH4,A项正确;a、b中分别为SO2、CO2,二者物质的量之比=m64 ml∶m44 ml=11∶16,则原子个数之比=(11×3)∶(16×3)=11∶16,B项错误;a、c中分别为SO2、O2,同温同压下,气体体积之比=物质的量之比,则a和c容器体积之比=m64 ml∶m32 ml=1∶2,C项正确;c、d中分别为O2、CH4,同温同压下,两种气体的密度之比=摩尔质量之比,因此c和d中气体密度之比=32∶16=2∶1,D项正确。
命题点2 以物质的量为中心的计算
3.[2021浙江]玻璃仪器内壁残留的硫单质可用热KOH溶液洗涤除去,发生如下反应:
3S+6KOH△2K2S+K2SO3+3H2O
(x-1)S+K2S△K2Sx(x=2~6)
S+K2SO3△K2S2O3
请计算:
(1)0.480 g硫单质与V mL 1.00 ml·L-1热KOH溶液恰好完全反应,只生成K2S和K2SO3,则V= 30.0 。
(2)2.560 g硫单质与60.0 mL 1.00 ml·L-1热KOH溶液恰好完全反应,只生成K2Sx和K2S2O3,则x=3。(写出计算过程)
(2x+2)S+6KOH△ 2K2Sx+K2S2O3+3H2O
2x+2 6
0.080 ml 0.060 ml
2x+20.080ml=60.060ml,解得x=3
解析 (1)0.480 g S的物质的量为0.015 ml,与KOH恰好完全反应只生成K2S和K2SO3,消耗0.030 ml KOH,结合题给条件可列式1.00 ml·L-1×0.001V L=0.030 ml,解得V=30.0。(2)n(S)=2.560g32g·ml-1=0.080 ml,n(KOH)=0.060 L×1.00 ml·L-1=0.060 ml。由于反应只生成K2Sx和K2S2O3,结合题给反应方程式可列式:
(2x+2)S+6KOH△ 2K2Sx+K2S2O3+3H2O
2x+2 6
0.080 ml 0.060 ml
2x+20.080ml=60.060ml,解得x=3。
4.[2023河北衡水模拟]铍、铝化学性质相似,常温常压下,m g铍、铝分别与足量稀硫酸反应产生氢气的体积分别为V1 L和V2 L。下列说法正确的是( D )
A.V1V2=23
B.m=V122.4×9=V222.4×18
C.铍、铝消耗硫酸的物质的量相等
D.若相同条件下用NaOH代替硫酸,则产生的气体体积不变
解析 根据Be+2H+Be2++H2↑、2Al+6H+ 2Al3++3H2↑知,V1V2=m9m27×32=21,A项错误;V1 L、V2 L是常温常压下H2的体积,不能用22.4 L·ml-1计算其物质的量,B项错误;铍、铝消耗的硫酸的物质的量分别为m9 ml、m27×32 ml,C项错误;根据Be+2OH-+2H2O[Be(OH)4]2-+H2↑、2Al+2OH-+6H2O2[Al(OH)4]-+3H2↑知,若相同条件下用NaOH代替硫酸,产生的氢气体积不变,D项正确。课标要求
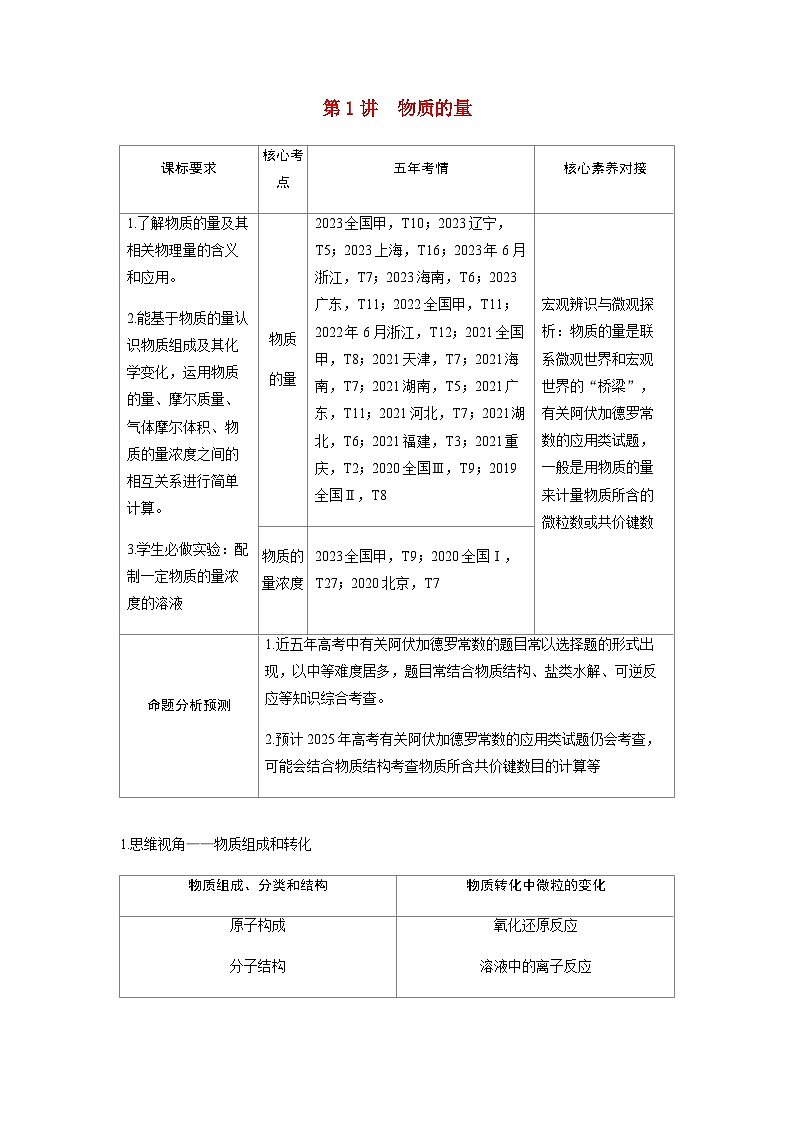
核心考点
五年考情
核心素养对接
1.了解物质的量及其相关物理量的含义和应用。
2.能基于物质的量认识物质组成及其化学变化,运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。
3.学生必做实验:配制一定物质的量浓度的溶液
物质
的量
2023全国甲,T10;2023辽宁,T5;2023上海,T16;2023年6月浙江,T7;2023海南,T6;2023广东,T11;2022全国甲,T11;2022年6月浙江,T12;2021全国甲,T8;2021天津,T7;2021海南,T7;2021湖南,T5;2021广东,T11;2021河北,T7;2021湖北,T6;2021福建,T3;2021重庆,T2;2020全国Ⅲ,T9;2019全国Ⅱ,T8
宏观辨识与微观探析:物质的量是联系微观世界和宏观世界的“桥梁”,有关阿伏加德罗常数的应用类试题,一般是用物质的量来计量物质所含的微粒数或共价键数
物质的量浓度
2023全国甲,T9;2020全国Ⅰ,T27;2020北京,T7
命题分析预测
1.近五年高考中有关阿伏加德罗常数的题目常以选择题的形式出现,以中等难度居多,题目常结合物质结构、盐类水解、可逆反应等知识综合考查。
2.预计2025年高考有关阿伏加德罗常数的应用类试题仍会考查,可能会结合物质结构考查物质所含共价键数目的计算等
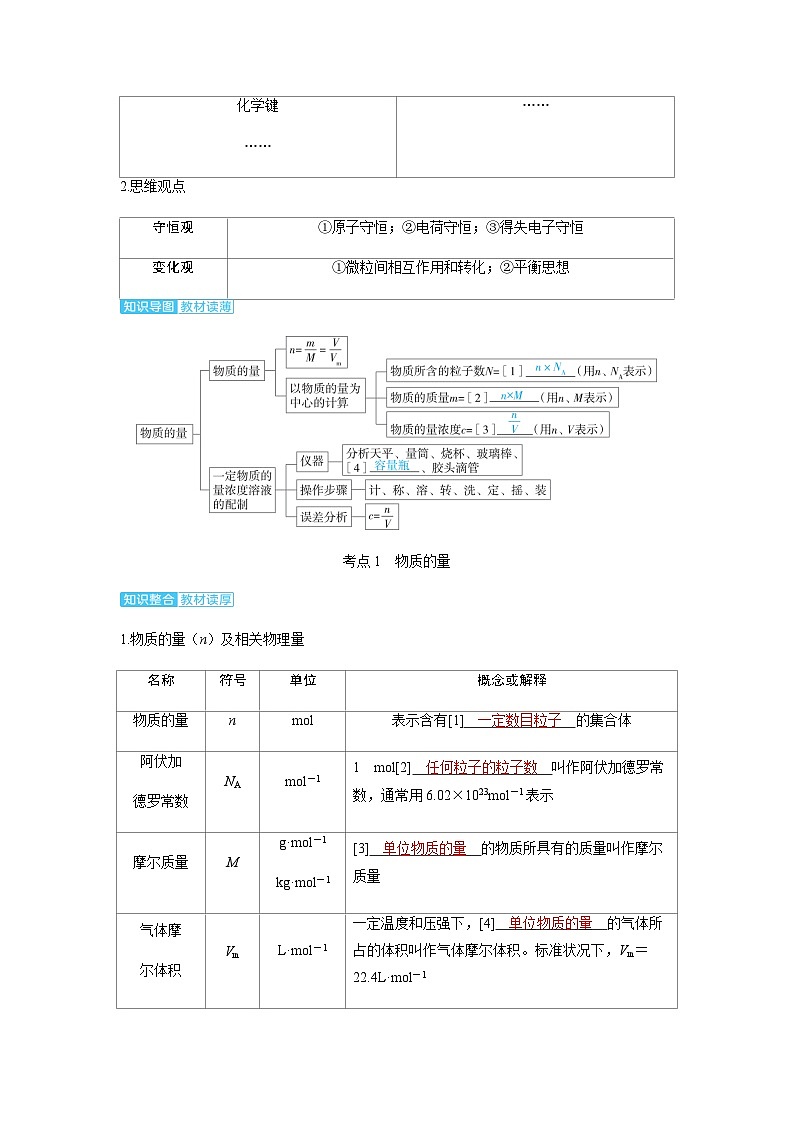
物质组成、分类和结构
物质转化中微粒的变化
原子构成
分子结构
化学键
……
氧化还原反应
溶液中的离子反应
……
守恒观
①原子守恒;②电荷守恒;③得失电子守恒
变化观
①微粒间相互作用和转化;②平衡思想
名称
符号
单位
概念或解释
物质的量
n
ml
表示含有[1] 一定数目粒子 的集合体
阿伏加
德罗常数
NA
ml-1
1 ml[2] 任何粒子的粒子数 叫作阿伏加德罗常数,通常用6.02×1023ml-1表示
摩尔质量
M
g·ml-1
kg·ml-1
[3] 单位物质的量 的物质所具有的质量叫作摩尔质量
气体摩
尔体积
Vm
L·ml-1
一定温度和压强下,[4] 单位物质的量 的气体所占的体积叫作气体摩尔体积。标准状况下,Vm=22.4L·ml-1
前提条件
推论
关系式
语言叙述
T、p相同
V1V2=n1n2
同温同压下,两气体的[9] 体积 之比等于其物质的量之比
T、p相同
ρ1ρ2=M1M2
同温同压下,两气体的[10] 密度 之比等于其摩尔质量之比
T、V相同
p1p2=n1n2
同温同体积下,两气体的[11] 压强 之比等于其物质的量之比
T、p、m相同
V1V2=M2M1
同温同压同质量下,两气体的[12] 体积 与其摩尔质量成反比
相关学案
这是一份最新高考化学考点一遍过(讲义) 考点06 一定物质的量浓度溶液的配制与计算,共17页。学案主要包含了一定物质的量浓度溶液的配制,物质的量浓度的计算方法等内容,欢迎下载使用。
这是一份最新高考化学考点一遍过(讲义) 考点05 物质的量 气体摩尔体积,共24页。学案主要包含了物质的量与阿伏加德罗常数,气体摩尔体积,阿伏加德罗定律及其推论等内容,欢迎下载使用。
这是一份高考化学 考点06 一定物质的量浓度溶液的配制与计算(含解析),共13页。学案主要包含了一定物质的量浓度溶液的配制,物质的量浓度的计算方法等内容,欢迎下载使用。








