





还剩22页未读,
继续阅读
2024春新教材高中化学第1章有机化合物的结构特点与研究方法第2节研究有机化合物的一般方法第1课时有机化合物的分离提纯课件新人教版选择性必修3
展开
这是一份2024春新教材高中化学第1章有机化合物的结构特点与研究方法第2节研究有机化合物的一般方法第1课时有机化合物的分离提纯课件新人教版选择性必修3,共30页。
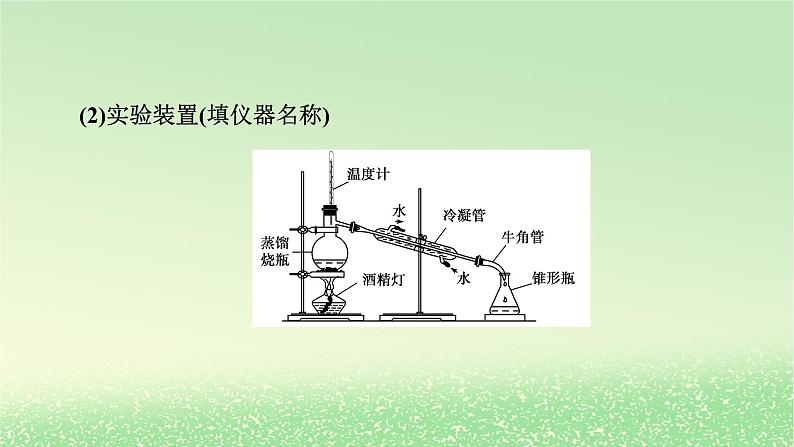
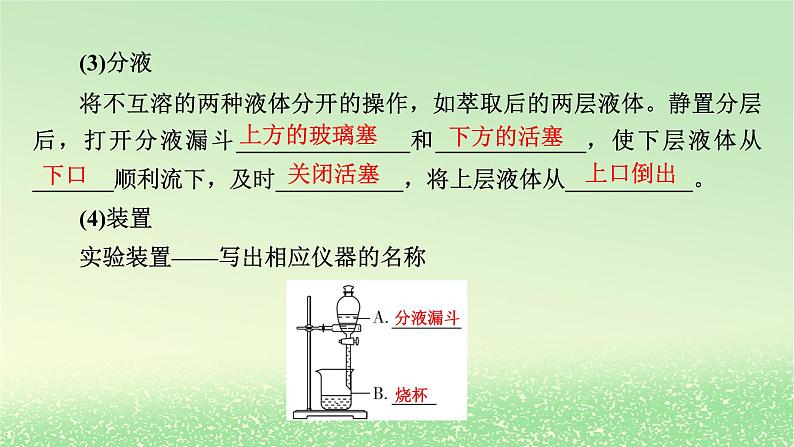
第二节 研究有机化合物的一般方法第1课时 有机化合物的分离、提纯1.通过蒸馏法、萃取法、重结晶法实验原理和基本操作的学习,认识科学探究过程的步骤,学会研究有机化合物的一般步骤和方法。2.初步学会分离提纯有机物的常规方法。科学探究与创新意识:通过实验探究蒸馏法、萃取法、重结晶法等方法在有机物分离和提纯中的应用,培养实验探究问题和自行设计实验方案解决问题的能力。 一、研究有机化合物的一般步骤_____________→确定_________→确定_________二、有机物的分离、提纯方法1.蒸馏分离和提纯_______有机化合物的常用方法。(1)适用范围分离、提纯的有机物 ,其沸点与杂质的沸点相差较大。分离、提纯实验式分子式液态(2)实验装置(填仪器名称)(3)注意事项①使用前要检查装置气密性。②蒸馏烧瓶需垫_________加热。③蒸馏时液体体积应占蒸馏烧瓶容积的___________。④蒸馏烧瓶应加入_________以防暴沸。⑤温度计水银球应位于蒸馏烧瓶的_________处。⑥冷凝水方向为_____口进,_____口出。 石棉网1/3~2/3碎瓷片支管口下上2.萃取(1)原理①液—液萃取:利用待分离组分在___________的溶剂中的_______不同,将其从一种溶剂转移到另一种溶剂的过程。②固—液萃取:用溶剂从__________中溶解出待分离组分的过程。(2)萃取剂的选择①萃取剂与原溶剂_________;②溶质在萃取剂中的溶解度_________在原溶剂中的溶解度;③萃取剂与原溶液中的成分不反应。常用萃取剂:_______、___________、___________等。两种不互溶溶解度固体物质不互溶远大于乙醚乙酸乙酯二氯甲烷(3)分液将不互溶的两种液体分开的操作,如萃取后的两层液体。静置分层后,打开分液漏斗_______________和_____________,使下层液体从_______顺利流下,及时___________,将上层液体从___________。(4)装置实验装置——写出相应仪器的名称上方的玻璃塞下方的活塞下口关闭活塞上口倒出分液漏斗烧杯3.重结晶(1)原理提纯固体有机化合物常用的方法。利用被提纯物质与杂质在同一溶剂中的_________不同而将杂质除去。(2)溶剂的选择①选择适当的溶剂,要求杂质在所选溶剂中溶解度____________,易于除去;②被提纯的有机化合物在所选溶剂中的溶解度受温度的影响_______,能够进行___________。溶解度很小或很大较大冷却结晶(3)实验探究重结晶法提纯苯甲酸,除去样品中少量的氯化钠和泥沙。【操作】【问题讨论】①重结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?答案:原理:苯甲酸在不同温度的蒸馏水中溶解度不同。主要操作步骤:加热溶解、趁热过滤、冷却结晶、过滤洗涤、干燥称量。②溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?答案:加热是为了增大苯甲酸的溶解度,使苯甲酸充分溶解。趁热过滤是为了防止苯甲酸提前结晶析出。③实验操作中多次用到了玻璃棒,分别起到了哪些作用?答案:搅拌和引流。④如何检验提纯后的苯甲酸中氯化钠已被除净?答案:用适量蒸馏水洗涤过滤器中的苯甲酸晶体,取少量第n次洗涤后的液体于小试管中,滴加几滴硝酸银溶液,观察是否有沉淀产生。若无沉淀产生,则氯化钠被除净。正误判断在括号内打“√”或“×”。(1)能用分液的方法分离植物油和水的混合物。( )(2)Br2、I2在水中的溶解度较小,但易溶于有机溶剂,故可用酒精萃取溴水中的Br2或碘水中的I2。( )(3)利用蒸馏法分离液态有机物时,温度计可以插入液面以下。( )(4)在蒸馏实验中,发现忘记加沸石,应立即停止实验,马上加入。( )(5)重结晶要求杂质的溶解度比被提纯的物质小才能进行分离。( )√××××应用体验1.(2024·包头高二检测)现有一瓶甲和乙的混合液,已知甲和乙的某些性质如表:由此推知分离甲和乙的最佳方法是( )A.萃取法 B.升华法C.蒸馏法 D.分液法C解析:由表中数据可知,甲和乙互溶,只有沸点不同,则甲和乙互相分离的最佳方法是蒸馏法。故选C。2.(1)如图是一套蒸馏装置图,图中存在的错误:_______________ ______________________________________。(2)若用蒸馏的方法分离甘油(沸点为290 ℃)和水的混合物,被蒸馏出来的物质是_____。(3)若用蒸馏的方法分离出CCl4(沸点为76.8 ℃)中含有的CH3CH2OCH2CH3(沸点为45 ℃),应控制的适宜温度为________。 温度计位置错误、冷凝管进出水方向不对、没有加碎瓷片水45 ℃3.选择下列实验方法分离、提纯物质,将分离、提纯方法的字母填在横线上。A.萃取 B.重结晶 C.分液 D.蒸馏 E.过滤 F.洗气(1)分离水和汽油的混合物:_____。(2)分离四氯化碳(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物:_____。(3)提取碘水中的碘:_____。(4)除去混在乙烷中的乙烯:_____。(5)从硝酸钾和氯化钠的混合溶液中获得硝酸钾:_____。CDAFB解析:(1)水与汽油分层。(2)四氯化碳和甲苯互溶,但沸点不同。(3)碘易溶于有机溶剂。(4)乙烯能与溴水反应,而乙烷不能。(5)硝酸钾和氯化钠的溶解度随温度的变化不同。1.分离、提纯方法的选择(1)过滤:不溶性的固体和液体。(2)蒸馏:沸点相差较大的互溶液体。(3)分液:互不相溶的液体。(4)重结晶:溶解度受温度影响较大的固体混合物。(5)蒸发:提纯溶解度随温度变化较小的溶质。(6)萃取:利用溶解性差异提取溶液中的溶质。2.结晶与重结晶比较3.色谱法当样品随着流动相经过固定相时,因样品中不同组分在两相间的分配不同而实现分离,这样的一类分离分析方法被称为色谱法。随堂演练·知识落实1.下列操作中选择的仪器正确的是( )①分离汽油和氯化钠溶液 ②从含Fe3+的自来水中得到蒸馏水③分离氯化钾和二氧化锰混合物 ④从食盐水中提取溶质AA.①—丁 ②—丙 ③—甲 ④—乙B.①—乙 ②—丙 ③—甲 ④—丁C.①—丁 ②—丙 ③—乙 ④—甲D.①—丙 ②—乙 ③—丁 ④—甲解析:分离汽油和氯化钠溶液可用分液法,即图中丁装置;从含Fe3+的自来水中得到蒸馏水,可利用蒸馏法,即图中丙装置;分离氯化钾和二氧化锰混合物,可溶解后过滤分离,即图中甲装置;从食盐水中得到氯化钠晶体,可蒸发分离,即图中乙装置,故选A。2.青蒿素是高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,甲醇、乙醇、乙醚中可溶解,在水中几乎不溶,熔点为156~157 ℃,热稳定性差。已知:乙醚的沸点为35 ℃。提取青蒿素的主要工艺如图所示:下列有关此工艺操作说法错误的是( )A.破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率B.操作Ⅰ需要用到的玻璃仪器有漏斗、烧杯、玻璃棒C.操作Ⅱ是蒸馏,利用了乙醚与青蒿素的沸点相差较大D.操作Ⅲ的主要过程是加水溶解、蒸发浓缩、冷却结晶、过滤D解析:将青蒿素干燥粉碎增大了与乙醇的接触面积,提高青蒿素的浸取率,A项正确;操作Ⅰ为过滤,用到的玻璃仪器为漏斗、烧杯、玻璃棒,B项正确;操作Ⅱ是蒸馏,乙醚与青蒿素的沸点相差较大,乙醚沸点低可回收利用,C项正确;由题意知,青蒿素在水中几乎不溶解,故D错误。3.下列实验中,所采取的分离方法与原理都正确的是( )D解析:分离溶于水中的碘,由于乙醇与水可互溶,则不能用乙醇萃取,故A错误;分离氢氧化铁胶体和氯化钠溶液,不能用过滤的方法分离,胶体、溶液均可透过滤纸,故B错误;除去KNO3溶液中混有的少量NaCl,硝酸钾的溶解度受温度变化的影响较大,NaCl的溶解度受温度变化影响小,可采用冷却结晶的方法,故C错误;除去丁醇(沸点117.5 ℃)中的甲醇(沸点64.7 ℃),两物质的沸点不同,可采用蒸馏的方法分离,故D正确。4.探究用环己烯粗品精制环己烯的方法。已知实验室制取环己烯的化学原理:(1)除去环己烯粗品中的杂质,需先加入饱和碳酸钠溶液,其主要目的是_____________________________________。除去环己烯中的酸性杂质和部分环己醇(2)加入饱和碳酸钠溶液后,振荡、静置,环己烯在上层还是下层:_______。(3)静置后如何操作:_______________________________________ __________________。该操作用到的主要仪器是_________________。上层将下层液体从分液漏斗下口放出,环己烯从分液漏斗上口倒出分液漏斗、烧杯
第二节 研究有机化合物的一般方法第1课时 有机化合物的分离、提纯1.通过蒸馏法、萃取法、重结晶法实验原理和基本操作的学习,认识科学探究过程的步骤,学会研究有机化合物的一般步骤和方法。2.初步学会分离提纯有机物的常规方法。科学探究与创新意识:通过实验探究蒸馏法、萃取法、重结晶法等方法在有机物分离和提纯中的应用,培养实验探究问题和自行设计实验方案解决问题的能力。 一、研究有机化合物的一般步骤_____________→确定_________→确定_________二、有机物的分离、提纯方法1.蒸馏分离和提纯_______有机化合物的常用方法。(1)适用范围分离、提纯的有机物 ,其沸点与杂质的沸点相差较大。分离、提纯实验式分子式液态(2)实验装置(填仪器名称)(3)注意事项①使用前要检查装置气密性。②蒸馏烧瓶需垫_________加热。③蒸馏时液体体积应占蒸馏烧瓶容积的___________。④蒸馏烧瓶应加入_________以防暴沸。⑤温度计水银球应位于蒸馏烧瓶的_________处。⑥冷凝水方向为_____口进,_____口出。 石棉网1/3~2/3碎瓷片支管口下上2.萃取(1)原理①液—液萃取:利用待分离组分在___________的溶剂中的_______不同,将其从一种溶剂转移到另一种溶剂的过程。②固—液萃取:用溶剂从__________中溶解出待分离组分的过程。(2)萃取剂的选择①萃取剂与原溶剂_________;②溶质在萃取剂中的溶解度_________在原溶剂中的溶解度;③萃取剂与原溶液中的成分不反应。常用萃取剂:_______、___________、___________等。两种不互溶溶解度固体物质不互溶远大于乙醚乙酸乙酯二氯甲烷(3)分液将不互溶的两种液体分开的操作,如萃取后的两层液体。静置分层后,打开分液漏斗_______________和_____________,使下层液体从_______顺利流下,及时___________,将上层液体从___________。(4)装置实验装置——写出相应仪器的名称上方的玻璃塞下方的活塞下口关闭活塞上口倒出分液漏斗烧杯3.重结晶(1)原理提纯固体有机化合物常用的方法。利用被提纯物质与杂质在同一溶剂中的_________不同而将杂质除去。(2)溶剂的选择①选择适当的溶剂,要求杂质在所选溶剂中溶解度____________,易于除去;②被提纯的有机化合物在所选溶剂中的溶解度受温度的影响_______,能够进行___________。溶解度很小或很大较大冷却结晶(3)实验探究重结晶法提纯苯甲酸,除去样品中少量的氯化钠和泥沙。【操作】【问题讨论】①重结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?答案:原理:苯甲酸在不同温度的蒸馏水中溶解度不同。主要操作步骤:加热溶解、趁热过滤、冷却结晶、过滤洗涤、干燥称量。②溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?答案:加热是为了增大苯甲酸的溶解度,使苯甲酸充分溶解。趁热过滤是为了防止苯甲酸提前结晶析出。③实验操作中多次用到了玻璃棒,分别起到了哪些作用?答案:搅拌和引流。④如何检验提纯后的苯甲酸中氯化钠已被除净?答案:用适量蒸馏水洗涤过滤器中的苯甲酸晶体,取少量第n次洗涤后的液体于小试管中,滴加几滴硝酸银溶液,观察是否有沉淀产生。若无沉淀产生,则氯化钠被除净。正误判断在括号内打“√”或“×”。(1)能用分液的方法分离植物油和水的混合物。( )(2)Br2、I2在水中的溶解度较小,但易溶于有机溶剂,故可用酒精萃取溴水中的Br2或碘水中的I2。( )(3)利用蒸馏法分离液态有机物时,温度计可以插入液面以下。( )(4)在蒸馏实验中,发现忘记加沸石,应立即停止实验,马上加入。( )(5)重结晶要求杂质的溶解度比被提纯的物质小才能进行分离。( )√××××应用体验1.(2024·包头高二检测)现有一瓶甲和乙的混合液,已知甲和乙的某些性质如表:由此推知分离甲和乙的最佳方法是( )A.萃取法 B.升华法C.蒸馏法 D.分液法C解析:由表中数据可知,甲和乙互溶,只有沸点不同,则甲和乙互相分离的最佳方法是蒸馏法。故选C。2.(1)如图是一套蒸馏装置图,图中存在的错误:_______________ ______________________________________。(2)若用蒸馏的方法分离甘油(沸点为290 ℃)和水的混合物,被蒸馏出来的物质是_____。(3)若用蒸馏的方法分离出CCl4(沸点为76.8 ℃)中含有的CH3CH2OCH2CH3(沸点为45 ℃),应控制的适宜温度为________。 温度计位置错误、冷凝管进出水方向不对、没有加碎瓷片水45 ℃3.选择下列实验方法分离、提纯物质,将分离、提纯方法的字母填在横线上。A.萃取 B.重结晶 C.分液 D.蒸馏 E.过滤 F.洗气(1)分离水和汽油的混合物:_____。(2)分离四氯化碳(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物:_____。(3)提取碘水中的碘:_____。(4)除去混在乙烷中的乙烯:_____。(5)从硝酸钾和氯化钠的混合溶液中获得硝酸钾:_____。CDAFB解析:(1)水与汽油分层。(2)四氯化碳和甲苯互溶,但沸点不同。(3)碘易溶于有机溶剂。(4)乙烯能与溴水反应,而乙烷不能。(5)硝酸钾和氯化钠的溶解度随温度的变化不同。1.分离、提纯方法的选择(1)过滤:不溶性的固体和液体。(2)蒸馏:沸点相差较大的互溶液体。(3)分液:互不相溶的液体。(4)重结晶:溶解度受温度影响较大的固体混合物。(5)蒸发:提纯溶解度随温度变化较小的溶质。(6)萃取:利用溶解性差异提取溶液中的溶质。2.结晶与重结晶比较3.色谱法当样品随着流动相经过固定相时,因样品中不同组分在两相间的分配不同而实现分离,这样的一类分离分析方法被称为色谱法。随堂演练·知识落实1.下列操作中选择的仪器正确的是( )①分离汽油和氯化钠溶液 ②从含Fe3+的自来水中得到蒸馏水③分离氯化钾和二氧化锰混合物 ④从食盐水中提取溶质AA.①—丁 ②—丙 ③—甲 ④—乙B.①—乙 ②—丙 ③—甲 ④—丁C.①—丁 ②—丙 ③—乙 ④—甲D.①—丙 ②—乙 ③—丁 ④—甲解析:分离汽油和氯化钠溶液可用分液法,即图中丁装置;从含Fe3+的自来水中得到蒸馏水,可利用蒸馏法,即图中丙装置;分离氯化钾和二氧化锰混合物,可溶解后过滤分离,即图中甲装置;从食盐水中得到氯化钠晶体,可蒸发分离,即图中乙装置,故选A。2.青蒿素是高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,甲醇、乙醇、乙醚中可溶解,在水中几乎不溶,熔点为156~157 ℃,热稳定性差。已知:乙醚的沸点为35 ℃。提取青蒿素的主要工艺如图所示:下列有关此工艺操作说法错误的是( )A.破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率B.操作Ⅰ需要用到的玻璃仪器有漏斗、烧杯、玻璃棒C.操作Ⅱ是蒸馏,利用了乙醚与青蒿素的沸点相差较大D.操作Ⅲ的主要过程是加水溶解、蒸发浓缩、冷却结晶、过滤D解析:将青蒿素干燥粉碎增大了与乙醇的接触面积,提高青蒿素的浸取率,A项正确;操作Ⅰ为过滤,用到的玻璃仪器为漏斗、烧杯、玻璃棒,B项正确;操作Ⅱ是蒸馏,乙醚与青蒿素的沸点相差较大,乙醚沸点低可回收利用,C项正确;由题意知,青蒿素在水中几乎不溶解,故D错误。3.下列实验中,所采取的分离方法与原理都正确的是( )D解析:分离溶于水中的碘,由于乙醇与水可互溶,则不能用乙醇萃取,故A错误;分离氢氧化铁胶体和氯化钠溶液,不能用过滤的方法分离,胶体、溶液均可透过滤纸,故B错误;除去KNO3溶液中混有的少量NaCl,硝酸钾的溶解度受温度变化的影响较大,NaCl的溶解度受温度变化影响小,可采用冷却结晶的方法,故C错误;除去丁醇(沸点117.5 ℃)中的甲醇(沸点64.7 ℃),两物质的沸点不同,可采用蒸馏的方法分离,故D正确。4.探究用环己烯粗品精制环己烯的方法。已知实验室制取环己烯的化学原理:(1)除去环己烯粗品中的杂质,需先加入饱和碳酸钠溶液,其主要目的是_____________________________________。除去环己烯中的酸性杂质和部分环己醇(2)加入饱和碳酸钠溶液后,振荡、静置,环己烯在上层还是下层:_______。(3)静置后如何操作:_______________________________________ __________________。该操作用到的主要仪器是_________________。上层将下层液体从分液漏斗下口放出,环己烯从分液漏斗上口倒出分液漏斗、烧杯
相关资料
更多









