

- 2024福州一中高三上学期期末考试政治含解析 试卷 0 次下载
- 2024福州一中高三上学期期末考试地理含解析 试卷 0 次下载
- 2024福州一中高三上学期期末考试历史含答案 试卷 0 次下载
- 2024福州一中高三上学期期末考试生物含解析 试卷 0 次下载
- 2024福州一中高三上学期期末考试物理含解析 试卷 0 次下载
2024福州一中高三上学期期末考试化学含解析
展开(完卷75分钟 满分100分)
可能用到的相对原子质量:H-1 Li-7 C-12 O-16 S-32 Cl-35.5 Ti-48 Fe-56
第Ⅰ卷 选择题(共40分)
每题只有一个选项是正确的,每题4分,共40分,请将答案填涂在答题卷上。
1. 化学与生产、生活密切相关。下列过程中没有发生化学变化的是
A. 水滴石穿
B. 用沾有KMnO4的硅藻土做水果保鲜剂
C. 肥皂水作蚊虫叮咬处的清洗剂
D. NaCl固体加入蛋白质溶液中生成沉淀
2. 化学用语可以表达化学过程,下列化学用语的表达错误的是
A. 分子的VSEPR模型:
B. 中子数为10的氧原于:
C. 用电子云轮廓图表示的键形成的示意图:
D. 用电子式表示的形成:
3. 蛇烯醇(Serpentenynenynl)的结构如图所示,特别像一条蛇。下列关于蛇烯醇说法错误的是
A. 蛇烯醇可以使酸性高锰酸钾溶液褪色,说明其结构中含有碳碳双键或碳碳三键
B. 1ml该物质与足量溴水反应,最多可消耗6ml
C. 蛇烯醇中碳原子有sp、和三种杂化方式
D. 蛇烯醇可以进行催化氧化反应,得到醛类物质
4. 离子液体在合成与催化、电化学、功能助剂、溶剂、分离过程、分析测试、功能材料等领域广泛应用,一种由短周期主族元素构成的典型离子液体阴离子结构如图所示,其中Y、X、Q、W是原子序数依次增大的同一周期元素。下列说法正确的是
A. 该阴离子中所有原子均达到8电子稳定结构
B. 该阴离子中X、Y两种原子的杂化方式相同
C. 氢化物的沸点:Y
5. 下列反应离子方程式不正确的是
A. 向饱和氯化钠溶液中依次通入足量NH3和CO2:Na++NH3+CO2+H2O=NaHCO3↓+NH
B. 电解CuSO4溶液的总反应(石墨作阳极、铁作阴极):2Cu2++2H2O2Cu+4H++O2↑
C. FeO与稀硝酸的反应:3FeO+10H++NO=3Fe3++NO↑+5H2O
D. 硫酸氢钠溶液中滴加过量的氢氧化钡溶液:2H++SO+Ba2++2OH-=BaSO4↓+2H2O
6. 设为阿伏加德罗常数的值,下列说法正确的是
A. 溶液中所含数目为
B. 中杂化的碳原子数目为1
C. 标准状况下,中含有的电子数目为
D. 常温下,将投入足量浓硝酸中,反应转移电子数目为
7. 下列实验装置能达到实验目的的是
A. 图1制备乙炔气体B. 图2盐酸滴定氨水
C. 图3制备干燥氨气D. 图4配制氢氧化钠溶液
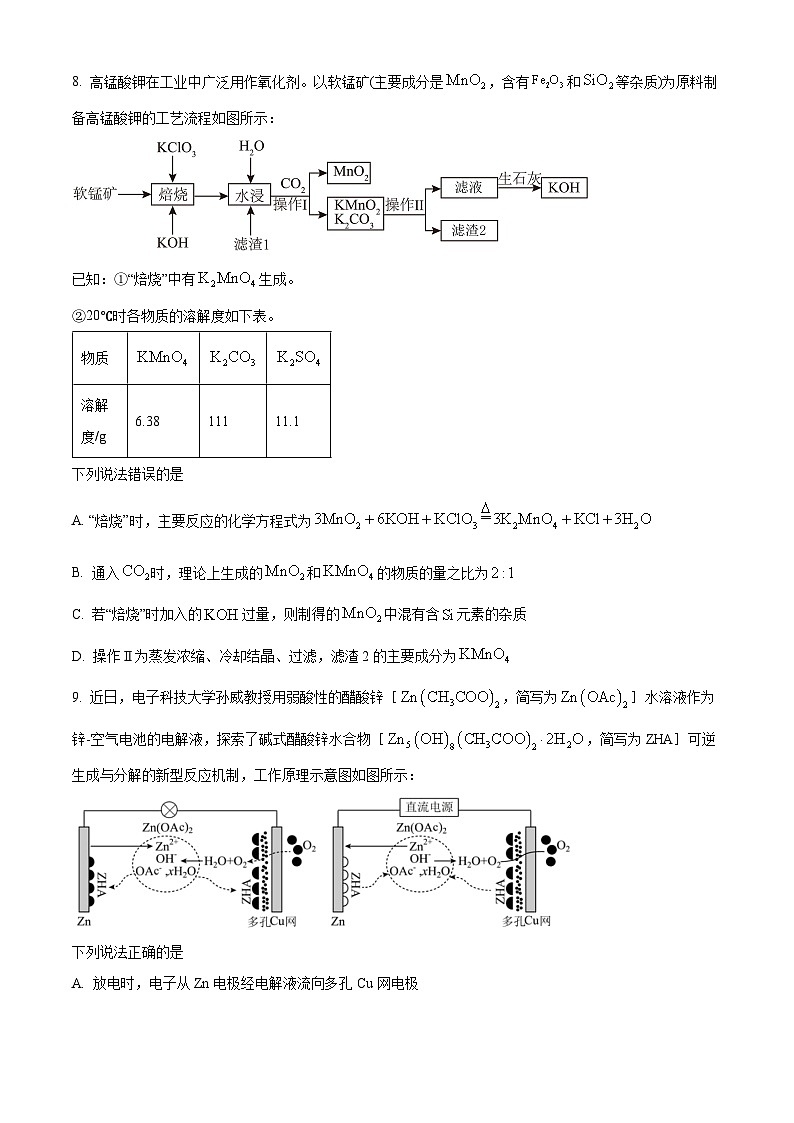
8. 高锰酸钾在工业中广泛用作氧化剂。以软锰矿(主要成分是,含有和等杂质)为原料制备高锰酸钾的工艺流程如图所示:
已知:①“焙烧”中有生成。
②20℃时各物质的溶解度如下表。
下列说法错误的是
A. “焙烧”时,主要反应的化学方程式为
B. 通入时,理论上生成的和的物质的量之比为
C. 若“焙烧”时加入的过量,则制得的中混有含元素的杂质
D. 操作Ⅱ为蒸发浓缩、冷却结晶、过滤,滤渣2的主要成分为
9. 近日,电子科技大学孙威教授用弱酸性的醋酸锌[,简写为]水溶液作为锌-空气电池的电解液,探索了碱式醋酸锌水合物[,简写为ZHA]可逆生成与分解的新型反应机制,工作原理示意图如图所示:
下列说法正确的是
A. 放电时,电子从Zn电极经电解液流向多孔Cu网电极
B. 充电时,多孔Cu网电极的电极反应式为
C. 放电时的电池总反应为
D. 与多孔Cu网电极相比,放电时,Zn电极电势低,充电时,Zn电极电势高
10. 某研究小组利用电位滴定法研究盐酸滴定亚磷酸钠()溶液过程中的化学变化,得到电极电位U和溶液pH随盐酸滴加的体积变化曲线如图所示。下列说法正确的是
[已知:①电位滴定法的原理:在化学计量点附近,被测离子浓度发生突跃,指示电极j电位也发生了突跃,进而确定滴定终点。②亚磷酸()是二元弱酸,其电离常数分别是,]
A. a点对应溶液的溶质为和NaCl,pH>7
B. 第二次电极电位突跃发生的离子反应为
C. 水的电离程度:
D. c点对应的溶液中一定存在:
第Ⅱ卷 非选择题(共60分)
11. 从铜电解液分离出的粗硫酸镍晶体中含有大量的杂质元素(Cu、Fe、As、Ca、Zn等),我国科学家对粗硫酸镍进行精制提纯,其工艺流程如下。
已知:
i.含镍溶液中的主要离子有:、、、、、和
ii.部分物质的电离常数和溶度积常数如下表。回答下列问题:
(1)将粗硫酸镍溶液的pH调小至0.5,加入的试剂是___________。
(2)滤渣1中除CuS外,还含有和S。反应生成和S的离子方程式是:______。
(3)“氧化除杂”时,加入的目的___________。
(4)用沉淀溶解平衡原理解释用能够“氟化除杂”的原因___________。
(5)含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。
①将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是___________(填标号)。
A. B. C. D.
②如图是硫的四种含氧酸根的结构:
根据组成和结构推断,能在酸性溶液中将转化为的是___________(填标号)。理由是___________。
③如图是CZTS四元半导体化合物的四方晶胞。该物质的化学式为___________。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若图中A原子的坐标为,则B的原子坐标为___________。
12. 钛在医疗领域的使用非常广泛,如制人造关节、头盖、主动心瓣等。是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备 (夹持装置略去)。
已知:HCl与不发生反应;装置C中除生成外,同时还生成一种有毒气态氧化物和少量其它相关信息如下表所示:
请回答下列问题:
(1)装置A中导管a的作用为___________,装置B中所盛试剂为___________,装置A中发生反应的离子方程式为___________(反应后Mn元素以形式存在)。
(2)组装好仪器后,部分实验步骤如下:
a.装入药品 b.打开分液漏斗活塞 c.检查装置气密性 d.关闭分液漏斗活塞 e.停止加热,充分冷却 f.加热装置C中陶瓷管
从上述选项选择合适操作(不重复使用)并排序:___________→___________→b→___________→___________→d。__________
(3)下列说法不正确的是___________。
A.通入氯气之前,最好先从k处通入氮气,否则实验会失败
B.石棉绒载体是为了增大气体与、碳粉的接触面积,以加快反应速率
C.装置D中的烧杯中可加入冰水,便于收集到纯的液态
D.装置E可防止空气中的水蒸气进入装置D的圆底烧瓶中使变质
E.该装置有缺陷,通过装置E后气体不可直接排放到空气中
(4)可制备纳米:以为载体,用和水蒸气反应生成。再控制温度生成纳米。测定产物组成的方法如下:
步骤一:取样品2.100g用稀硫酸充分溶解得到,再用足量铝将还原为,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,定容得到待测液。
步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用的标准溶液滴定,将氧化为,三次滴定消耗标准溶液的平均值为24.00mL。
①滴定终点的判断方法是___________。
②通过分析、计算,该样品的组成为___________。
13. 航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用。
Sabatier反应:CO2(g)+4H2(g)CH4(g)+2H2O(g)
水电解反应:2H2O(g)=2H2(g)+O2(g)
一种新的循环利用方案是用Bsch反应CO2(g)+2H2(g)C(s)+2H2O(g) ΔH<0代替Sabatier反应,再电解水实现O2的循环利用。
回答下列问题:
(1)有关上述反应,下列说法正确的是_____(填标号)。
A.室温下,2H2O(g)⇌2H2(g)+O2(g)不能自发进行的原因为ΔS<0
B.可逆反应都有一定的限度,限度越大反应物的转化率一定越高
C.可逆反应中,若反应物的总能量>生成物的总能量,则ΔH<0
(2)在Sabatier反应[反应Ⅰ:CO2(g)+4H2(g) CH4(g)+2H2O(g) KⅠ]体系中,还会发生副反应(反应Ⅱ):CO2(g)+H2(g) CO(g)+H2O(g) KⅡ;一定压强下,向某容积可变的密闭容器中通入CO2和H2的混合气体(其中CO2和H2的物质的量之比为1∶4),在某催化剂的作用下同时发生反应Ⅰ和反应Ⅱ,测得CO2的转化率、CH4的选择性、CO的选择性随反应温度的变化情况如图所示。
已知:CH4或CO的选择性指反应生成CH4或CO时所消耗的CO2的物质的量占参与反应的CO2总物质的量的百分比。相同温度下,反应2CO(g)+2H2(g)⇌CO2(g)+CH4(g)的平衡常数为_____(用含KⅠ、KⅡ的式子表示);提高CH4的选择性的措施有_____、_____。
(3)对于Bsch反应CO2(g)+2H2(g)⇌C(s)+2H2O(g) ΔH<0,下列关于各图像的解释或得出的结论正确的是_____(填标号)。
A. 由甲图可知,反应在t1min时可能改变了压强或使用了催化剂
B. 由乙图可知,反应在m点可能达到了平衡状态
C. 由丙图可知,反应过程中v正>v逆的点是C点
D. 由丁图可知,交点A表示的反应一定处于平衡状态
(4)室温下,向体积为2L的恒容密闭容器中通入4mlH2和1mlCO2发生Sabatier反应:CO2(g)+4H2(g) CH4(g)+2H2O(g)(不考虑副反应);若反应时保持温度恒定,测得反应过程中压强随时间的变化如下表所示:
①0~10min内,v(CO2)=_____ml·L-1·min-1,该温度下Sabatier反应的Kp=_____(Kp为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)。
②Sabatier反应的速率方程:v正=k正c(CO2)c4(H2),v逆=k逆c(CH4)c2(H2O)(k是速率常数,只与温度有关)。20min时,_____;反应达平衡时,升高温度,k正增大的倍数_____k逆增大的倍数。(填“>”“<”或“=”)
14. 有机化合物H是一种医药合成中间体,其合成路线如图所示:
回答下列问题:
(1)A含有的官能团名称:______。
(2)C的分子式:______。
(3)E→G的反应类型为______。
(4)D→F分两步完成,其中D与NaOH反应的化学方程式为______。
(5)H在酸或碱存在并加热条件下可以发生水解反应,若在盐酸作用下水解,其生成物中属于盐的结构为______。
(6)溴代乙酸乙酯有多种同分异构体,其中与其具有相同官能团的结构还有______种(不考虑立体异构、不考虑Br-直接与-COO-相连)。物质
溶解度/g
6.38
111
11.1
物质
溶度积常数
物质
溶度积常数
物质
溶度积常数
CuS
NiS
FeS
熔点/℃
沸点/℃
密度/(g/cm3)
水溶性
-24
136.4
1.7
易水解生成白色沉淀,能溶于有机溶剂
-23
76.8
1.6
难溶于水
时间/min
0
10
20
30
40
50
60
压强
5.00p
4.60p
4.30p
4.15p
4.06p
400p
4.00p
福州一中2023-2024学年第一学期第二学段模块考试
高三化学学科期末试卷
(完卷75分钟 满分100分)
可能用到的相对原子质量:H-1 Li-7 C-12 O-16 S-32 Cl-35.5 Ti-48 Fe-56
第Ⅰ卷 选择题(共40分)
每题只有一个选项是正确的,每题4分,共40分,请将答案填涂在答题卷上。
1. 化学与生产、生活密切相关。下列过程中没有发生化学变化的是
A. 水滴石穿
B. 用沾有KMnO4的硅藻土做水果保鲜剂
C. 肥皂水作蚊虫叮咬处的清洗剂
D. NaCl固体加入蛋白质溶液中生成沉淀
【答案】D
【解析】
【详解】A.水滴石穿是指滴水产生的力在不断的作用在石头上,时间长了和碳酸钙、二氧化碳反应生成溶于水的碳酸氢钙,使石头上出现了小孔,有新物质生成,属于化学变化,A错误;
B.水果释放出的乙烯能催熟水果,高锰酸钾能氧化乙烯,所以用浸有酸性高锰酸钾的硅藻土作水果保鲜剂,与氧化还原反应有关,B错误;
C.肥皂水显碱性,与蚊虫叮咬处释放的酸发生中和反应,发生了化学反应,C错误;
D.蛋白质溶液中加入饱和NaCl溶液发生盐析,没有新物质生成,属于物理变化,D正确;
故合理选项是D。
2. 化学用语可以表达化学过程,下列化学用语的表达错误的是
A. 分子的VSEPR模型:
B. 中子数为10的氧原于:
C. 用电子云轮廓图表示的键形成的示意图:
D. 用电子式表示的形成:
【答案】A
【解析】
【详解】A. 的孤电子对为=1,所以其VSEPR模型为四面体结构,A错误;
B. 核素符号中左上角表示质量数,左下角代表质子数,O的质子数为8,质量数=质子数+中子数=8+10=18,B正确;
C. 每个H原子核外1s能级的电子经过“头碰头”方式结合形成键,C正确;
D. K2S中钾原子失去电子,硫原子得到电子形成离子键,其电子式表示的形成过程规范正确,D正确;
故选A。
3. 蛇烯醇(Serpentenynenynl)的结构如图所示,特别像一条蛇。下列关于蛇烯醇说法错误的是
A. 蛇烯醇可以使酸性高锰酸钾溶液褪色,说明其结构中含有碳碳双键或碳碳三键
B. 1ml该物质与足量溴水反应,最多可消耗6ml
C. 蛇烯醇中碳原子有sp、和三种杂化方式
D 蛇烯醇可以进行催化氧化反应,得到醛类物质
【答案】A
【解析】
【详解】A.蛇烯醇能够使酸性高锰酸钾褪色的结构除了碳碳双键、碳碳三键还有羟基,A错误;
B.1ml该物质中含有2ml碳碳双键和2ml碳碳三键,1ml碳碳双键加成消耗1ml,1ml碳碳三键加成消耗2ml,因此1ml该物质与足量溴水反应,最多可消耗6ml,B正确;
C.双键碳是杂化,三键碳为sp杂化,饱和碳原子为杂化,C正确;
D.蛇烯醇结构中连有羟基的碳上还有2个氢原子,故可以发生催化氧化且得到醛类物质,D正确;
故选A。
4. 离子液体在合成与催化、电化学、功能助剂、溶剂、分离过程、分析测试、功能材料等领域广泛应用,一种由短周期主族元素构成的典型离子液体阴离子结构如图所示,其中Y、X、Q、W是原子序数依次增大的同一周期元素。下列说法正确的是
A. 该阴离子中所有原子均达到8电子稳定结构
B. 该阴离子中X、Y两种原子的杂化方式相同
C. 氢化物的沸点:Y
【答案】B
【解析】
【分析】Y、X、Q、W是原子序数依次增大的同一周期元素,根据结构式成键方式可知Y为C,X为N,Q为O,W为F,Z为S;
【详解】A.根据结构式可知,该阴离子中S元素不符合8电子稳定结构,A错误;
B.Y为C,成4个共价单键,采取sp3杂化,X为N,成2个共价单键,有2对孤电子对,采取sp3杂化,该阴离子中X、Y两种原子的杂化方式相同,B正确;
C.Z、W对应得氢化物分别为:、,但Y的氢化物是碳原子数不确定的烃类,因此无法比较氢化物的沸点,C错误;
D.电离能第VA族>第VIA族,Y、X、Q三种元素的第一电离能:N>O>C即X>Q>Y,D错误;
故选B。
5. 下列反应的离子方程式不正确的是
A. 向饱和氯化钠溶液中依次通入足量NH3和CO2:Na++NH3+CO2+H2O=NaHCO3↓+NH
B. 电解CuSO4溶液的总反应(石墨作阳极、铁作阴极):2Cu2++2H2O2Cu+4H++O2↑
C. FeO与稀硝酸的反应:3FeO+10H++NO=3Fe3++NO↑+5H2O
D. 硫酸氢钠溶液中滴加过量的氢氧化钡溶液:2H++SO+Ba2++2OH-=BaSO4↓+2H2O
【答案】D
【解析】
【详解】A.向饱和氯化钠溶液中依次通入足量NH3和CO2,发生反应生成NaHCO3晶体和氯化铵,反应的离子方程式为:Na++NH3+CO2+H2O=NaHCO3↓+NH,A正确;
B.电解CuSO4溶液,在阳极上水电离产生的氢氧根离子失去电子产生氧气,阴极上铜离子得电子生成单质铜,总反应(石墨作阳极、铁作阴极)为:2Cu2++2H2O2Cu+4H++O2↑,B正确;
C.FeO与稀硝酸发生氧化还原反应,产生硝酸铁、一氧化氮和水,离子方程式为:3FeO+10H++NO=3Fe3++NO↑+5H2O,C正确;
D.硫酸氢钠溶液中滴加过量的氢氧化钡溶液,离子方程式为:H++SO+Ba2++OH-=BaSO4↓+H2O,D错误;
答案选D。
6. 设为阿伏加德罗常数的值,下列说法正确的是
A. 溶液中所含数目为
B. 中杂化的碳原子数目为1
C. 标准状况下,中含有的电子数目为
D. 常温下,将投入足量浓硝酸中,反应转移电子数目为
【答案】B
【解析】
【详解】A.溶液中铜元素以四氨合铜离子存在,不存在单独的,A错误;
B.CH3CHO中甲基中碳原子采用sp3杂化,醛基上碳原子采用sp2杂化,(为1ml)中杂化的碳原子数目为1,B正确;
C.标准状况下HF为液体,故无法计算中含有的电子数目,C错误;
D.常温下Fe遇到浓硝酸将发生钝化,将投入足量浓硝酸中,无法计算反应转移电子数目,D错误;
故选B。
7. 下列实验装置能达到实验目的的是
A. 图1制备乙炔气体B. 图2盐酸滴定氨水
C. 图3制备干燥氨气D. 图4配制氢氧化钠溶液
【答案】B
【解析】
【详解】A.电石是粉末状的会从启普发生器中间的间隙中漏到食盐水中,启普发生器条件必须是块状固体,并且不溶于水, A不符合题意;
B.盐酸滴定氨水,生成,指示剂选择甲基橙,B符合题意;
C.要与氯化钙反应,因此不能用无水氯化钙干燥,C不符合题意;
D.溶解不能在容量瓶中进行,D不符合题意;
故选B。
8. 高锰酸钾在工业中广泛用作氧化剂。以软锰矿(主要成分是,含有和等杂质)为原料制备高锰酸钾的工艺流程如图所示:
已知:①“焙烧”中有生成。
②20℃时各物质的溶解度如下表。
下列说法错误是
A. “焙烧”时,主要反应的化学方程式为
B. 通入时,理论上生成的和的物质的量之比为
C. 若“焙烧”时加入的过量,则制得的中混有含元素的杂质
D. 操作Ⅱ为蒸发浓缩、冷却结晶、过滤,滤渣2的主要成分为
【答案】B
【解析】
【分析】软锰矿(主要成分是,含有和等杂质)与KClO3在强碱性条件下焙烧,反应生成氯化钾、锰酸钾和水,反应后的固体加水溶解,得到滤渣为氧化铁和二氧化硅,滤液含有锰酸钾,通入二氧化碳后,在酸性条件下,锰酸钾发生歧化反应得到二氧化锰固体和锰酸钾、碳酸钾,根据锰酸钾、碳酸钾的溶解度差别较大,可以采取蒸发浓缩、冷却结晶,过滤得到高锰酸钾固体和碳酸钾,碳酸钾加入生石灰后,得到氢氧化钾,据以上分析解答。
【详解】A.“焙烧”中有K2MnO4生成,该步骤主要反应的化学方程式为:,故A正确;
B.通入后,在酸性条件下,锰酸钾发生歧化反应得到二氧化锰固体和锰酸钾、碳酸钾,根据得失电子守恒和原子守恒配平化学方程式为:3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO3,理论上生成和的物质的量之比为,故B错误;
C.若“焙烧”时加入的过量,SiO2也能和NaOH反应生成Na2SiO3,导致制得的中混有含元素的杂质,故C正确;
D.根据表格中的溶解度,KMnO4的溶解度远小于K2CO3,可用重结晶的方法将它们分离,操作的方法是蒸发浓缩、冷却结晶、过滤,故D正确;
故选B。
9. 近日,电子科技大学孙威教授用弱酸性的醋酸锌[,简写为]水溶液作为锌-空气电池的电解液,探索了碱式醋酸锌水合物[,简写为ZHA]可逆生成与分解的新型反应机制,工作原理示意图如图所示:
下列说法正确的是
A. 放电时,电子从Zn电极经电解液流向多孔Cu网电极
B. 充电时,多孔Cu网电极的电极反应式为
C. 放电时的电池总反应为
D. 与多孔Cu网电极相比,放电时,Zn电极电势低,充电时,Zn电极电势高
【答案】C
【解析】
【分析】原电池锌作为负极,铜作为正极,电子从导线流向铜棒,电解池中锌作为阴极得电子,铜作为阳极失去电子。
【详解】A.放电时,电子从Zn电极经导线流向多孔Cu网电极,故A错误;
B.充电时,多孔Cu网电极的电极反应式为,故B错误;
C.放电时的电池总反应为,故C正确;
D.与多孔Cu网电极相比,放电时,Zn电极是负极电势低,充电时,Zn电极电势低,故D错误;
故选:C。
10. 某研究小组利用电位滴定法研究盐酸滴定亚磷酸钠()溶液过程中的化学变化,得到电极电位U和溶液pH随盐酸滴加的体积变化曲线如图所示。下列说法正确的是
[已知:①电位滴定法的原理:在化学计量点附近,被测离子浓度发生突跃,指示电极j电位也发生了突跃,进而确定滴定终点。②亚磷酸()是二元弱酸,其电离常数分别是,]
A. a点对应溶液的溶质为和NaCl,pH>7
B. 第二次电极电位突跃发生的离子反应为
C. 水的电离程度:
D. c点对应的溶液中一定存在:
【答案】D
【解析】
【详解】A.分析可知,a点为第一次电极电位突跃,恰好完成第一步反应,对应溶质为、NaCl,的电离平衡常数,水解平衡常数,的电离程度大于水解程度,即pH<7,故A错误;
B.发生第二次突跃是和盐酸恰好完全反应,反应是,故B错误;
C.水解促进水电离,盐酸抑制水电离,加盐酸过程中水的电离程度逐渐减小,所以水电离,故C错误;
D.c点对应溶质为、NaCl、,根据电荷守恒有:,根据物料守恒,所以,故D正确;
选D。
第Ⅱ卷 非选择题(共60分)
11. 从铜电解液分离出的粗硫酸镍晶体中含有大量的杂质元素(Cu、Fe、As、Ca、Zn等),我国科学家对粗硫酸镍进行精制提纯,其工艺流程如下。
已知:
i.含镍溶液中的主要离子有:、、、、、和
ii.部分物质的电离常数和溶度积常数如下表。回答下列问题:
(1)将粗硫酸镍溶液的pH调小至0.5,加入的试剂是___________。
(2)滤渣1中除CuS外,还含有和S。反应生成和S的离子方程式是:______。
(3)“氧化除杂”时,加入的目的___________。
(4)用沉淀溶解平衡原理解释用能够“氟化除杂”原因___________。
(5)含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。
①将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是___________(填标号)。
A. B. C. D.
②如图是硫的四种含氧酸根的结构:
根据组成和结构推断,能在酸性溶液中将转化为的是___________(填标号)。理由是___________。
③如图是CZTS四元半导体化合物的四方晶胞。该物质的化学式为___________。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若图中A原子的坐标为,则B的原子坐标为___________。
【答案】(1)稀硫酸(或)
(2)
(3)使的水解平衡向正反应方向移动,生成(其他合理答案也给分)
(4)的平衡常数,所以加入能将完全转化为沉淀
(5) ①. B ②. D ③. D中过氧键具有强氧化性,能将转化为 ④. ⑤.
【解析】
【分析】粗硫酸镍晶体溶解调节pH=0.5,通入硫化氢除去铜、砷元素;加入氯气将二价铁转化为三价铁,加入氢氧化镍调节pH值,除去铁元素;加入NiF2或HF除去钙元素;调节pH萃取分离出镍元素,最终得到精制硫酸镍;
【小问1详解】
调节pH时不能引入新的杂质,将粗硫酸镍溶液的pH调小至0.5,加入的试剂是稀硫酸;
【小问2详解】
滤渣1中除CuS外,还含有As2S3和S,说明和H2S反应生成As2S3、S和H2O,As元素由+5价下降到+3价,S元素由-2价上升到0价,根据得失电子守恒和电荷守恒配平离子方程式为:
【小问3详解】
“氧化除杂”时,加入Cl2和Ni(OH)2能析出Fe(OH)3的原因是:Cl2将Fe2+氧化为Fe3+,Fe3++3H2O⇌Fe(OH)3+3H+,加入的Ni(OH)2和H+反应,使Fe3+的水解平衡向正反应方向移动,生成Fe(OH)3;
【小问4详解】
由题目所给数据可知,的平衡常数,所以加入能将完全转化为沉淀;
【小问5详解】
①根据题意,顺磁性物质含有未成对电子。A选项、C选项、D选项中各原子核外电子均已成对,不符合题意;B选项,中 Cu2+ 的价电子排布是 3d9,有未成对电子,符合题意,故选B;② 转化为 需要氧化剂,且氧化性比 的强,由 SO2 能使 KMnO4 溶液褪色知 的氧化性弱于,而 与 中 S 的化合价均为 +6 价,故A不符合题意;B选项,C选项中S的化合价比中S的价态低,氧化性更弱,故B、C不符合题意;D选项中含有−1价的 O(结构式中位于中间的2个 O),具有强氧化性,能将 转化为 ;③根据晶胞结构,结合均摊法知,S 原子位于体内,每个晶胞中含有的 S 原子数目为 8,Sn 原子位于面心和棱心,数目为 ,Zn 原子位于顶点和体心,数目为,Cu 原子位于面上,数目为 ,则该物质的化学式为;②根据A原子的坐标和几何关系知,B原子的坐标为。
12. 钛在医疗领域的使用非常广泛,如制人造关节、头盖、主动心瓣等。是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备 (夹持装置略去)。
已知:HCl与不发生反应;装置C中除生成外,同时还生成一种有毒气态氧化物和少量。其它相关信息如下表所示:
请回答下列问题:
(1)装置A中导管a的作用为___________,装置B中所盛试剂为___________,装置A中发生反应的离子方程式为___________(反应后Mn元素以形式存在)。
(2)组装好仪器后,部分实验步骤如下:
a.装入药品 b.打开分液漏斗活塞 c.检查装置气密性 d.关闭分液漏斗活塞 e.停止加热,充分冷却 f.加热装置C中陶瓷管
从上述选项选择合适操作(不重复使用)并排序:___________→___________→b→___________→___________→d。__________
(3)下列说法不正确的是___________。
A.通入氯气之前,最好先从k处通入氮气,否则实验会失败
B.石棉绒载体是为了增大气体与、碳粉的接触面积,以加快反应速率
C.装置D中的烧杯中可加入冰水,便于收集到纯的液态
D.装置E可防止空气中的水蒸气进入装置D的圆底烧瓶中使变质
E.该装置有缺陷,通过装置E后的气体不可直接排放到空气中
(4)可制备纳米:以为载体,用和水蒸气反应生成。再控制温度生成纳米。测定产物组成的方法如下:
步骤一:取样品2.100g用稀硫酸充分溶解得到,再用足量铝将还原为,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,定容得到待测液。
步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用的标准溶液滴定,将氧化为,三次滴定消耗标准溶液的平均值为24.00mL。
①滴定终点的判断方法是___________。
②通过分析、计算,该样品的组成为___________。
【答案】(1) ①. 平衡气压,便于浓盐酸顺利滴下 ②. 浓硫酸 ③.
(2)ca(b)fe(d)
(3)AC (4) ①. 滴入最后一滴标准液,溶液出现血红色且半分钟不褪色 ②.
【解析】
【分析】装置A中高锰酸钾和浓盐酸反应产生的氯气中含有水蒸气,通过装置B中的浓硫酸除去,然后在电炉内与二氧化钛发生反应,用装置D的冰盐水降低温度,获得液态四氯化钛,四氯化钛易水解,故应在后面连接干燥管,防止空气中的水蒸气进入装置D,根据三次滴定消耗标准溶液的平均体积,利用关系式~,计算的质量,从而求出水的质量,可得x、y的比值,进而得到物质的组成。
【小问1详解】
装置A中导管a能够使分液漏斗的液体上下气体压强相同,其作用为平衡气压,便于浓盐酸顺利滴下;装置B的作用是干燥氯气,因此所盛的试剂为浓硫酸;装置A中高锰酸钾和浓盐酸发生氧化还原反应,生成KCl、MnCl2、Cl2、H2O,反应的离子方程式为,故答案为:平衡气压,便于浓盐酸顺利滴下;浓硫酸;。
【小问2详解】
组装好仪器后,首先要检查装置气密性,然后装入药品,并打开分液漏斗活塞,使浓盐酸滴入装置A中发生反应,然后加热装置C中陶瓷管,使Cl2、C与反应制取,待反应结束时停止加热,充分冷却,最后关闭分液漏斗活塞,故操作排序用字母序号表示为:cabfed,故答案为:ca(b)fe(d)。
【小问3详解】
A.为防止碳粉在高温下被装置中的空气氧化,应该先通入氯气,但k处是出气口,而不能由此通入氮气,故A错误;
B.石棉绒载体比较膨松,可以增大气体与、碳粉的接触面积,以加快反应速率,故B正确;
C.装置D中的烧杯中可加入冰水,目的是降低温度,使液化,但反应产生的物质中有少量的也会被液化,因此不能收集到纯的液态,故C错误;
D.装置E的碱石灰能够吸收空气中的水分,这样就可防止空气中的水蒸气进入装置D的圆底烧瓶中使变质,故D正确;
E.该装置有缺陷,通过装置E后的气体可能含有未反应的Cl2及少量的蒸气,因此不可直接排放到空气中,故E正确;
故合理选项是AC。
【小问4详解】
①若反应完全,滴入溶液中的不能反应,与SCN-结合,使溶液变成血红色,故滴定终点的现象为滴入最后一滴标准液,溶液出现血红色且半分钟不褪色。
②三次滴定消耗标准溶液的平均值为24.00mL,物质反应转化关系为~,m()=80g/ml0.024L=1.92g;m(H2O)= 2.100g-1.92g=0.18g,所以x:y=:=12:5,故该物质的化学式为。
13. 航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用。
Sabatier反应:CO2(g)+4H2(g)CH4(g)+2H2O(g)
水电解反应:2H2O(g)=2H2(g)+O2(g)
一种新的循环利用方案是用Bsch反应CO2(g)+2H2(g)C(s)+2H2O(g) ΔH<0代替Sabatier反应,再电解水实现O2的循环利用。
回答下列问题:
(1)有关上述反应,下列说法正确的是_____(填标号)。
A.室温下,2H2O(g)⇌2H2(g)+O2(g)不能自发进行的原因为ΔS<0
B.可逆反应都有一定的限度,限度越大反应物的转化率一定越高
C.可逆反应中,若反应物的总能量>生成物的总能量,则ΔH<0
(2)在Sabatier反应[反应Ⅰ:CO2(g)+4H2(g) CH4(g)+2H2O(g) KⅠ]体系中,还会发生副反应(反应Ⅱ):CO2(g)+H2(g) CO(g)+H2O(g) KⅡ;一定压强下,向某容积可变的密闭容器中通入CO2和H2的混合气体(其中CO2和H2的物质的量之比为1∶4),在某催化剂的作用下同时发生反应Ⅰ和反应Ⅱ,测得CO2的转化率、CH4的选择性、CO的选择性随反应温度的变化情况如图所示。
已知:CH4或CO的选择性指反应生成CH4或CO时所消耗的CO2的物质的量占参与反应的CO2总物质的量的百分比。相同温度下,反应2CO(g)+2H2(g)⇌CO2(g)+CH4(g)的平衡常数为_____(用含KⅠ、KⅡ的式子表示);提高CH4的选择性的措施有_____、_____。
(3)对于Bsch反应CO2(g)+2H2(g)⇌C(s)+2H2O(g) ΔH<0,下列关于各图像的解释或得出的结论正确的是_____(填标号)。
A. 由甲图可知,反应在t1min时可能改变了压强或使用了催化剂
B. 由乙图可知,反应在m点可能达到了平衡状态
C. 由丙图可知,反应过程中v正>v逆的点是C点
D. 由丁图可知,交点A表示的反应一定处于平衡状态
(4)室温下,向体积为2L的恒容密闭容器中通入4mlH2和1mlCO2发生Sabatier反应:CO2(g)+4H2(g) CH4(g)+2H2O(g)(不考虑副反应);若反应时保持温度恒定,测得反应过程中压强随时间的变化如下表所示:
①0~10min内,v(CO2)=_____ml·L-1·min-1,该温度下Sabatier反应的Kp=_____(Kp为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)。
②Sabatier反应的速率方程:v正=k正c(CO2)c4(H2),v逆=k逆c(CH4)c2(H2O)(k是速率常数,只与温度有关)。20min时,_____;反应达平衡时,升高温度,k正增大的倍数_____k逆增大的倍数。(填“>”“<”或“=”)
【答案】(1)C (2) ①. ②. 控制反应温度在340℃左右 ③. 增大压强 (3)BC
(4) ①. 0.01 ②. ③. > ④. <
【解析】
【小问1详解】
A.2H2O(g)⇌2H2(g)+O2(g) ΔS>0,室温下,该反应不能自发进行的原因是ΔH>0,不利于反应自发进行,且为主要的影响因素,A错误;
B.增大某反应物浓度可提高可逆反应的限度,但该反应的转化率减小,B错误;
C.ΔH=生成物总能量-反应物总能量,可逆反应中,若反应物总能量大于生成物总能量,则ΔH<0,C正确;
故选C。
【小问2详解】
①根据盖斯定律,目标反应=反应I-2×反应II,则目标反应的平衡常数K=;
②由题图可知,在温度为340-400℃时,甲烷的选择性为100%,即此温度范围内只发生反应I,在此温度范围内升高温度,二氧化碳的转化率减小,说明反应I平衡逆向移动,KI减小,由上述分析及反应I、反应II在反应前后气体分子数的变化特点可知,温度、压强可影响甲烷的选择性,增大压强,反应I平衡正向移动,可提高甲烷的选择性,故可采用控制反应温度在340-400℃、增大压强等措施来提高甲烷的选择性;
【小问3详解】
A.对Bsch反应,反应后气体分子数减小,改变压强正逆反应速率不等,A错误;
B.已知生成物的百分含量随温度的升高而增大,m点为曲线的最高点,生成物的百分含量达到最大值,即建立了相应温度下的平衡状态,继续升温生成物的百分含量减小,说明升温平衡逆向移动,B正确;
C.C点二氧化碳转化率小于该温度下的平衡转化率,反应正向进行,正反应速率大于逆反应速率,C正确;
D.A点时反应物浓度等于生成物浓度,反应不一定达到平衡状态,D错误;
故选BC。
【小问4详解】
①向体积为2L的恒容容器中通入4ml氢气和1ml二氧化碳发生反应,设达到10min时消耗二氧化碳的物质的量为xml,则有:
恒温恒容条件下,反应前后气体物质的量之比等于压强之比,则10min时,,解得x=0.2,v(CO2)=0.2÷(2×10)=0.01ml/(L∙min)。
②由表中数据可知,反应在50min时达到平衡,设反应达到平衡时消耗yml二氧化碳,则有,解得y=0.5。CO2(g)、4H2(g) 、CH4(g)、2H2O(g)的分压分别为0.5p、2p、0.5p、p,Kp=;
③已知v正=k正c(CO2)c4(H2),v逆=k逆c(CH4)c2(H2O),根据表中数据,20min时,反应还未达到平衡,反应正向进行,所以v正> v逆,所以v正=k正c(CO2)c4(H2)>v逆=k逆c(CH4)c2(H2O),即k正c(CO2)c4(H2)>k逆c(CH4)c2(H2O),所以>;
④反应为放热反应,升高温度,平衡逆向移动,v正< v逆,k正增大的倍数
回答下列问题:
(1)A含有的官能团名称:______。
(2)C的分子式:______。
(3)E→G的反应类型为______。
(4)D→F分两步完成,其中D与NaOH反应化学方程式为______。
(5)H在酸或碱存在并加热的条件下可以发生水解反应,若在盐酸作用下水解,其生成物中属于盐的结构为______。
(6)溴代乙酸乙酯有多种同分异构体,其中与其具有相同官能团的结构还有______种(不考虑立体异构、不考虑Br-直接与-COO-相连)。
【答案】14. (酚)羟基、碳溴键(溴原子)
15. C16H25BO4
16. 还原反应 17. +NaOH+C2H5OH
18. 19. 10
【解析】
【分析】A和CH3CH2I发生取代反应生成B,结合C的结构简式可知,B的结构简式为:,C和取代反应生成D,D中含有酯基,D→F分两步完成,先在碱性条件下水解后酸化得到,E发生还原反应得到G,G和F发生取代反应生成H,以此解答。
以此解题。
【小问1详解】
根据A的结构简式可知,A含有的官能团名称是(酚)羟基、碳溴键(溴原子)。
【小问2详解】
结合C的结构简式可知其分子式为:C16H25BO4。
【小问3详解】
对比E和G的结构简式可知,E中的碳氧双键被还原,则E→G为还原反应。
【小问4详解】
D中含有酯基,在碱性条件下可以发生水解反应,方程式为:+NaOH+C2H5OH。
【小问5详解】
H中含有酰胺基,在酸性条件下可以水解,生成两种物质,其中一种物质含有氨基,可以和盐酸反应生成盐,其结构简式为:。
【小问6详解】
乙酸乙酯中氢原子被溴原子取代还有2种,甲酸正丙酯有3种,甲酸异丙酯有2种,丙酸甲酯有3种,共10种。
物质
溶解度/g
6.38
111
11.1
物质
溶度积常数
物质
溶度积常数
物质
溶度积常数
CuS
NiS
FeS
熔点/℃
沸点/℃
密度/(g/cm3)
水溶性
-24
136.4
1.7
易水解生成白色沉淀,能溶于有机溶剂
-23
76.8
1.6
难溶于水
时间/min
0
10
20
30
40
50
60
压强
5.00p
4.60p
4.30p
4.15p
4.06p
4.00p
4.00p
福建省福州第一中学2023-2024学年高三上学期期末考试化学试卷(Word版附解析): 这是一份福建省福州第一中学2023-2024学年高三上学期期末考试化学试卷(Word版附解析),共28页。试卷主要包含了5 Ti-48 Fe-56, 化学与生产、生活密切相关等内容,欢迎下载使用。
2024苏州高三上学期期末考试化学含解析: 这是一份2024苏州高三上学期期末考试化学含解析,共29页。试卷主要包含了可能用到的相对原子质量, 含锂物质在能源方面有重要应用, 硫及其化合物的转化形态丰富等内容,欢迎下载使用。
福建省福州第一中学2023-2024学年高三上学期期末考试化学试题(无答案): 这是一份福建省福州第一中学2023-2024学年高三上学期期末考试化学试题(无答案),共9页。试卷主要包含了5 Ti-48 Fe-56,化学与生产、生活密切相关,蛇烯醇的结构如图所示,下列实验装置能达到实验目的的是,高锰酸钾在工业中广泛用作氧化剂等内容,欢迎下载使用。












