

湖南省部分校2023-2024学年高二上学期10月联考化学试卷(含答案)
展开一、单选题
1.化学与航天、能源、化工等密切相关。下列说法错误的是( )
A.液氢和液氧是理想的火箭推进剂之一
B.煤经干馏可以获得煤焦油
C.工业合成氨反应选用合适的催化剂能提高生产效率
D.天然气、沼气的主要成分都是甲烷,二者均是不可再生能源
2.下列物质的分类、用途均正确的是( )
A.:盐,食品膨松剂B.:碱性氧化物,供氧剂
C.HClO:酸,与碳酸盐反应制备D.胶体:混合物,饮用水消毒剂
3.阿司匹林是生活中的常用药,具有解热镇痛作用,其活性成分为乙酰水杨酸,结构简式如图所示。下列有关乙酰水杨酸的说法错误的是( )
A.分子式为B.属于烃的衍生物
C.不能与溶液反应D.能发生取代反应
4.下列说法正确的是( )
A.升高温度和增大压强均可增大活化分子百分数
B.升高温度,无论是吸热反应,还是放热反应,、均加快
C.对于反应,增加C粉用量,反应速率明显加快
D.对于反应的平衡体系,增大压强,可用勒夏特列原理解释颜色加深现象
5.下列离子方程式书写正确的是( )
A.向水中通入氯气:
B.向硫酸铜溶液中加入小块钠:
C.磁性氧化铁与盐酸反应:
D.用烧碱溶液除去铁粉中的铝粉:
6.二元弱酸的电离过程是吸热过程,某温度下,其电离常数、。下列说法错误的是( )
A.升高温度后,、均增大
B.向溶液中加入少量KHX固体,减小
C.该温度下的溶液中
D.向溶液中加水稀释过程中,减小
7.为阿伏伽德罗常数的值。下列说法正确的是( )
A.64gCu和32gS共热充分反应时转移电子数为
B.64g溶于足量的水中生成的分子数小于
C.1ml和2ml在一定条件下充分反应生成的分子数为
D.标准状况下,11.2L含有的原子总数为
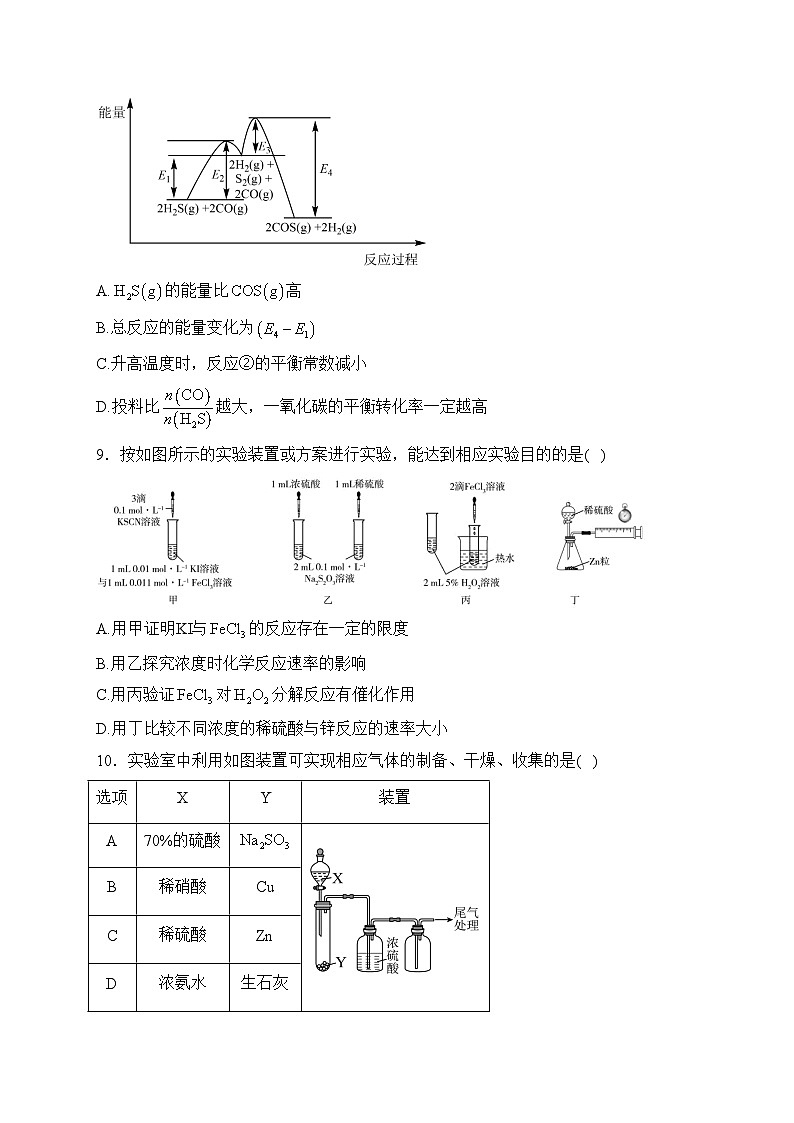
8.以CO为碳源制COS的反应分两步进行:①、②,反应过程中的能量变化如图所示,下列有关该反应的说法正确的是( )
A.的能量比高
B.总反应的能量变化为
C.升高温度时,反应②的平衡常数减小
D.投料比越大,一氧化碳的平衡转化率一定越高
9.按如图所示的实验装置或方案进行实验,能达到相应实验目的的是( )
A.用甲证明KI与的反应存在一定的限度
B.用乙探究浓度时化学反应速率的影响
C.用丙验证对分解反应有催化作用
D.用丁比较不同浓度的稀硫酸与锌反应的速率大小
10.实验室中利用如图装置可实现相应气体的制备、干燥、收集的是( )
A.AB.BC.CD.D
11.已知25℃时,某些物质的燃烧热数据如表:
下列热化学方程式书写正确的是( )
A.
B.
C.
D.
12.催化剂Ⅰ和Ⅱ均能催化反应,反应历程(如图所示)中,M为中间产物。其他条件相同时,下列说法错误的是( )
A.该反应反应物的总能量大于生成物的总能量
B.当催化剂为Ⅰ时,增大压强,反应速率加快,R的平衡转化率增大
C.使用催化剂Ⅰ的最高活化能小于Ⅱ的最高活化能
D.Ⅰ和Ⅱ相比,使用催化剂Ⅰ时,反应过程中M所能达到的最高浓度更大
13.用消除NO有害气体的反应原理为。在一定条件下,该反应的速率方程为(、分别为正、逆反应速率常数,与温度、催化剂有关,与浓度无关),测得速率常数k(表示、)的对数温度倒数的关系如图所示。其中,能代表与关系的直线为( )
A.aB.bC.cD.d
14.向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:,各容器的容积、反应温度、反应物起始量如表所示,其中甲、乙容器反应过程中C的浓度随时间变化的关系如图所示:
下列分析与推断错误的是( )
A.
B.
C.平衡时丙容器中
D.保持其他条件不变,向平衡后的乙容器中再充入0.5mlA和0.5mlC,则
二、推断题
15.以淀粉为原料合成F和J的简易流程如下:
回答下列问题:
(1)淀粉的分子式为___________。
(2)检验麦芽糖中含有醛基的常用试剂是___________(填名称)。
(3)葡萄糖在酶的催化下转变为乙醇的化学方程式为___________。
(4)E→F的反应类型是___________。G中含有的官能团名称是___________。
(5)H→J的化学方程式为___________。
三、填空题
16.工业合成氨解决了世界约二分之一人的粮食问题,是人类科学技术的一项重大突破。
(1)在(Ⅲ)铁原子簇表面发生反应的机理如下:
ⅰ.
ⅱ.
ⅲ.
ⅳ.
①___________0(填“>”或“<”)。
②推测该机理中,速率控制步骤为___________(填“ⅰ”“ⅱ”“ⅲ”或“ⅳ”),理由是___________。
③___________(用含、、、的代数式表示)。
(2)工业合成氨生产中,原料气的平衡转化率低于30%,工业生产为了提高原料气总转化率采取了多项措施,其中有___________(填两点)。
(3)最新“人工固氮”途径为。已知: ,欲计算的,还需要从教材中查询的一个数据是___________。
(4)利用的还原性可以消除氮氧化物的污染,反应原理之一为,当该反应转移3ml电子时,放出的热量为___________kJ;已知该反应的,试通过计算说明该反应常温下(298K)能否自发进行?___________。
17.的资源化利用能有效助力“碳中和”和“碳达峰”,工业上用与催化合成甲醇,相关反应如下:
请回答下列问题:
(1)___________(用含、代数式表示)。
(2)已知平衡常数、、随温度变化的曲线如图所示:
①___________0(填“>”或“<”),判断依据为___________。
②___________(填“>”“<”或“=”)。
(3)一定温度下,向2L的恒容密闭容器中充入3ml和1ml,只发生反应ⅰ和ⅱ,经过10min后达到平衡状态,测得平衡时气体的压强是开始时的0.7倍,的平衡转化率为80%。
①0~10min内用表示的平均反应速率___________。
②平衡时___________。该温度下反应ⅱ的化学平衡常数___________。
(4)在催化剂作用下,向某密闭容器中按投料,发生反应ⅰ、ⅱ和ⅲ,研究发现,在180~250℃温度区域,随温度升高,平衡时混合气体的平均摩尔质量持续减小,在250℃以上区域,平衡时混合气体的平均摩尔质量几乎不变。试分析,250℃以上区域,随温度升高,平衡时混合气体的平均摩尔质量几乎不变的原因可能是___________。
四、实验题
18.是重要的化工产品,某小组设计如下实验装置制备氯化铁并探究其性质。
已知:①易升华、遇水蒸气易潮解。
②实验室用铁氰化钾溶液检验,产生蓝色沉淀。
回答下列问题:
(1)盛装浓盐酸的仪器是___________(填名称),装置B中的试剂是___________,装置C的作用是___________。
(2)装置A中发生反应的离子方程式为___________。
(3)装置E中冰水浴的作用是___________。
(4)上述实验装置存在两处缺陷:一是制备产品的导气管太细,易堵塞;二是___________。
(5)对实验装置进行改进后,继续完成实验。实验完毕后,取产品探究其性质:
根据上述实验现象,不能确定产品中是否含有铁单质,理由是___________(用离子方程式表示)。为了确认产品中是否含有铁单质,取上述实验②所得溶液于试管中,___________(补充步骤和现象),则证明产品中含有铁单质。
参考答案
1.答案:D
解析:A.液氢和液氧反应除释放大量能量外,产物水对环境也友好,是理想的火箭推进剂之一,A项正确;
B.煤的干馏可以得到出炉煤气、煤焦油和焦炭等化工原料,B项正确;
C.工业合成氨反应选用合适的催化剂,能加快反应速率,提高单位时间的产量,从而提高生产效率,C项正确;
D.天然气、沼气的主要成分都是甲烷,但天然气、沼气分别为不可再生能源和可再生能源,D项错误;
故选D。
2.答案:A
解析:是盐,可作食品膨松剂,A正确;
是碱性氧化物,不能作供氧剂,B错误;
是过氧化物,不是酸,C错误;
胶体是混合物,可作净水剂,不能作消毒剂,D错误。
3.答案:C
解析:A.由图可知,乙酰水杨酸的分子式为,A项正确;
B.乙酰水杨酸含碳、氢、氧元素,属于烃的含氧衍生物,B项正确;
C.羧基能与碳酸氢钠溶液反应生成,C项错误;
D.乙酰水杨酸能发生酯化反应、水解反应,都属于取代反应,D项正确;
故选C。
4.答案:B
解析:A.增大压强可增大单位体积内活化分子数,但活化分子百分数不变,故A错误;
B.升高温度,无论是吸热反应,还是放热反应,正逆反应速率均加快,故B正确;
C.固体的浓度为定值,增加固体碳粉的用量,不能改变反应物的浓度,反应速率不变,故C错误;
D.该反应为气体体积不变的反应,增大压强,碘蒸气的浓度增大,气体颜色加深,但平衡不移动,所以颜色加深不能用勒夏特列原理解释,故D错误;
故选B。
5.答案:D
解析:
6.答案:D
解析:,加水稀释过程中,减小,故增大,故D错误;
故选D。
7.答案:B
解析:64gCu和32gS共热充分反应时生成,转移电子数为,A项错误;
溶于水生成的反应是可逆反应,64g溶于足量的水中生成的分子数小于,B项正确;
和在一定条件下的反应是可逆反应,1ml和2ml在一定条件下充分反应生成的分子数小于,C项错误;
标准状况下,是固体,D项错误。
8.答案:C
解析:B.由图知,能量变化为,故B错误;
C.反应②为放热反应,则升温,平衡逆移,k值变小,故C正确。
9.答案:D
解析:C.变量不仅有是否用了溶液,还有温度也不同,故无法验证对的分解有催化作用,故C错误;
D.可用不同浓度的稀硫酸,与Zn反应,测得收集相同体积所需时间的不同,从而可比较不同浓度的稀硫酸与Zn反应的速率大小,故D正确;
故选D。
10.答案:A
解析:A.与70%的硫酸反应生成,通过浓硫酸进行干燥,的密度大于空气,可用向上排空气法收集,有毒,可用NaOH溶液吸收尾气,A项正确;
B.Cu与稀硝酸反应生成NO,NO与空气密度相近,且与空气中的氧气反应,只能用排水法收集,B项错误;
C.Zn与稀硫酸反应生成,的密度小于空气,不能用向上排空气法收集,C项错误;
D.浓氨水与生石灰反应生成,能与浓硫酸反应,不能用浓硫酸干燥,D项错误;
答案选A。
11.答案:A
解析:
12.答案:B
解析:A.由图可知,该反应的反应物总能量大于生成物总能量,A项正确;
B.当催化剂为Ⅰ时,增大压强,反应速率加快,R的平衡转化率不变,B项错误;
C.由图可知,使用催化剂Ⅰ的最高活化能小于催化剂Ⅱ的最高活化能,C项正确;
D.由图可知,在前两个历程中,使用催化剂Ⅰ,活化能较低反应速率较快,后两个历程中,使用催化剂Ⅰ,活化能较高反应速率较慢,所以使用催化剂Ⅰ时,反应过程中M所能达到的最高浓度更大,D项正确;
答案选B。
13.答案:C
解析:
14.答案:C
解析:
15.答案:(1)
(2)银氨溶液(或新制的氢氧化铜)
(3)
(4)酯化反应(或取代反应);羧基、碳碳双键
(5)
解析:(1)淀粉的分子式:;
(2)醛基可以用银氨溶液或新制的氢氧化铜检验;
(3)葡萄糖在酶的催化下转变为乙醇的化学方程式:;
(4)E→F发生酯化反应,脱去两分子水;G中含有的官能团名称:羧基、碳碳双键;
(5)G与甲醇反应生成丙烯酸甲酯,丙烯酸甲酯发生加聚反应生成高聚物J,反应方程式:。
16.答案:(1)①>
②ⅱ;较稳定,断裂氮氮三键需要的能量较多
③
(2)增大压强;及时分离出氨气;将反应混合物中分离出的氢气和氮气进行循环操作等
(3)的燃烧热
(4)453;常温下,该反应的,反应能自发进行
解析:(1)①为化学键断裂过程,断键吸热,;
②步骤ii涉及氮氮三键断裂,该步反应的活化能最大,反应速率最慢,所以速率控制步骤为ii;
③根据盖斯定律可得;
(2)合成氨反应是气体体积减小的可逆反应,工业生产时提高原料气总转化率的方法有增大压强、及时分离出氨气等;反应后的混合气分离出氨气后还含有氛气和氮气,进行循环操作也可以提高原料气的总转化率。
17.答案:(1)
(2)①>;升高温度,平衡常数增大,平衡向正反应方向移动,则正反应为吸热反应
②>
(3)①0.04;②0.3;0.8
(4)当温度高于250℃时,以反应ii为主
解析:
18.答案:(1)分液漏斗;饱和食盐水;干燥氯气
(2)
(3)冷凝氯化铁
(4)E和F之间缺少干燥装置或装置F中挥发出来的水蒸气进入E中,导致氯化铁潮解
(5);滴加铁氰化钾溶液,若产生蓝色沉淀
解析:(1)用饱和食盐水吸收氯气中的氯化氢,用浓硫酸干燥氯气;
(2)二氧化锰与浓盐酸反应的条件是加热,离子方程式为;
(3)氯化铁易升华,可用冰水浴冷凝;
(4)依题意,氯化铁易潮解,装置F中挥发出来的水蒸气进入E中,导致氯化铁潮解;
(5)若产品溶于稀硫酸无气泡产生,不能说明产品中不含铁单质,因为氯化铁能与铁发生反应;向溶液中加入铁氰化钾溶液,可检验亚铁离子,若存在亚铁离子,则铁过量,否则铁不过量。
选项
X
Y
装置
A
70%的硫酸
B
稀硝酸
Cu
C
稀硫酸
Zn
D
浓氨水
生石灰
物质
燃烧热
-285.8
-393.5
-395.0
-3267.5
容器
甲
乙
丙
容积
0.5L
0.5L
0.5L
温度/℃
反应物
起始量
1.5mlA
0.5mlB
1.5mlA
0.5mlB
3mlA
1mlB
相关反应
化学平衡常数(K)
ⅰ
ⅱ
ⅲ
实验
操作
现象
①
取少量固体溶于蒸馏水,滴加KSCN溶液
溶液变红色
②
取少量固体溶于稀硫酸
固体溶解,无气泡产生
湖南省名校教育联盟2023-2024学年高二上学期中联考化学试卷含答案: 这是一份湖南省名校教育联盟2023-2024学年高二上学期中联考化学试卷含答案,共18页。试卷主要包含了下列离子方程式书写不正确的是,下列图示与对应的叙述相符的是等内容,欢迎下载使用。
湖南省部分校联考2023-2024学年高二上学期期中考试化学试题含答案: 这是一份湖南省部分校联考2023-2024学年高二上学期期中考试化学试题含答案,共23页。试卷主要包含了本试卷主要考试内容,01NA等内容,欢迎下载使用。
湖南省部分校联考2023-2024学年高二上学期期中考试化学试卷(含答案): 这是一份湖南省部分校联考2023-2024学年高二上学期期中考试化学试卷(含答案),共21页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。












