









专题六 主观题突破 4.化工流程中化学方程式的书写及有关计算 2024年高考化学二轮复习课件+讲义
展开(一)化工流程中化学方程式的书写
1.书写思路首先根据题给材料中的信息写出部分反应物和生成物的化学式,再根据反应前后元素化合价有无变化判断反应类型:(1)元素化合价无变化则为非氧化还原反应,遵循质量守恒定律;(2)元素化合价有变化则为氧化还原反应,既遵循质量守恒定律,又遵循得失电子守恒规律。
2.流程中陌生的氧化还原反应的书写流程(1)首先根据题给材料中的信息确定氧化剂(或还原剂)与还原产物(或氧化产物),结合已学知识根据加入的还原剂(或氧化剂)判断氧化产物(或还原产物)。(2)根据得失电子守恒配平氧化还原反应。(3)根据电荷守恒和反应物的酸碱性,在方程式左边或右边补充H+、OH-或H2O等。(4)根据质量守恒配平反应方程式。
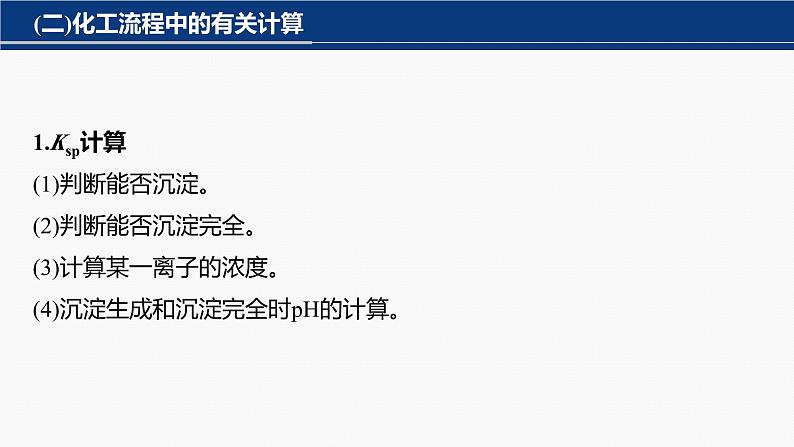
(二)化工流程中的有关计算
1.Ksp计算(1)判断能否沉淀。(2)判断能否沉淀完全。(3)计算某一离子的浓度。(4)沉淀生成和沉淀完全时pH的计算。
2.产率、纯度的计算(1)计算公式
(2)计算的关键在于运用守恒或关系式法结合实验原理找到计算的关系,确定数量关系。
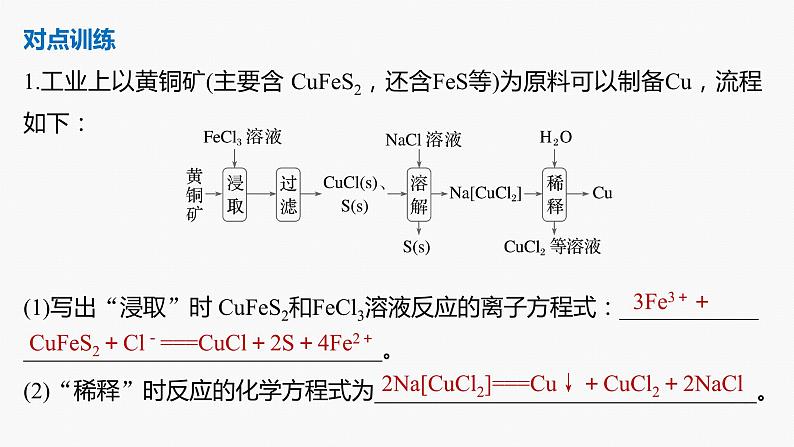
对点训练1.工业上以黄铜矿(主要含 CuFeS2,还含FeS等)为原料可以制备Cu,流程如下:
(1)写出“浸取”时 CuFeS2和FeCl3溶液反应的离子方程式:___________________________________________。(2)“稀释”时反应的化学方程式为_________________________________。
CuFeS2+Cl-===CuCl+2S+4Fe2+
2Na[CuCl2]===Cu↓+CuCl2+2NaCl
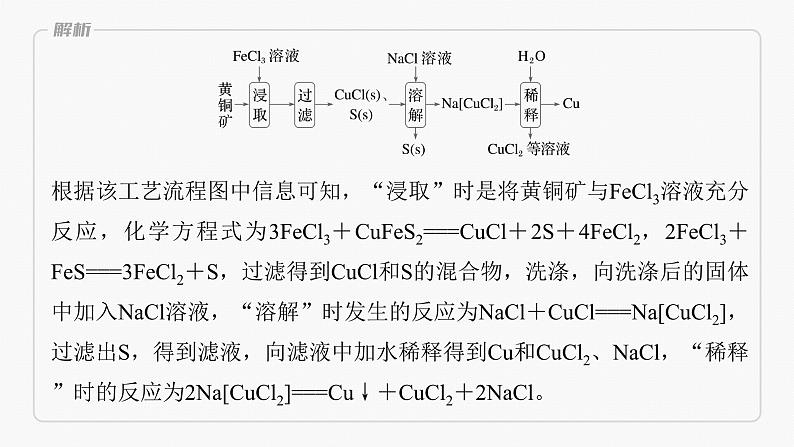
根据该工艺流程图中信息可知,“浸取”时是将黄铜矿与FeCl3溶液充分反应,化学方程式为3FeCl3+CuFeS2===CuCl+2S+4FeCl2,2FeCl3+FeS===3FeCl2+S,过滤得到CuCl和S的混合物,洗涤,向洗涤后的固体中加入NaCl溶液,“溶解”时发生的反应为NaCl+CuCl===Na[CuCl2],过滤出S,得到滤液,向滤液中加水稀释得到Cu和CuCl2、NaCl,“稀释”时的反应为2Na[CuCl2]===Cu↓+CuCl2+2NaCl。
2.工业上使用催化剂时常需要载体,纳米氧化锌可作为一些催化剂的载体。工业上由软锰矿(主要成分为MnO2)与锌精矿(主要成分为ZnS)酸性共融法制备MnO2及纳米ZnO的工艺流程如图。回答下列问题:
(1)写出酸浸时ZnS与MnO2发生的主要反应的化学方程式:_______________________________________________(无单质硫生成)。
+4H2SO4===ZnSO4+4MnSO4+4H2O
根据工艺流程分析,酸浸时,ZnS、MnO2分别转化为ZnSO4、MnSO4,即S由-2价升高为+6价,Mn由+4价降低为+2价,根据得失电子守恒、原子守恒,配平化学方程式为ZnS+4MnO2+4H2SO4===ZnSO4+4MnSO4+4H2O。
(2)Na2S2O8是一种强氧化剂,能与Mn2+反应生成 和紫色 。用Na2S2O8检验水相中的Mn2+时发生反应的离子方程式为_____________________________________________。
3.将等体积的4×10-3 ml·L-1的AgNO3溶液和4×10-3ml·L-1 K2CrO4溶液混合,有无Ag2CrO4沉淀产生?[已知:Ksp (Ag2CrO4)=1.12×10-12]
1.(2022·广东,18)稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
已知:月桂酸(C11H23COOH)的熔点为44 ℃;月桂酸和(C11H23COO)3RE均难溶于水。该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=1.8×10-8,Al(OH)3开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
(1)“氧化调pH”中,化合价有变化的金属离子是_______。
由流程可知,该类矿(含铁、铝等元素)加入酸化MgSO4溶液浸取,
加入月桂酸钠,使RE3+形成(C11H23COO)3RE沉淀,滤液2主要含有MgSO4溶液,可循环利用,滤饼加盐酸,经加热搅拌溶解后,再冷却结晶,析出月桂酸,再固液分离得到RECl3溶液。
由分析可知,“氧化调pH”的目的是除去含铁、铝等元素的离子,需要将Fe2+氧化为Fe3+,以便后续除杂,所以化合价有变化的金属离子是Fe2+。
(2)“过滤1”前,用NaOH溶液调pH至_____________的范围内,该过程中Al3+发生反应的离子方程式为_________________________。
Al3++3OH-===Al(OH)3↓
由表中数据可知,Al3+沉淀完全时的pH为4.7,而RE3+开始沉淀时的pH为6.2,所以为保证Fe3+、Al3+沉淀完全,且RE3+不沉淀,要用NaOH溶液调pH至4.7≤pH<6.2的范围内,该过程中Al3+发生反应的离子方程式为Al3++3OH-===Al(OH)3↓。
(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为2.7 g·L-1。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c(C11H23COO-)低于__________ ml·L-1(保留两位有效数字)。
滤液2中Mg2+浓度为2.7 g·L-1,即0.112 5 ml·L-1,根据Ksp[(C11H23COO)2Mg]=c(Mg2+)·c2(C11H23COO-),若要加入月桂酸钠后只生成(C11H23COO)3RE,而不产生(C11H23COO)2Mg,
(4)①“加热搅拌”有利于加快RE3+溶出、提高产率,其原因是_________________________。②“操作X”的过程为先__________,再固液分离。
“操作X”的结果是分离出月桂酸,由信息可知,月桂酸(C11H23COOH)的熔点为44 ℃,故“操作X”的过程为先冷却结晶,再固液分离。
(5)该工艺中,可再生循环利用的物质有________(写化学式)。
(6)稀土元素钇(Y)可用于制备高活性的合金类催化剂Pt3Y。①还原YCl3和PtCl4熔融盐制备Pt3Y时,生成1 ml Pt3Y转移_____ ml电子。
YCl3中Y为+3价,PtCl4中Pt为+4价,而Pt3Y中金属均为0价,所以还原YCl3和PtCl4熔融盐制备Pt3Y时,生成1 ml Pt3Y转移15 ml电子。
②Pt3Y/C用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化O2的还原,发生的电极反应为___________________________。
碱性溶液中,氢氧燃料电池正极发生还原反应,发生的电极反应为O2+4e-+2H2O===4OH-。
O2+4e-+2H2O
2.[2021·河北,15(1)(2)(3)(6)(7)]绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr—Fe—Al—Mg的深度利用和Na+内循环。工艺流程如图:
回答下列问题:(1)高温连续氧化工序中被氧化的元素是________(填元素符号)。
(2)工序①的名称为__________。
工序①为将氧化后的固体加水溶解浸出可溶性物质。
(3)滤渣Ⅰ的主要成分是______________(填化学式)。
(6)热解工序产生的混合气体最适宜返回工序______(填“①”“②”“③”或“④”)参与内循环。
热解工序产生的混合气体为二氧化碳和水蒸气,将混合气体通入滤渣Ⅰ中可以将氧化镁转化为碳酸氢镁溶液,则混合气体最适宜返回的工序为工序②。
(7)工序④溶液中的铝元素恰好完全转化为沉淀的pH为______(通常认为溶液中离子浓度小于10-5 ml·L-1为沉淀完全;Al(OH)3+OH- K=100.63;Kw=10-14,Ksp[Al(OH)3]=10-33)。
1.金属钒在新能源动力电池中有重要作用。含钒尖晶石是钒渣中最主要的含钒物相,其主要成分有V2O3、FeO、Fe2O3、Al2O3、SiO2。采用以下工艺流程制备V2O5。
(1)“焙烧”过程中被氧化的元素为________,写出V2O3与Na2CO3反应的化学方程式____________________________________。
加入碳酸钠焙烧后,V2O3、Al2O3、SiO2分别生成NaVO3、NaAlO2、Na2SiO3,FeO被氧化为Fe2O3,加水进行水溶,只有Fe2O3不溶,则沉淀1为Fe2O3,加入盐酸调节pH=2~3,将硅元素转化为硅酸,则沉淀2为硅酸,用NaOH调节pH,生成氢氧化铝和氢氧化铁沉淀,溶液中只含NaVO3,加入(NH4)2CO3“沉钒”析出NH4VO3,煅烧NH4VO3得到V2O5。
(2)“沉淀1”的成分是_______。(3)“滤液1”中铝元素所发生反应的离子方程式为___________________________。
(4)“沉淀2”加热分解后固体产物的用途为________________________(任写一种)。(5)该工艺流程中可回收再循环利用的物质有_________。
光导纤维(或制单质硅等)
2.Zn、Fe及其化合物在生产、生活中应用比较广泛。工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO和CuO等杂质)制取金属锌的工艺流程如下:
(1)若净化后的溶液中Cu2+浓度为1×10-12ml·L-1,则净化后溶液中Zn2+浓度为______________[已知:室温下Ksp(ZnS)=1.6×10-24,Ksp(CuS)=6.4×10-36]。
0.25 ml·L-1
(2)ZnFe2O4是一种性能优良的软磁材料,工业上常利用ZnFe2(C2O4)3·6H2O隔绝
空气加热分解制备,该晶体的热分解化学方程式为____________________________________________________________。
ZnFe2(C2O4)3·6H2O
测热分解后产品中ZnFe2O4的质量分数方法如下:取a g产品用硫酸溶解后加入足量KI溶液充分反应,调溶液至弱酸性,再加入淀粉指示剂,用c ml·L-1 Na2S2O3标准溶液滴定,用去此标准溶液V mL时,刚好达到滴定终点,则此产品中ZnFe2O4的质量分数为_________(用a、c、V表示)。
3.磁性氧化铁是电讯器材的重要原料,以高硫铝土矿(主要含Al2O3、Fe2O3、SiO2和少量的FeS2等)提取氧化铝和磁性氧化铁的流程如图:
已知:不同温度下,NH4Fe(SO4)2和NH4Al(SO4)2的溶解度(g/100 g H2O)如表:
(1)写出“焙烧Ⅱ”中Fe2O3发生反应的化学方程式:________________________________________________。(2)从滤液中获得NH4Al(SO4)2的操作是________________________________________。
Fe2O3+4(NH4)2SO4
蒸发浓缩、冷却结晶、过滤、
(3)“反应 Ⅲ ”在隔绝空气条件下进行,参与反应的n(FeS2)∶n(Fe2O3)=________。
根据流程图,焙烧Ⅱ中氧化铁和氧化铝与硫酸铵反应,发生非氧化还原反应,
反应Ⅲ中发生反应:FeS2+Fe2O3―→SO2↑+Fe3O4,据此分析。反应Ⅲ 中发生反应:FeS2+Fe2O3―→SO2↑+Fe3O4,令FeS2物质的量为a ml,Fe2O3物质的量为b ml,
(4)为测定Al2O3产品的纯度(Al2O3的质量分数),称量m g样品溶解于足量稀硫酸,配成100.00 mL溶液,取出20.00 mL溶液,加入c1 ml·L-1 EDTA标准溶液V1 mL,调节溶液pH并煮沸,
冷却后用c2 ml·L-1 CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液V2 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。则制得的Al2O3的纯度为____________________________________(用代数式表示)。
Al3+、Cu2+与EDTA反应的化学计量比均为1∶1,n(Al3+)+n(Cu2+)=n(EDTA),n(Al3+)=n(EDTA)-n(Cu2+)=V1×10-3 L×c1 ml·L-1-V2×10-3 L×c2 ml·L-1,根据原子守恒,
专题六 大题突破(二) 化工流程题的综合分析 2024年高考化学二轮复习课件+讲义: 这是一份专题六 大题突破(二) 化工流程题的综合分析 2024年高考化学二轮复习课件+讲义,文件包含专题六大题突破二化工流程题的综合分析pptx、专题六大题突破二化工流程题的综合分析教师版docx、专题六大题突破二化工流程题的综合分析docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
专题六 主观题突破 2.化工生产中物质转化条件的控制 2024年高考化学二轮复习课件+讲义: 这是一份专题六 主观题突破 2.化工生产中物质转化条件的控制 2024年高考化学二轮复习课件+讲义,文件包含专题六主观题突破2化工生产中物质转化条件的控制pptx、专题六主观题突破2化工生产中物质转化条件的控制教师版docx、专题六主观题突破2化工生产中物质转化条件的控制docx等3份课件配套教学资源,其中PPT共53页, 欢迎下载使用。
专题五 主观题突破 3.平衡体系中的有关计算 2024年高考化学二轮复习课件+讲义: 这是一份专题五 主观题突破 3.平衡体系中的有关计算 2024年高考化学二轮复习课件+讲义,文件包含专题五主观题突破3平衡体系中的有关计算pptx、专题五主观题突破3平衡体系中的有关计算教师版docx、专题五主观题突破3平衡体系中的有关计算docx等3份课件配套教学资源,其中PPT共49页, 欢迎下载使用。












